增加雷斯青霉15α-羥化酶基因拷貝數提高甾體轉化效率
李雪龍,李 改,謝東奇,金 鵬,毛淑紅,王正祥,劉曉光
(1.天津科技大學生物工程學院,天津 300457;2.天津科技大學化工與材料學院,天津 300457)
甾體藥物在臨床上主要用于治療類風濕性關節炎、哮喘、抗病毒、抗腫瘤和生育控制,此外還用于麻醉和心血管、淋巴白血病等疾病的治療,是僅次于抗生素的第二大類藥物[1-3].
孕激素中孕二烯酮避孕效果好、副作用小,是第三代高效口服避孕藥的主要成分[4-5].15α-羥基左旋乙基甾烯雙酮是合成口服避孕藥孕二烯酮的關鍵中間體,過去主要通過有機合成來完成;但化學合成具有反應步驟多且專一性不強、得率低、使用大量有機溶劑等缺點[6].目前工業上已采用微生物轉化的生產工藝,主要利用絲狀真菌雷斯青霉(Penicillium raistrickii)細胞催化直接在左旋乙基甾烯雙酮的C15α位引入羥基,合成15α-羥基左旋乙基甾烯雙酮[7].
課題組前期根據該菌種轉錄組測序的結果,從預測的61 個細胞色素P450 基因中篩選出15 個候選C15α-羥化酶CYP 基因,并利用實時熒光定量PCR定量擴增考察了甾體底物誘導與非誘導條件下候選基因的表達差異情況,最終確定了12820 和6138 兩個基因受甾體底物的高度誘導.甾體轉化實驗表明,6138 基因(簡稱8 號)對左旋乙基甾烯雙酮沒有轉化活性,而12820 基因能夠轉化左旋乙基甾烯雙酮,生成15α-羥基左旋乙基甾烯雙酮,表明12820 基因為15α-羥化酶基因.從雷斯青霉ATCC10490 中克隆鑒定了參與左旋乙基甾烯雙酮C15α-羥化反應的基因12820 (PRH),該基因編碼一種細胞色素P450 羥化酶[8],其羥化反應所需的電子由雷斯青霉NADPH-細胞色素P450 還原酶提供[9].
轉化效率偏低是目前工業上利用雷斯青霉轉化左旋乙基甾烯雙酮急需解決的問題(底物投料2 g/L,轉化60 h,摩爾轉化率75%).為了增加左旋乙基甾烯雙酮C15α-羥化效率,本文通過增加C15α-羥化酶基因PRH 的拷貝數以提高其表達水平.考慮大多數真菌的細胞色素P450 酶位于微球體的膜上,而8號預測編碼一個受甾體底物高度誘導的P450 酶,將PRH 基因定點整合至雷斯青霉ATCC10490 基因組的8 號基因位點,導致8 號基因失活.這樣一方面增加了15α-羥化酶基因的拷貝數,另一方面微球體膜可能有多余的空間容納過表達的目標C15α-羥化酶.鑒于雷斯青霉C15α-羥化酶基因的表達受底物左旋乙基甾烯雙酮的高度誘導[9-10],分別構建過表達載體pPZP-p800-PRH 和pPZP-TrpC-PRH,使PRH 基因的表達受本身的誘導型啟動子或外源組成型啟動子的控制,通過同源重組的方法定點整合到雷斯青霉的基因組,達到增加基因拷貝數的目的,以期獲得轉化效率提高的基因工程菌株.
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
雷斯青霉(Penicillium raistrickii)ATCC10490、根癌農桿菌(Agrobacterium tumefaciens)AGL-1,天津科技大學微生物菌種保藏中心.大腸桿菌(Escherichia coli)JM109 以及質粒pCSN44、pPZP-HYG2 均為本實驗保存.
1.1.2 酶與試劑
限制性內切酶(EcoRⅠ、NotⅠ、SacⅠ、HindⅢ、KpnⅠ)、SolutionⅠ連接試劑盒及Pyrobest DNA 聚合酶,Takara 公司;甲醇、乙腈、乙酸乙酯及石油醚,天津市化學試劑六廠;其他常規試劑為進口分裝或國產分析純.引物的合成及序列的測定由北京華大公司完成.
1.1.3 主要溶液及緩沖液
K buffer:用 1.25 mol/L K2HPO4溶液調節1.25 mol/L KH2PO4溶液的 pH=4.8,121 ℃滅菌20 min 備用.
MN buffer:3.0 g MgSO4·7H2O、1.5 g NaCl 溶于去離子水,定容至100 mL,121 ℃滅菌20 min 備用.
IM Trace elements:0.1 g ZnSO4·7H2O、0.1 g CuSO4·5H2O、0.1 g H3BO3、0.1 g MnSO4、0.1 g Na2MoO4·2H2O 溶于去離子水,定容至 100 mL,121 ℃滅菌20 min 備用.
APS+N:2.61 g KCl、7.48 g KH2PO4、29.75 g NaNO3用去離子水溶解,定容至100 mL,用5 mol/L的KOH 溶液調節pH=5.5,121 ℃滅菌20 min 備用.
CM Trace elements:2.1 g ZnSO4·7H2O、1.1 g H3BO3、0.5 g MnCl2·4H2O、0.5 g FeSO4·7H2O、0.17 g CuSO4·5H2O、0.15 g Na2MoO4·2H2O、5.1 g EDTA 用去離子水溶解,定容至100 mL,121 ℃滅菌20 min備用.
1.1.4 培養基
PDA 培養基(g/L):土豆200,葡萄糖20,115 ℃滅菌15 min.
LB 培養基(g/L):蛋白胨10,NaCl 10,酵母粉5,121 ℃滅菌20 min.
YPD 培養基(g/L):蛋白胨20,酵母粉10,葡萄糖20,115 ℃滅菌20 min.
誘導培養基(IM):900 mL 去離子水,121 ℃滅菌20 min.加入預先滅菌的K buffer 0.8 mL、MN buffer 20 mL、1%CaCl2溶 液 1 mL、0.01%FeSO4溶液10 mL、IM Trace elements 5 mL、20%NH4NO3溶液2.5 mL、1 mol/L MES 40 mL、50%甘油10 mL、20%葡萄糖10 mL,搖勻備用.固體培養基將去離子水中加入15 g 瓊脂粉,121 ℃滅菌20 min 備用.
真菌生長完全培養基(CM):在900 mL 去離子水中加入瓊脂粉15 g,121 ℃滅菌20 min.使用前用微波爐加熱至瓊脂完全溶解,然后加入預先滅菌的APS+N 20 mL、1 mol/L MgSO4溶液2 mL、CM Trace elements 1 mL、10%酪蛋白水解物10 mL、10%酵母浸出物50 mL、50%葡萄糖20 mL.
1.1.5 甾體化合物
左旋乙基甾烯雙酮(底物,英文縮寫 GD)和15α-羥基左旋乙基甾烯雙酮(產物,英文縮寫15α-OH-GD)均由北京紫竹藥業有限公司提供.
1.2 方法
1.2.1 雷斯青霉ATCC10490 重組菌的構建
為了將C15α-羥化酶基因PRH 定點整合至雷斯青霉ATCC10490 基因組的8 號位點[8],以雷斯青霉的8 號基因為同源臂,設計引物(8-L-F/R 和8-RF/R),以雷斯青霉基因組為模板,PCR 得到同源臂.用HindⅢ和XbaⅠ雙酶切質粒pCSN44,膠回收后得到潮霉素抗性基因(HYG,2.2 kbp).用SacⅠ和KpnⅠ雙酶切質粒pBluescript Ⅱ KS+,回收后得到3.0 kbp 的線性載體骨架片段.用引物(PRH-TT-F/R、p800-PRH-TT-F/R),以雷斯青霉基因組為模板,PCR擴增得到 PRH-TT 和p800-PRH-TT,用XbaⅠ和HindⅢ雙酶切HYG,獲得TrpC 啟動子.將上述酶切體系進行切膠回收,獲得目的片段與載體.
引物序列為 8-L-F:GGTACCTTCACTTTGCT TGGATTGAGCG,8-L-R:AAGCTTACTTGAGAT TACTGAGGATGATGG;8-R-F:GAATTCGCCGAAT AAGCAAGTCGAATG,8-R-R:GAGCTCGATAGTC TCGAACTTACTTGCGTC;PRH-TT-F:AAGCTTAT GGCTGTCCTCACCGAATTG,PRH-TT-R:GAATTC TTGTGCGGTCTGGAGTTCATG;p800-PRH-TT-F:TCTAGAGAGACTCAAGGCGTAGCTCCAG,p800-P RH-TT-R:GAATTCTTGTGCGGTCTGGAGTTCATG.
將回收的目的片段與載體連接分別得到重組質粒 pBlue-L-HYG、pBlue-p800-PRH-TT-R 和 pBlue-TrpC-PRH-TT-R.使用SacⅠ和XbaⅠ雙酶切重組質粒pBlue-L-HYG,膠回收片段pBlue-L-HYG;使用SacⅠ和 XbaⅠ分別雙酶切重組質粒 pBlue-p800-PRH-TT-R 和 pBlue-TrpC-PRH-TT-R,膠回收片段p800-PRH-TT-R 和 TrpC-PRH-TT-R.將 pBlue-LHYG 分別與p800-PRH-TT-R 和TrpC-PRH-TT-R 兩個片段進行連接,將連接產物分別轉化 E.coli JM109,得到相應的重組質粒:pBlue-L-HYG-p800-PRH-TT-R 和pBlue-L-HYG-TrpC-PRH-TT-R.
采取DNA 體外重組的方法分別構建雷斯青霉甾體15α-羥化酶的2 個表達載體:pPZP-L-HYGp800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R.
1.2.2 雷斯青霉ATCC10490 孢子懸液的制備
用接種環將雷斯青霉ATCC10490 的孢子劃線接種于PDA 試管斜面上,28 ℃培養3~5 d.待孢子成熟后,用預先滅菌的1 mol/L 山梨醇溶液洗滌,用滅菌的玻璃珠將其打散(震蕩約15~30 min),用血球計數板計數,再稀釋至相應濃度,分裝,4 ℃保存備用.
1.2.3 根癌農桿菌AGL-1 的轉化和培養
將重組菌(pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R)通過電擊轉化的方法轉入根癌農桿菌AGL-1 感受態中,挑取長勢良好的轉化子,進行菌落PCR 驗證.PCR 引物為HYGF/HYG-R,HYG-F:GTACCTGTGCATTCTGGGTAA ACG,HYG-R:TGTTTATCGGCACTTTGCATCGGC.
將驗證成功的陽性單克隆轉化子在LB(含卡那霉素50 μg/mL)平板上劃線,28 ℃培養72 h 后放于4 ℃備用.
將根癌農桿菌接種于5 mL LB 液體培養基中,28 ℃、200 r/min 搖床培養24 h 后,轉接于裝有50 mL LB 液體培養基的250 mL 的搖瓶中,28 ℃、200 r/min搖床培養至A600=0.8;5 000 r/min 離心10 min,棄上清液.使用IM 培養基重懸菌體,28 ℃、200 r/min 搖床誘導培養5 h.將誘導好的根癌農桿菌與雷斯青霉孢子懸液按體積比1:1 均勻混合,涂布于IM 平板上,25 ℃共培養48 h.用1 mL 生理鹽水將菌絲洗下,并用涂布器打碎涂布于CM 平板上.
1.2.4 雷斯青霉過表達轉化子的篩選與驗證
待CM 平板上生長出單菌落,在其產孢前,隨機挑選雷斯青霉陽性轉化子于含300 μg/mL HYG 抗性的PDA 平板進行復篩,于28 ℃培養箱培養3~5 d.挑取長勢良好的菌落于含有300 μg/mL HYG 抗性的PDA 試管斜面中,28 ℃培養箱培養3~4 d.待試管中轉化子產生孢子后,用生理鹽水將孢子洗下并保菌.余下的孢子懸液接種于PDA 液體培養基培養菌絲,提取雷斯青霉轉化子的基因組,并以雷斯青霉出發菌株基因組作為對照,以L-F、HYG-R 為引物進行PCR 驗證.L-F:CAGAAACTTCTCGACAGACG T,HYG-R:GATCTTCCAAACCACATAGGTG.
1.2.5 重組雷斯青霉PRH 基因的拷貝數檢測
本課題組前期從雷斯青霉ATCC10490 中克隆鑒定了參與左旋乙基甾烯雙酮C15α-羥化反應的基因12820(PRH),根據PRH 基因的cDNA 的序列設計目的基因的引物PRH-F 和PRH-R,根據轉錄組測序結果中提供的內參cDNA 基因序列設計一對特異性引物tublin-F 和tublin-R,該基因是雷斯青霉整個生長過程中表達穩定的內參基因.PRH-F:GAATTCATG GCTGTCCTCACCGAAT,PRH-R:CTCGAGCTACT CTCCCAAGAAACTCA;Tublin-F:AACCATCTCCG GTGAGCACG,Tublin-R:GCATGCAGATATCGTAC AGAGC.
將過表達PRH 基因與內參基因進行實時熒光定量 PCR(Real-time PCR).反應體系(20 μL):2×SYBR Green Mix 10 μL,ROX 0.4 μL,上、下游引物(10 μmol/L)各0.5 μL,模板(基因組)1 μL,dd H2O 7.6 μL.反應條件:95 ℃ 10 min,95 ℃ 15 s,60 ℃1 min,40 個循環.實驗過程中Ct 值表明擴增產物的熒光信號達到設定閾值時所經過的擴增循環數,利用每個模板的Ct 值與該模板起始拷貝數的對數存在的線性關系,以檢測不同菌株之間表達差異.表達差異倍數按照文獻[11]方法計算.
1.2.6 雷斯青霉重組菌的甾體轉化實驗
鑒于雷斯青霉C15α-羥化酶基因的表達受底物左旋乙基甾烯雙酮的高度誘導,其PRH 基因前面是誘導型啟動子.為提高雷斯青霉對甾體底物的轉化效率,后續實驗中在PRH 基因前面添加一個組成型啟動子TrpC.為了初步探索重組菌的甾體15α-羥基化活性,將雷斯青霉出發菌株、誘導型PRH-p800 重組菌株和組成型PRH-TrpC 重組菌株各1 mL(計數為107)到30 mL YPD 培養基中,24 h 后加入2 g/L 的左旋乙基甾烯雙酮,分別誘導轉化12、24、36、48、60、72、84 h,28 ℃、180 r/min 培養,適時取樣測定轉化率.
1.2.7 硅膠薄層層析(TLC)分析
取1 mL 菌體發酵液,加入500 μL 的乙酸乙酯混勻,12 000 r/min 離心3 min,取上清液(乙酸乙酯層)200 μL,用直徑為0.2 mm 的毛細管點樣于硅膠層析板上.在距層析板邊緣 1 cm 處點樣,樣點間距0.5 cm.在展開之前用展開劑將層析缸飽和30 min.將點有樣品的硅膠板放入層析缸中展開,加蓋,密封,待展開劑前沿快到頂端時,取出點樣板,烘干.采用紫外檢測儀觀察轉化產物.
1.2.8 轉化產物的高效液相色譜(HPLC)分析
取樣萃取后靜置,取100 μL 上層有機相于干凈的1.5 mL EP 管中,待乙酸乙酯揮發完,加入100 μL乙腈溶解后用0.22 μm 膜過濾.色譜條件:色譜柱為C18 柱(4.6 mm×250 mm,5 μm),流動相為乙腈-水溶液(體積比為4:1),流量0.8 mL/min,柱溫25 ℃,進樣量10 μL,檢測波長240 nm.
1.2.9 雷斯青霉重組菌轉化效率測定
通過色譜圖中生物轉化產物曲線下的峰面積確定獲得的HGD 的質量.GD 到15α-OH-GD(HGD)的摩爾轉化率按照式(1)計算[12].
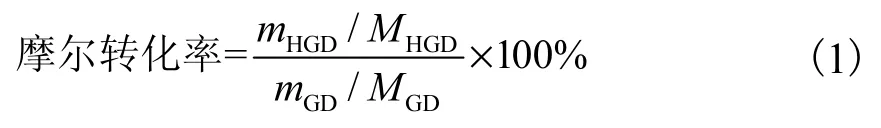
式中:mHGD和mGD分別為HGD 和GD 的質量,MHGD和MGD分別為HGD 和GD 的相對分子質量.
2 結果與分析
2.1 雷斯青霉ATCC10490 誘導型啟動子與組成型啟動子過表達載體的構建
為了改進現有生產菌種雷斯青霉ATCC10490 轉化GD 合成15α-OH-GD 的效率,探討增加目標基因PRH 拷貝數對 GD 轉化活性的影響.首先構建GD15α-羥化酶基因PRH 的表達載體,表達載體構建示意圖如圖1 所示.
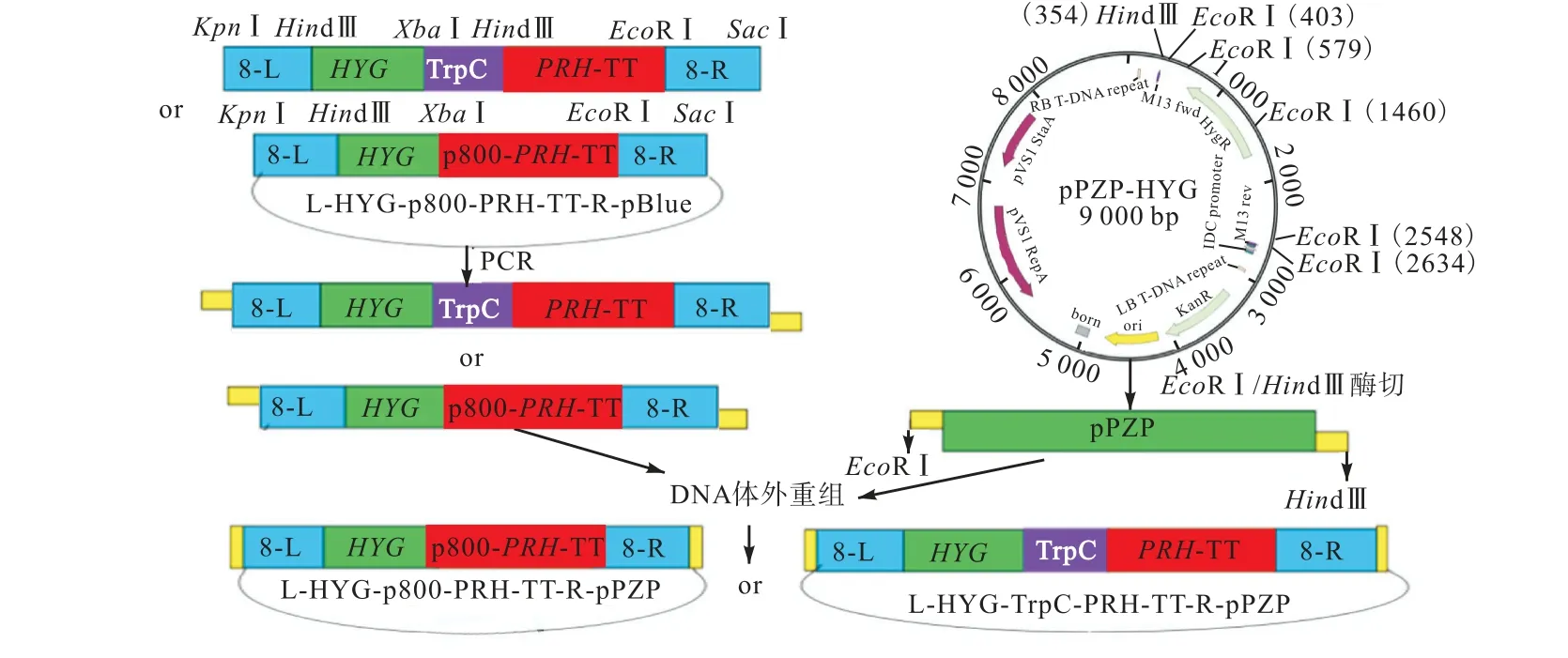
圖1 過表達載體構建示意圖Fig.1 Schema of overexpression vector construction
構建的過表達載體,將重組質粒分別進行酶切分析.載體pPZP 為6.7 kbp,其中HYG 抗性基因及其啟動子為 2.2 kbp,p800-PRH-TT 片段為 3.3 kbp,TrpC-PRH-TT 片段為2.8 kbp.經XhoⅠ/XbaⅠ雙酶切后,瓊脂糖凝膠電泳結果(圖2(a))顯示約10 kbp的載體片段和3.3 kbp 的目的基因片段,證實過表達載體構建成功,命名為pPZP-L-HYG-p800-PRH-TTR.而經HindⅢ單酶切后3 個片段應為7.9、2.7、2.5 kbp.酶切電泳結果(圖2(b))顯示所得片段大小與理論值一致,證實PRH 基因組成型過表達載體構建成功,表達載體命名為pPZP-L-HYG-TrpC-PRHTT-R.

圖2 過表達載體的酶切驗證Fig.2 Enzymatic digestion verification of overexpression vector
2.2 雷斯青霉過表達載體轉化根癌農桿菌
將過表達載體pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R 電轉至已經制備好的根癌農桿菌感受態中.因為載體在根癌農桿菌AGL-1 中的拷貝數較低,因此無法通過質粒提取的方法驗證載體是否成功轉化至根癌農桿菌,需通過菌落PCR 的方法驗證載體是否成功轉化至根癌農桿菌AGL-1.PCR 結果如圖3 所示,菌落PCR 得到約2.1 kbp 的條帶,與HYG 基因設計引物PCR 預測結果大小一致,證實過表達載體pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R 已經成功轉入根癌農桿菌AGL-1 中.
2.3 雷斯青霉重組菌株的鑒定
利用根癌農桿菌介導雷斯青霉ATCC10490 轉化,將15α-羥化酶基因PRH 表達盒轉入雷斯青霉中,通過同源重組定點整合的方式增加雷斯青霉PRH 基因的拷貝數.同源重組的原理及基因重組菌株驗證策略見圖4.將過表達重組菌株的基因組作為模板,以L-F、HYG-R 為引物進行PCR 驗證.擴增結果如圖5 所示,PCR 產物大小約為1.2 kbp 條帶,與理論結果大小一致,表明成功得到了過表達PRH 基因重組菌株.
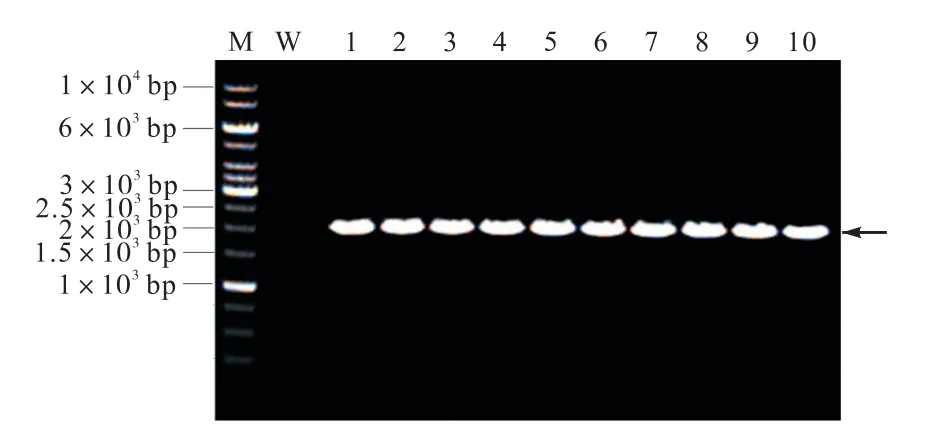
圖3 根癌農桿菌AGL-1 pPZP-L-HYG-p800-PRH-TTR 和pPZP-L-HYG-TrpC-PRH-TT-R 轉化子菌落PCR驗證Fig.3 PCR verification of the A.tumefaciens AGL-1 transformants of pPZP-L-HYG-p800-PRH-TT-R and pPZP-L-HYG-TrpC-PRH-TT-R
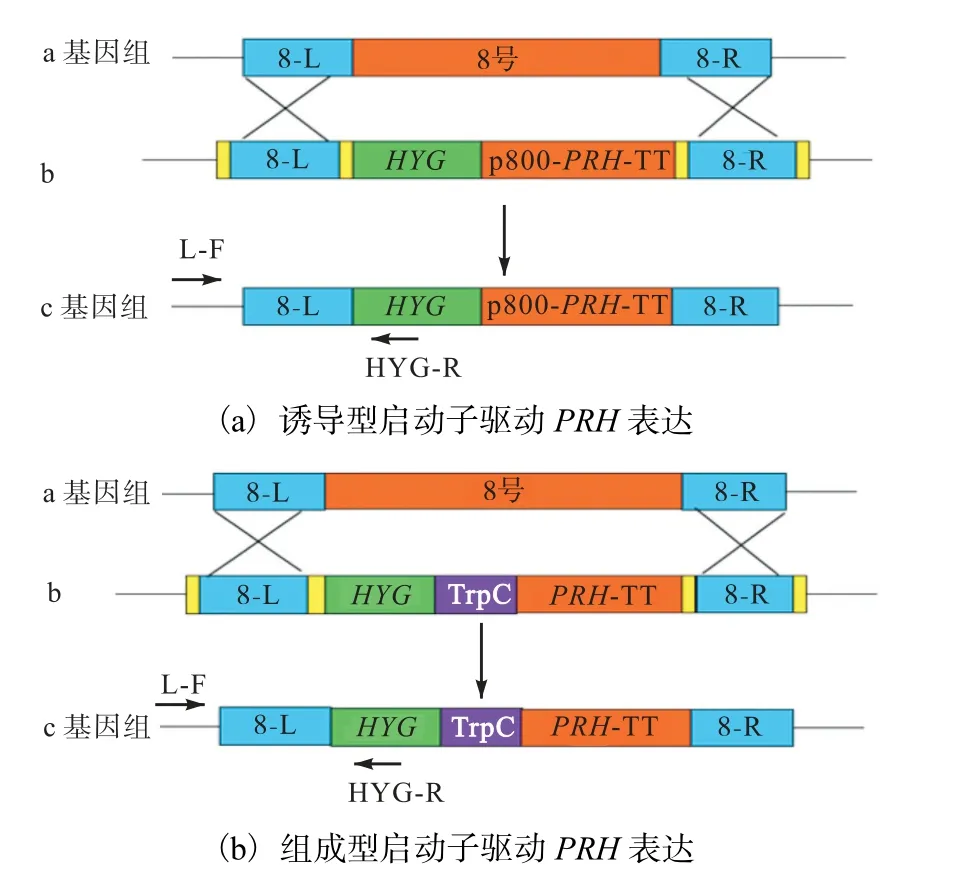
圖4 PRH-P800和PRH-TrpC基因表達盒定點整合Fig.4 Targeted integration of PRH-P800 and PRH-TrpC expression cassette
2.4 PRH 過表達重組菌株拷貝數的確定
利用實時定量PCR 檢測野生型菌株、誘導型菌株PRH-P800 和組成型菌株PRH-TrpC 的PRH 基因拷貝數.基因組DNA 定量PCR 擴增結果(圖6)顯示:如果將野生型菌株PRH 基因的相對拷貝數定量為1.001 5,則菌株PRH-P800 的PRH 基因相對拷貝數為 2.043 3,菌株 PRH-TrpC 的相對拷貝數為1.846 2.這說明重組菌的PRH 基因相對拷貝數是野生菌的2 倍,達到預期結果.
圖5 重組菌PCR驗證Fig.5 PCR validation of recombined strains
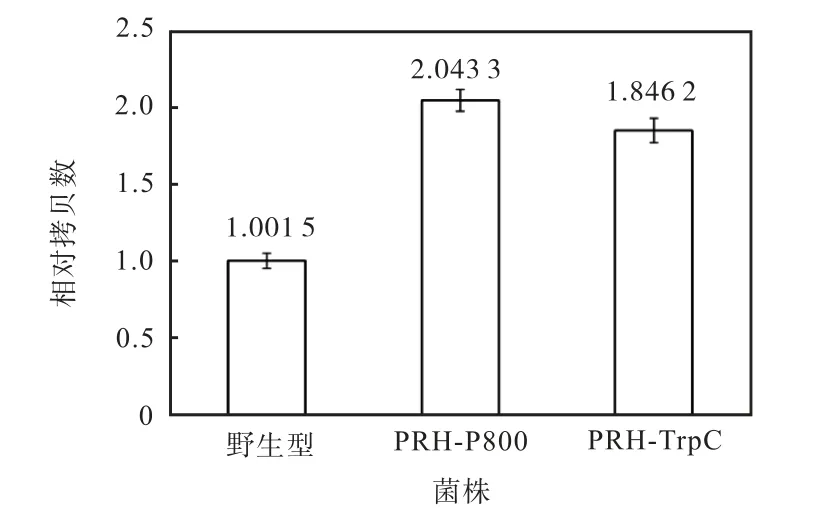
圖6 雷斯青霉重組菌株PRH 基因拷貝數的定量PCR測定Fig.6 Determination of PRH copy number in P.raistrickii recombined strains with qPCR
2.5 增加甾體羥化酶基因一個拷貝對轉化效率的影響
為了考察雷斯青霉重組菌株的左旋乙基甾烯雙酮15α-羥基化活性,比較了野生型菌株、誘導型啟動子重組菌株PRH-P800 和組成型啟動子重組菌株PRH-TrpC 在底物投樣量為2 g/L 時左旋乙基甾烯雙酮轉化情況.15α-羥化酶的特異性強,在轉化產物中幾乎沒有副產物產生,但是在工業上轉化效率偏低,增加甾體羥化酶基因一個拷貝后,與野生型菌株相比較,過表達PRH 基因重組菌株對左旋乙基甾烯雙酮的轉化效率明顯提高.實驗結果如圖7 所示,重組菌PRH-TrpC 在48 h 左右摩爾轉化率最高達到90%,重組菌PRH-P800在48 h 左右摩爾轉化率達到85%,而野生型菌株在60 h 左右才達到75%.以上結果表明PRH 基因重組菌株PRH-P800 同出發菌株相比摩爾轉化率高出13%,PRH-TrpC 同出發菌株相比摩爾轉化率高出20%,而且轉化時間均縮短了12 h.
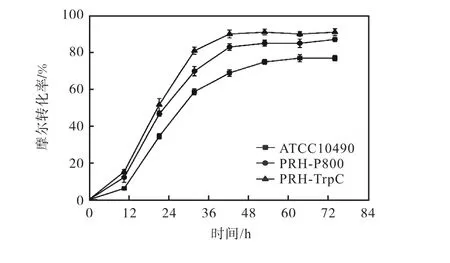
圖7 不同雷斯青霉過表達PRH 基因重組菌株的GD轉化曲線Fig.7 Transformation curves of GD by PRH-overexpressing recombined P.raistrickii strains
3 結 語
本文考察了增加雷斯青霉ATCC10490 C15α-羥化基因PRH 的拷貝數對轉化左旋乙基甾烯雙酮效率的影響.分別構建了PRH 基因的誘導型和組成型過表達載體pPZP-P800-PRH 和pPZP-TrpC-PRH,并通過同源重組的方法定點整合到雷斯青霉基因組.轉化實驗表明,在出發菌株中增加一個PRH 基因拷貝顯著提高了甾體左旋乙基甾烯雙酮轉化效率,重組菌PRH-P800 和PRH-TrpC 的摩爾轉化率分別提高了13%和20%,同時轉化時間均縮短了12 h.

