膿毒癥患者28 d死亡率的相關因素分析
秦 妮, 米 婷, 段亞楠
(陜西省西安市中心醫院 重癥醫學科, 陜西 西安, 710000)
膿毒癥屬于宿主對感染產生調節失常性反應,在細菌、真菌感染后,機體固有免疫將對病原體迅速產生應答,一但非特異性免疫作用未能在早期控制感染,將代償性過度活化免疫細胞及相關細胞因子、補體成分,造成正常組織細胞損傷[1], 異常激活凝血系統,生理性抗凝作用受到抑制,可繼發循環功能障礙與彌散性血管內凝血[2], 加重膿毒癥病情。作為臨床重癥監護單元(ICU)收治對象的重要組成部分,隨著抗生素濫用影響的不斷擴大,全球范圍內膿毒癥患病率以9%的年均增幅上漲,每年有數以百萬計的新發膿毒癥患者面臨死亡[3]。盡管如此,由于不同區域膿毒癥患者存在流行病學、文化環境、經濟水平及一般情況的差異,既往針對膿毒癥死亡患者的研究結論并不完全一致[4]。本研究對本院膿毒癥患者28 d內死亡的相關危險因素進行分析,現將結果報告如下。
1 資料與方法
1.1 一般資料
回顧性分析2016年4月—2019年3月本院收治的168例膿毒癥患者臨床資料。納入標準: ① 存在明確感染,且臨床癥狀、化驗結果均符合膿毒癥相關診斷標準[5]; ② 年齡≥18歲; ③ 臨床資料完整。排除標準: ① 收入ICU后48 h內死亡或轉出; ② 診斷出自身免疫性疾病、免疫缺陷性疾病或終末期肝臟、腎臟疾病; ③ 3個月內服用免疫調節劑或化療藥物; ④ 妊娠期或哺乳期婦女。根據確診后28 d內存活情況分為死亡組(n=71)與存活組(n=97)。
1.2 研究方法
回顧入選患者病例資料,分別錄入以下項目作為統計變量: ① 基線資料,包括年齡、性別、收入ICU危重程度[急性生理與慢性健康Ⅱ(APACHEⅡ)評分][6]、合并癥; ② 血清生化指標(以收入ICU時所測為研究內容),包括白蛋白(Alb)、C反應蛋白(CRP)、葡萄糖(Glu)、乳酸(Lac)、丙氨酸氨基轉移酶(ALT)、肌酐(SCr)、D-二聚體(D-D)、維生素D(VitD); ③ 干預措施,包括機械通氣、血液凈化等。
1.3 統計學處理
將所得數據資料錄入SPSS 20.0進行處理,連續變量通過Kolmogorov-Smirnov正態性檢驗均已證實近似服從正態分布,故以平均值±標準差描述,組間單因素比較采用獨立樣本t檢驗; 分類變量以[n(%)]描述,組間單因素比較采用Pearson卡方檢驗; 將檢驗所得有統計學意義的單因素納入Logistic多因素回歸模型去除混雜偏倚,回歸方法選擇“向前Wald”, 篩選出有意義的變量作為獨立影響因素; 將獨立影響因素數據錄入Medcalc 18.2繪制受試者工作特征(ROC)曲線以探討對終點事件的預測效能,獲取曲線下面積(AUC)、置信區間(95%CI)、最大Youden指數及cut-off值(僅限其中的連續變量)。
2 結 果
2.1 2組膿毒癥患者臨床資料比較
死亡組年齡、APACHEⅡ評分、惡性腫瘤率、心力衰竭率、休克率、機械通氣率、血液凈化率及血清CRP、Lac、ALT、SCr、D-D水平均顯著大于存活組,而血清VitD水平則顯著低于存活組(P<0.05或P<0.01), 見表1。
2.2 多因素回歸分析
多因素Logistic回歸分析結果顯示,年齡、APACHEⅡ評分、休克、CRP、Lac均是膿毒癥患者28 d死亡的獨立危險因素(OR>1,P<0.05), 而VitD是其獨立保護因素(OR<1,P<0.05), 見表2。
2.3 獨立危險因素變量的ROC曲線
年齡、APACHEⅡ評分、休克、CRP、Lac、VitD預測膿毒癥患者28 d死亡的ROC曲線AUC分別為0.645、0.732、0.630、0.676、0.707、0.738, 均顯著大于參考線AUC(P<0.05), 其中屬于連續變量的年齡、APACHEⅡ評分、CRP、Lac、VitD的cut-off值分別為59歲、24分、37.99 mg/L、3.31 mmol/L、29.73 ng/L, 見圖1、表3。

表1 死亡組與存活組患者臨床資料比較
APACHEⅡ評分: 急性生理與慢性健康Ⅱ評分;
Alb: 白蛋白; CRP: C反應蛋白; Glu: 葡萄糖; Lac: 乳酸;
ALT: 丙氨酸氨基轉移酶; SCr: 肌酐; D-D: D-二聚體;
VitD: 維生素D。與死亡組比較, *P<0.05, **P<0.01。
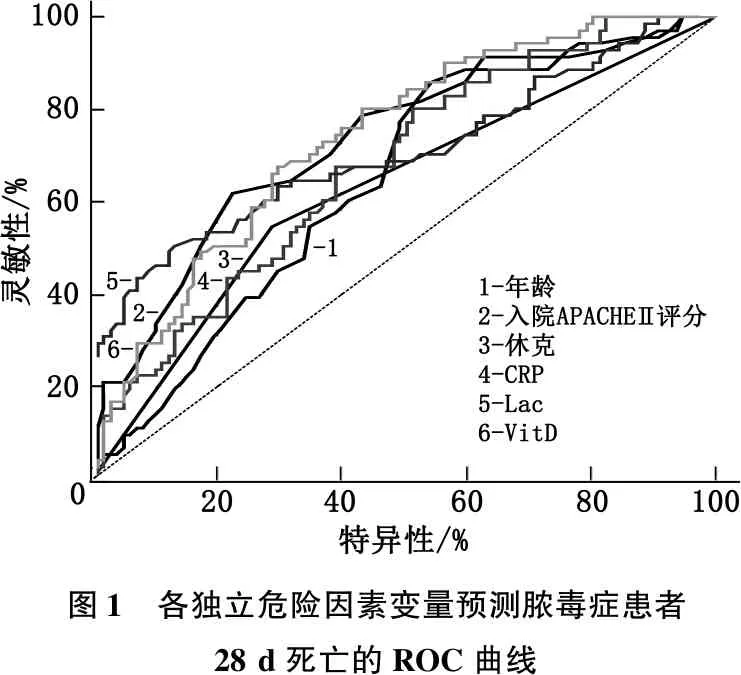
圖1 各獨立危險因素變量預測膿毒癥患者28 d死亡的ROC曲線
3 討 論
膿毒癥好發于各年齡段人群,老年人由于存在免疫功能低下、并發癥較多、營養不良、院前身體狀態較差等生理特點,其膿毒癥易感體質較為突出[7]。由于老年膿毒癥患者與年輕患者在治療策略上并不具備特殊性,疾病管理趨于一致,其預后治療結局與生活質量往往較年輕患者更差[8], 尤其伴有心力衰竭、糖尿病、腦血管或外周血管疾病的老年患者,身體對治療措施的反應更不明確,并已通過Meta分析指出該類患者具有更高的ICU入住率、住院時間與病死率[9]。

表2 膿毒癥患者28d死亡的多因素的Logistic回歸模型
APACHEⅡ評分: 急性生理與慢性健康Ⅱ評分; CRP: C反應蛋白; Lac: 乳酸; VitD: 維生素D。

表3 ROC曲線相關參數
休克屬于各種強烈致病因素作用于機體后致循環功能急劇減退,而導致的組織器官微循環灌注嚴重不足,生命器官機能、代謝障礙性全身性危重化病理過程[10]。據相關文獻[11]報道,膿毒性休克發生早期重要器官缺血、缺氧尚不十分嚴重,整體需氧與攝氧平衡還能基本維持,醫護人員需及時對其病情變化做出準確判斷,第一時間采取應對措施,增加其搶救成功率。本研究結果顯示,年齡≥59歲、APACHEⅡ評分≥24分、發生休克均是導致膿毒癥患者28 d內死亡的獨立危險因素,這表明年齡越大或病情越嚴重的膿毒癥患者死亡風險越高,臨床需在收治患者時及早通過APACHEⅡ對其病情進行評價,觀察是否存在休克相關體征變化,并以此為據采取有效干預措施,積極改善患者預后。
CRP是一種肝臟合成的急性時相反應蛋白,能通過激活補體系統與淋巴細胞發生特異性結合,限制淋巴細胞過度活化效應,并提高巨噬細胞吞噬活性,代償性減少炎癥損傷對機體的損害作用,通常炎癥反應越劇烈,其表達水平越高[12]。既往研究[13]也通過測定其水平來鑒別膿毒性休克、膿毒癥、普通感染患者及健康受試者,其診斷ROC曲線AUC可達0.745, 較白細胞計數(WBC)的0.698更為理想,可作為膿毒癥病情評估的血清標志物。本研究中,血清CRP≥37.99 mg/L被證實是引起膿毒癥患者28 d內死亡的高危因素,提示早期檢測CRP能反映出膿毒癥患者病情演進階段,從而指導臨床干預策略的制定與實施。
Lac是人體組織在缺氧情況下產生的無氧代謝產物,是器官功能障礙的標志物之一,目前已在膿毒癥與膿毒性休克液體復蘇治療中作為常用的療效描述性動態觀測指標[14]。部分研究[15]指出,膿毒癥患者繼發Lac中度升高或高乳酸血癥并不單純由組織低灌注、低氧狀態所致,還可能由心臟驟停、酮癥酸中毒或惡性腫瘤等原因引起,其水平高于4 mmol/L提示膿毒癥患者院內死亡的風險提高5.53倍。本研究也通過Logistic多因素回歸分析發現,血清Lac≥3.31 mmol/L是導致膿毒癥患者28 d內死亡的獨立危險因素,這說明積極監測膿毒癥患者Lac水平變化有助于指導其早期液體復蘇與抗生素治療思路,并實現早期識別與分層管理。
VitD缺乏與病毒、細菌感染的相關性已被臨床所廣泛認同,但國內研究對膿毒癥病情影響的研究還停留在新生兒范疇,低VitD膿毒癥患兒預后與免疫功能均不能達到預期理想水平[16]。有國外學者[17]指出,危急重癥患者由于缺乏VitD,其甲狀旁腺亢進明顯,且由于機體缺少通過VitD抑制炎癥因子表達的機制,抗生素治療耐藥性更為突出,住院時間有所延長,也更傾向于獲得不良治療結局[18-19]。本研究發現,血清VitD水平≥29.73 ng/L可作為膿毒癥患者28 d內死亡的獨立保護因素[20],這提示確保患者住ICU期間攝入充足的VitD能保障其免疫功能恢復效率與抗感染治療有效性,促進病情轉歸,降低其近期死亡率。
綜上所述,膿毒癥患者28 d死亡率受年齡、APACHEⅡ評分、休克、CRP、Lac、VitD等因素獨立影響,臨床可圍繞上述變量開展早期病情評估、相關指標監測及干預措施優化。

