Drp1和自噬在七氟醚后處理大鼠心肌保護中的作用
王一珍,賀建東2,韓沖芳2,郭大鵬,王志豪
作為一種使用安全、有效性穩定的吸入性麻醉劑,七氟醚自誕生以來逐漸成為日常麻醉工作中重要的麻醉藥物[1]。研究證實七氟醚具有一定程度的心肌保護作用,而其中的作用機制尚未明確[2]。自噬是機體清除受損細胞器、維持內環境穩定的機制,大量研究已證實自噬參與心肌缺血再灌注損傷(myocardial ischemia and reperfusion injury,MIRI)的各個階段[3]。動力相關蛋白1(dynamin-related protein 1,Drp1)是位于細胞質中介導細胞分裂的蛋白,被證實具有介導自噬并保護心肌的作用[4]。由此假設七氟醚對大鼠MIRI的保護作用與Drp1及自噬有關,本實驗擬通過建立大鼠MIRI模型,給予七氟醚后處理并測定相關心肌損傷指標及蛋白表達,探究Drp1和自噬在七氟醚后處理大鼠心肌保護中的作用。
1 材料與方法
1.1 實驗動物及分組 本實驗動物由北京華阜康生物科技股份有限公司提供,健康成年雄性SD大鼠45只,體重200~230 g,以隨機數字表法分為假手術組(Sham組)、缺血再灌注組(I/R組)和七氟醚后處理組(SpostC組),各15只。所有實驗操作均已獲得山西醫科大學動物倫理委員會許可。
1.2 心肌缺血再灌注實驗模型制備 45只大鼠由20%烏拉坦以0.6 mL/100 g麻醉后固定于無菌保溫操作臺,四肢連接針狀電極,由BL NewCentury機能實驗系統記錄其心率(HR)、心電圖(ECG)。頸正中切口入路行氣管切開術,連接小型動物呼吸機(成都泰盟軟件有限公司,型號HX-101E),調整呼吸參數為頻率60次/min,潮氣量2~3 mL/100 g,吸呼比1∶2,氧流量1 L/min,七氟醚揮發罐一端與氧氣管連接,一端與動物呼吸機連接,待生命體征穩定后開始實驗。采用文獻[5]方法制備大鼠MIRI模型,于大鼠胸骨左緣心尖搏動最強處剪開胸骨暴露心臟,以7-0帶針縫線沿左心耳下方找到冠狀動脈左前降支(LAD)穿過,穩定15 min后開始實驗。Sham組僅于LAD下穿線而不結扎,觀察150 min;I/R組在LAD下穿過縫線后,在縫線末端穿過聚乙烯導管,拉緊縫線結扎LAD,以結扎部位以下心肌發白,ECG示ST段抬高為缺血模型成功,30 min后松開扎線,以蒼白部位轉紅、ST段下移為再灌注成功,觀察120 min;SpostC組于再灌注前吸入2.5%七氟醚5 min后進行再灌注,觀察120 min。
1.3 2,3,5-氯化三苯基四氮唑(TTC)法測量心肌梗死面積 每組5只大鼠于再灌注結束后再次結扎冠狀動脈,于右頸內靜脈注入伊文氏藍染液1 mL,觀察大鼠口唇和四肢藍染2 min后取下心臟,洗凈血液,于-20 ℃短暫冰凍20 min后取出,垂直于心臟長軸將心臟均勻切成2 mm左右切片,經過TTC染色、固定后制成切片,圖像經掃描后由ImageJ軟件進行分析計算,藍色為非缺血區,紅色為缺血危險區,灰白色為壞死區。計算心肌梗死面積(infraction size,IS)值,IS=心肌梗死區占總截面百分比/危險區占總截面百分比。
1.4 Drp1及微血管相關蛋白輕鏈3-Ⅱ(LC3-Ⅱ)蛋白表達測定(Western-blot法) 余10只大鼠于再灌注結束后迅速在冰上稱取心肌心尖部組織,以清潔剪刀將組織剪碎,并將其放入裂解液,經過裂解、離心后取上清液,按照BCA蛋白檢測試劑(Thermo Scientific,23225)說明進行蛋白質濃度檢測,計算上樣量,隨后進行蛋白電泳、轉模、孵育,后加入一抗Drp1多克隆抗體(1∶1 000,ABclonal,A2470)和LC3B-兔多克隆抗體(1∶1 000,proteintech,18725-1-AP)4 ℃孵育過夜、漂洗,后孵育HRP山羊抗兔二抗(1∶2 000,ABclonal,AS014)并漂洗。最后進行顯影、定影、成像。使用ImageJ量化圖像,并使用Photoshop處理圖像,得到經典WB條帶形式。
1.5 病理切片染色形態學觀察 取下蛋白檢測材料同時再取部分心尖部組織,用蘇木精-伊紅染色法(hematoxylin-eosin staining,HE)經過多聚甲醛固定、乙醇脫水、石蠟包埋、切片等一系列加工后將其制成切片,并將適量中性樹膠封固切片,標記后用光學顯微鏡觀察心肌細胞形態學,明確心肌細胞凋亡及損傷程度。

2 結 果
2.1 3組大鼠心肌梗死面積比較 與Sham組比較,I/R組和SpostC組大鼠心肌梗死面積均增大(P<0.01);與I/R組比較,SpostC組大鼠心肌梗死面積減少(P<0.05)。詳見表1。
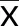

組別只數 IS值 Sham組50.1±0.5I/R組537.0±1.21)SpostC組526.3±2.61)2)
與Sham組比較,1)P<0.01;與I/R組比較,2)P<0.05
2.2 3組大鼠Drp1、LC3-Ⅱ蛋白表達水平比較 I/R組與SpostC組Drp1、LC3-Ⅱ表達水平較Sham組升高(P<0.05);與I/R組比較,SpostC組Drp1、LC3-Ⅱ表達水平明顯下降(P<0.05)。詳見表2。
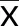
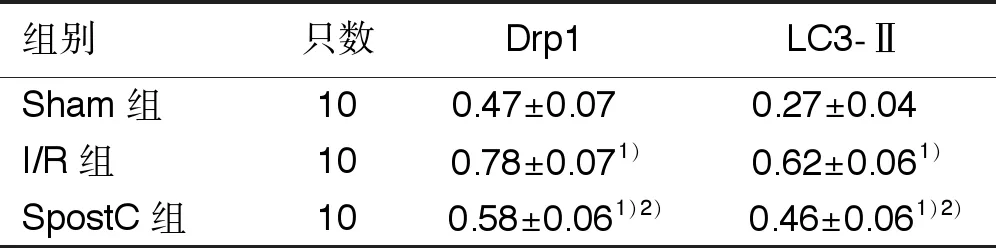
組別只數Drp1LC3-ⅡSham組 100.47±0.07 0.27±0.04 I/R組100.78±0.071)0.62±0.061)SpostC組 100.58±0.061)2)0.46±0.061)2)
與Sham組比較,1)P<0.05;與I/R組比較,2)P<0.05
2.3 心肌HE染色結果 光鏡下可見Sham組心肌細胞形態正常,心肌纖維排列整齊,染色較均勻,細胞核居中;I/R組心肌細胞形態改變,心肌纖維排列紊亂,可見部分纖維斷裂,細胞核破壞,可見較多炎性細胞,染色不均勻;與I/R組比較,SpostC組心肌細胞形態較正常,心肌纖維排列較整齊,可見細胞質輕度破壞,胞核相對完整,炎性細胞減少。詳見圖1。

圖1 3組大鼠心肌細胞HE染色結果(×400)
3 討 論
本實驗參照文獻[5]的方法,以結扎大鼠心肌冠狀動脈左前降支30 min,放松120 min的方法制備心肌缺血再灌注損傷模型。研究結果顯示,I/R組在結扎后出現心電圖ST段抬高、結扎部位以下區域變白,并于松開扎線后ST段下移,蒼白區域變紅,120 min再灌注后心肌發生梗死,主要表現為IS值的增大及病理染色心肌細胞形態的變化,提示心肌缺血再灌注模型建立成功。
自噬主要由Beclin-1-Vps34和mTORC1兩條通路介導,整個自噬過程分為自噬發動、自噬小泡形成、自噬體膜延伸、自噬體融合和降解、自噬終止5個過程[6]。而LC3-Ⅰ位于細胞質中,在自噬發動后,在自噬相關蛋白7(Atg7)和自噬相關蛋白5(Atg5)的作用下形成LC3-Ⅱ,參與自噬體膜的融合延伸,LC3-Ⅱ的增加(或同時伴LC3-Ⅰ的減少)是自噬表達上調的典型標志[7]。Drp1作為代表細胞分裂的蛋白,同時被發現具有介導自噬的作用[4]。本研究發現,Sham組存在Drp1及LC3-Ⅱ蛋白低水平的表達,表明在正常心肌細胞代謝過程中存在一定程度的細胞分裂和自噬,其存在可能與維持細胞正常能量代謝有關[8]。
自噬在心肌缺血再灌注過程中的作用是一個變化的過程,在心肌缺血階段,一定程度的自噬可保護心肌免于缺氧損傷,而再灌注過程中,過度上調的自噬加速了心肌細胞的死亡[9-10]。本實驗發現I/R組心肌LC3-Ⅱ及Drp1表達均上調,心肌細胞IS值增大且病理染色出現損傷變化,表明再灌注期間Drp1及自噬表達上調,對心肌細胞造成損害。當給予七氟醚后處理后,Drp1及LC3-Ⅱ蛋白表達水平下降,提示心肌細胞分裂及自噬下調,且心肌細胞損傷程度減輕,表現在IS值下降及病理HE染色改變,提示七氟醚后處理能夠減輕MIRI,同時下調Drp1及LC3-Ⅱ的表達,減輕心肌細胞自噬,進一步提示Drp1及自噬在七氟醚后處理心肌保護中具有重要作用。
本實驗為在體實驗,無法排除在體神經、體液等復雜因素對實驗結果的影響,應進一步進行離體實驗進行探究;隨著對細胞分裂及自噬的進一步深入研究,應行細胞培養及相關基因敲除實驗,進一步探究七氟醚心肌保護的細胞機制,更加深入了解其相關信號蛋白轉導通路。

