艾灸預處理天樞穴對潰瘍性結腸炎大鼠結腸TLR4/TRIF信號通路調節作用的研究
楊玲,黃艷,黃任佳,馬曉芃,馬喆,劉雅楠,鄭寒丹,朱毅,劉慧榮,王照欽,吳璐一
(1.上海市針灸經絡研究所,上海 200030;2.上海中醫藥大學附屬岳陽中西醫結合醫院,上海 200437;3.上海中醫藥大學針灸免疫效應重點研究室,上海 200030)
潰瘍性結腸炎(ulcerative colitis, UC)是一種病因未明的慢性非特異性腸道炎性疾病,好發于年輕人,病程慢性遷延且易反復發作,臨床治愈率低并有癌變的可能,嚴重影響患者的生活質量。UC屬于現代難治病,發病機制尚未完全闡明,主要與遺傳易感性、腸黏膜屏障缺陷、免疫反應失調、環境因素等有關[1]。
Toll樣受體(Toll-like receptors, TLRs)是最早被發現的一類模式識別受體(pattern recognition receptors, PRRs),是連接天然免疫和特異性免疫的跨膜信號轉導受體家族,其最突出的生物學功能是促進細胞因子的合成與釋放,引發炎癥反應[2]。TLR4是TLRs家族中研究最為廣泛的一種,活化的TLR4可激活MyD88依賴性信號轉導通路,TLR4通過招募主要接頭蛋白MAL(TIRAP)和MyD88,激活IKKα、IKKβ等一系列蛋白磷酸化激酶,導致轉錄因子 NF-κB激活并入核而啟動炎癥因子基因表達[3-4]。對MyD88基因敲除小鼠的研究發現,MyD88基因敲除小鼠對LPS仍有反應性,仍能激活NF-κB的信號轉導,表明TLR4介導的信號轉導通路中除了MyD88依賴性途徑外,還存在MyD88非依賴途徑[5]。β干擾素 TIR結構域銜接蛋白(TRIF)是和MyD88同樣具有 TIR結構域結構的接頭蛋白,在 TLR4介導的MyD88非依賴途徑中起關鍵作用。研究發現UC患者結腸黏膜中TLR4表達顯著升高,且與UC的發生發展有關[6-9]。以TLR4為靶點,尋找UC的特異性療法,可能是UC防治的一個切入點。
艾灸具有抗炎、調節機體免疫的作用,在UC的臨床應用中具有一定的優勢[10-11]。“艾灸預處理”屬于中醫治未病的范疇,應用于 UC的防治,可拓展艾灸的臨床應用范圍。課題組前期研究發現,艾灸預處理能夠調節 UC大鼠腸黏膜屏障相關蛋白,降低炎癥反應,改善UC大鼠結腸的病理狀態,達到預防UC的目的[12]。基于前期研究基礎,本研究擬從TLR4介導的MyD88非依賴途徑——TLR4/TRIF信號通路角度,探討艾灸預處理“天樞”穴防治UC的免疫機制。
1 材料和方法
1.1 實驗對象
清潔級 Sprague Dawley(SD)大鼠 28只,體質量(180±20)g,委托上海中醫藥大學實驗動物中心訂購,并提供適宜的飼養環境:12 h晝夜節律交替、室溫(20±2)℃,室內濕度 50%~70%,所有實驗操作均在上海中醫藥大學動物倫理委員會指導下進行。
1.2 主要藥物和試劑
1.3 實驗分組
大鼠適應性飼養1周后,采用完全隨機設計方法,分成正常組、模型組、隔藥灸預處理組和溫和灸預處理組,每組7只。
1.4 干預方法
本實驗共分為兩個階段干預,第一階段為預處理階段,第二階段為模型制備階段。
艾灸預處理(第 1~7天):隔藥灸預處理組,行隔藥灸干預;溫和灸預處理組,行溫和灸干預;正常組、模型組不予干預,只做與隔藥灸預處理組相同的抓取與固定。隔藥灸預處理干預方法:將藥餅(直徑1 cm、厚度0.5 cm)置于大鼠天樞穴區,上置艾炷(重量為90 mg)施灸,每日1次,每次每穴灸2壯,連續灸7 d;溫和灸預處理方法:采用大鼠實驗專用艾條(直徑 7 mm、長120 mm,重 2 g)距離天樞穴 2 cm處施灸,間隔 2 min刮取艾灰1次,每日1次,每次每穴灸10 min,連續灸7 d。
模型制備(第8~14天):隔藥灸預處理組、溫和灸預處理組、模型組,均予 4%DSS水溶液連續飲用制備UC模型[13];正常組不予處理。
1.5 標本的采集和處理
大鼠予腹腔注射2%的戊巴比妥鈉(30~40 mg/kg)麻醉處理后,暴露大鼠腹腔,分離結腸,自恥骨聯合處—盲腸取下整段結腸,沿腸系膜縱行剖開,予生理鹽水輕柔漂洗后肉眼觀察結腸大體形態,自下而上截取結腸6~8 cm,分成兩部分,一部分固定于4%多聚甲醛固定液中,用于形態學觀察;剩余部分置于液氮1 h后轉移至-80℃冰箱保存備用。
1.6 指標檢測
1.6.1 結腸組織病理學觀察
結腸組織切片采用HE染色后,于光學顯微鏡下觀察大鼠結腸組織病理學變化。主要步驟包括切片常規脫蠟至水,二甲苯Ⅰ、Ⅱ各 20 min;100%、95%、90%、80%、70%乙醇各5 min;雙蒸水5 min×2次;蘇木素浸染2~3 min;流水沖洗10 min;1%鹽酸乙醇分化1~2 s;流水沖洗5 min;伊紅浸染2~3 min;70%、80%、90%、100%乙醇各1~2 s;二甲苯Ⅰ、Ⅱ各15 min;封片,置于光學顯微鏡下觀察。
綜上所述,肝局灶性結節增生是發病率較低的一類良性占位病變,該疾病不是真正的腫瘤疾病,發病原因還不清楚,女性患者發病率比男性高。臨床中對肝局灶性結節性增生患者使用CT平掃和增強掃描的效果比較好,能夠很好的觀察分析患者的病理特征和供血情況,對患者的血管腫瘤鑒別效果比較理想,有些特殊影像特征會對診斷帶來一些影響,臨床中應該要引起重視。
1.6.2 TLR4、IRF3、TRAF6蛋白表達的檢測
采用免疫組織化學檢測法檢測。取大鼠結腸組織石蠟切片,依次經脫蠟、水化、抗原修復、封閉等流程后滴加一抗:TLR4(濃度 1:50);IRF3(濃度 1:100);TRAF6(濃度 1:200),4℃冰箱過夜后滴加二抗孵育,完成PBS沖洗、DAB顯色、蘇木素染色、脫水等流程后封片。在光學顯微鏡下隨機選擇3~5個視野進行圖像信息的采集,采用Image-Plus Pro 6.0軟件對采集的圖像進行分析,計算出每張切片的平均光密度值(AOD),AOD=積分光密度(IOD)/陽性目標陽性面積(Area)。
1.6.3 TRIF、IKK蛋白表達的檢測
采用免疫印跡檢測法檢測。取大鼠結腸組織經研磨、RIPA裂解、離心取上清等流程后,采用BCA蛋白定量法測定各樣本蛋白濃度,調整各樣本濃度一致、變性后,經電泳,轉膜后加入封閉液(5%脫脂奶粉)室溫封閉 1 h,加入一抗:TRIF(濃度為 1:1000);IKK(濃度為1:2000),4℃孵育過夜,洗膜后分別加入對應的二抗,室溫孵育1 h,于暗室中用X膠片感光、顯影、定影。
1.7 統計學方法
采用SPSS24.0統計軟件進行統計學分析。符合正態分布的計量資料用均數±標準差表示,組間比較采用單因素方差分析法;不符合正態性分布者以中位數(四分位數)[Median(P25, P75)]表示,組間比較采用非參數檢驗法。所有檢驗采用雙側檢驗,以α=0.05為檢驗水準,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠結腸組織病理學觀察結果
正常組可見結腸黏膜結構清晰,上皮組織完整,腺體排列整齊,杯狀細胞清晰可見,無炎性細胞浸潤,未見充血、水腫;模型組可見結腸黏膜結構不清,上皮脫落,腺體破壞,杯狀細胞基本消失,黏膜及黏膜下層可見大量的炎性細胞浸潤,伴有充血、水腫;隔藥灸預處理組、溫和灸預處理組結腸黏膜結構亦有不同程度的破壞,上皮均較為完整,腺體部分破壞,杯狀細胞部分消失,黏膜及黏膜下層可見炎性細胞浸潤,伴有輕度充血、水腫(圖1)。
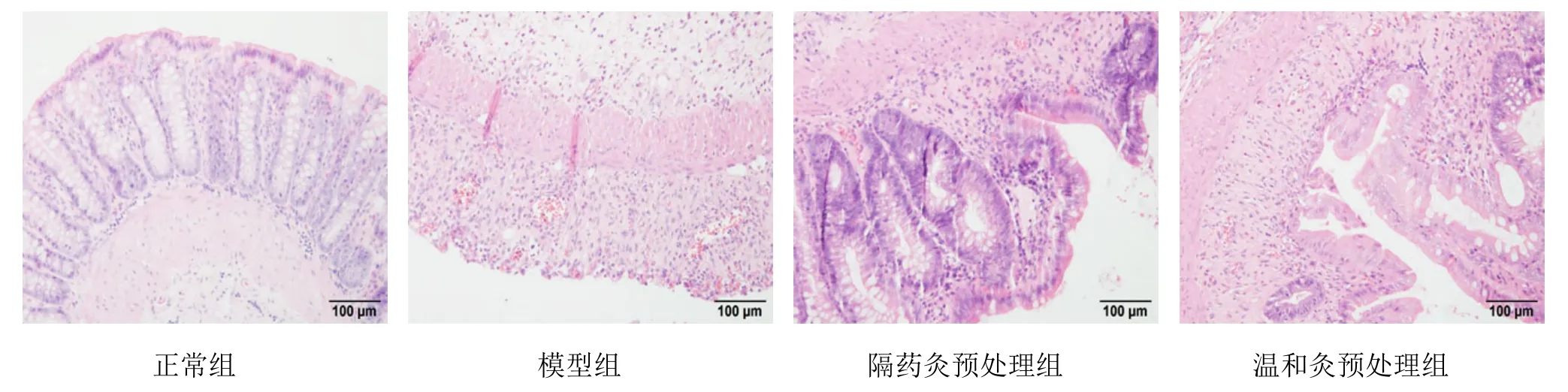
圖1 大鼠結腸組織病理學檢測結果
2.2 各組大鼠結腸組織TLR4免疫組化檢測結果
TLR4蛋白主要表達在黏膜層、黏膜下層及固有層的胞質及胞膜中,為彌漫性棕黃色顆粒。正常組 TLR4蛋白表達較弱;模型組TLR4蛋白大量表達于黏膜層、黏膜下層及固有層的胞質及胞膜中,且染色深,分布密集;隔藥灸預處理組、溫和灸預處理組大鼠結腸組織TLR4蛋白在黏膜層、黏膜下層及固有層的胞質及胞膜亦有不同程度的陽性表達(圖2)。定量結果表明,與正常組比較,模型組大鼠結腸組織TLR4蛋白表達顯著升高,差異有統計學意義(P<0.05);與模型組比較,隔藥灸預處理組、溫和灸預處理組大鼠結腸組織TLR4蛋白表達均顯著降低,差異均有統計學意義(P<0.05);與隔藥灸預處理組比較,溫和灸預處理組大鼠結腸組織TLR4蛋白表達差異無統計學意義(P>0.05)(表1)。
表1 各組大鼠結腸組織TLR4蛋白表達 (±s)
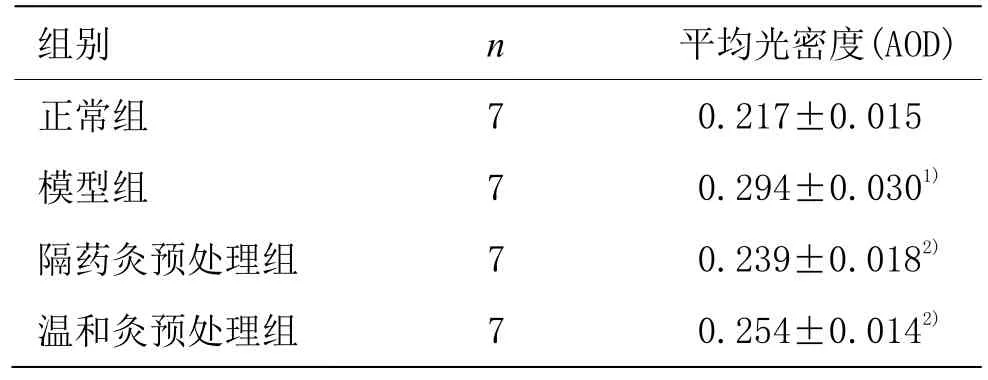
表1 各組大鼠結腸組織TLR4蛋白表達 (±s)
注:與正常組比較1)P<0.05;與模型組比較2)P<0.05
組別 n 平均光密度(AOD)正常組 7 0.217±0.015模型組 7 0.294±0.0301)隔藥灸預處理組 7 0.239±0.0182)溫和灸預處理組 7 0.254±0.0142)
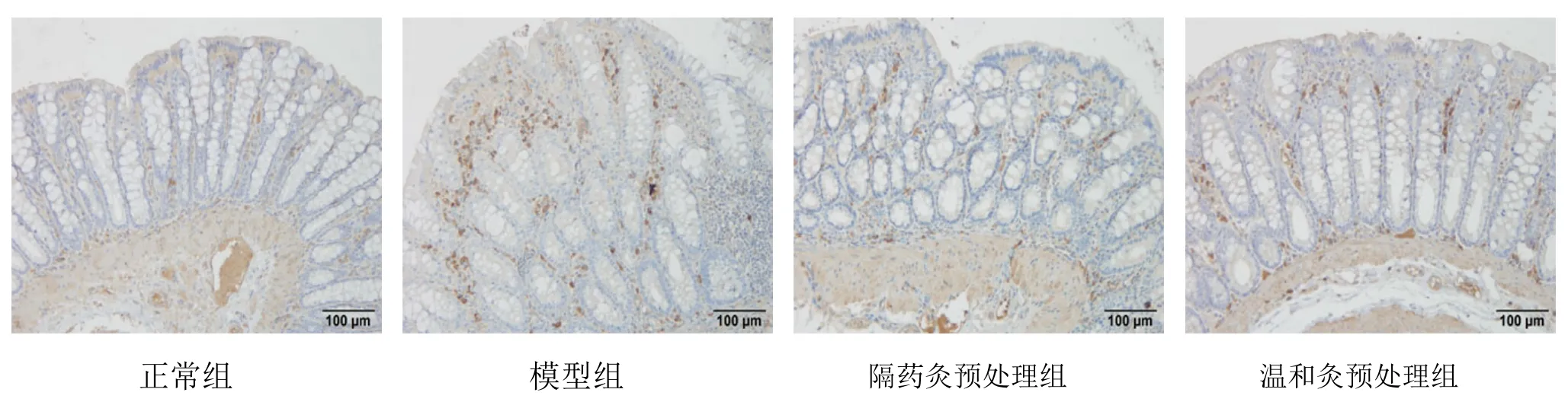
圖2 各組大鼠結腸組織TLR4免疫組化檢測結果
2.3 各組大鼠結腸組織TRIF免疫印跡檢測結果
表2 各組大鼠結腸組織TRIF蛋白表達 (±s)
注:與正常組比較1)P<0.05;與模型組比較2)P<0.05
組別 n 蛋白表達量(Fold change)正常組 7 0.418±0.451模型組 7 1.287±0.8631)隔藥灸預處理組 7 0.529±0.5222)溫和灸預處理組 7 0.522±0.2372)
與正常組比較,模型組大鼠結腸組織TRIF蛋白表達顯著升高,差異有統計學意義(P<0.05);與模型組比較,隔藥灸預處理組、溫和灸預處理組大鼠結腸組織TRIF蛋白表達均顯著降低,差異均有統計學意義(P<0.05);與隔藥灸預處理組比較,溫和灸預處理組大鼠結腸組織TRIF蛋白表達差異無統計學意義(P>0.05)(表2,圖 3)。
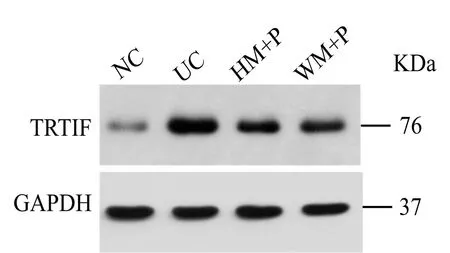
圖3 各組大鼠結腸組織TRIF免疫印跡檢測結果
2.4 各組大鼠結腸組織TRAF6免疫組化檢測結果
TRAF6蛋白主要表達在黏膜層胞質及胞膜中,為棕黃色顆粒。正常組僅有少量TRAF6蛋白表達在黏膜層胞質及胞膜中;模型組 TRAF6蛋白大量表達于黏膜層胞質及胞膜中,部分呈胞核表達,且染色深,分布密集;隔藥灸預處理組、溫和灸預處理組大鼠結腸組織TRAF6蛋白大量表達在黏膜層胞質及胞膜中有不同程度的陽性表達,亦可見少量胞核表達(圖4)。定量結果表明,與正常組比較,模型組大鼠結腸組織TRAF6蛋白表達顯著升高,差異有統計學意義(P<0.05);與模型組比較,隔藥灸預處理組、溫和灸預處理組大鼠結腸組織 TRAF6的表達均顯著降低,差異均有統計學意義(P<0.05),與隔藥灸預處理組比較,溫和灸預處理組大鼠結腸組織 TRAF6蛋白表達差異無統計學意義(P>0.05)(表 3)。
表3 各組大鼠結腸組織TRAF6蛋白表達 (±s)
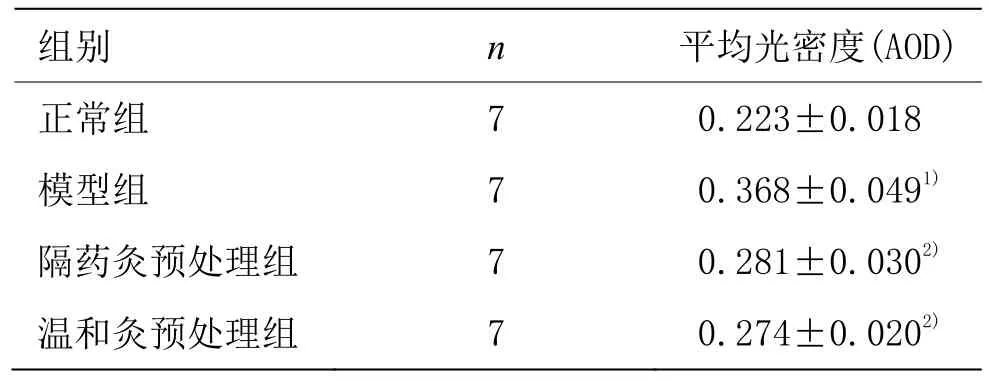
表3 各組大鼠結腸組織TRAF6蛋白表達 (±s)
注:與正常組比較1)P<0.05;與模型組比較2)P<0.05
組別 n 平均光密度(AOD)正常組 7 0.223±0.018模型組 7 0.368±0.0491)隔藥灸預處理組 7 0.281±0.0302)溫和灸預處理組 7 0.274±0.0202)
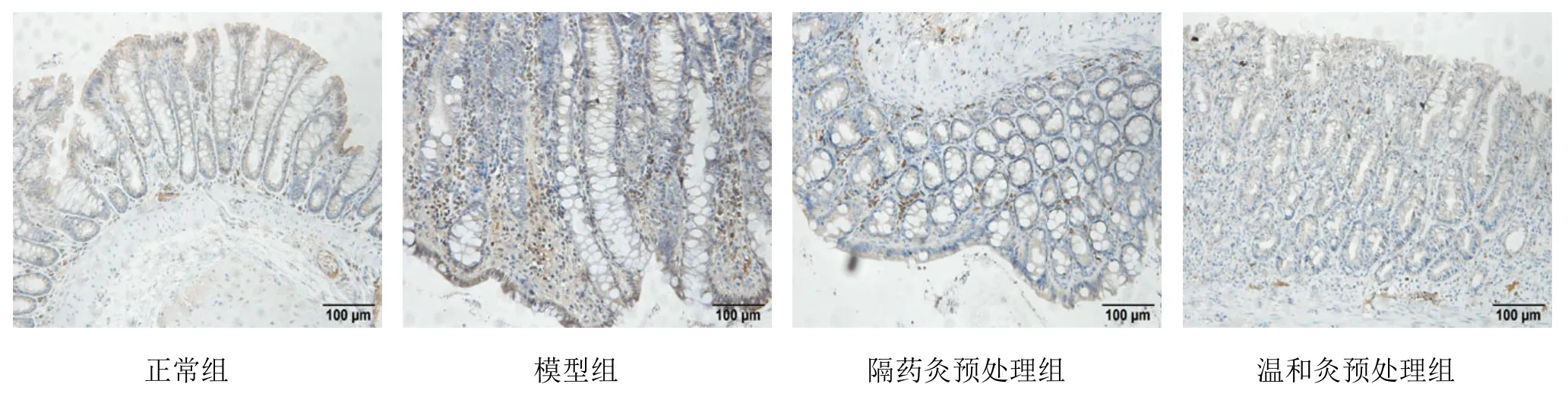
圖4 各組大鼠結腸組織TRAF6免疫組化檢測結果
2.5 各組大鼠結腸組織IRF3免疫組化檢測結果
IRF3蛋白主要表達在黏膜層的胞漿及胞膜中,為棕黃色顆粒。正常組IRF3蛋白均勻表達在黏膜層胞漿及胞膜中,未見胞核表達;模型組 IRF3蛋白部分表達于黏膜層胞漿及胞膜中,部分呈胞核表達,且染色深,分布密集;隔藥灸預處理組、溫和灸預處理組結腸組織IRF3蛋白在黏膜層胞質及胞膜中均有不同程度的表達,亦可見少量胞核表達(圖 5)。定量結果表明,與正常組比較,模型組大鼠結腸組織IRF3蛋白表達顯著升高,差異有統計學意義(P<0.05);與模型組比較,隔藥灸預處理組、溫和灸預處理組大鼠結腸組織IRF3的表達均顯著降低,差異均有統計學意義(P<0.05);與隔藥灸預處理組比較,溫和灸預處理組大鼠結腸組織IRF3蛋白表達差異無統計學意義(P>0.05)(表4)。
表4 各組大鼠結腸組織IRF3表達 (±s)
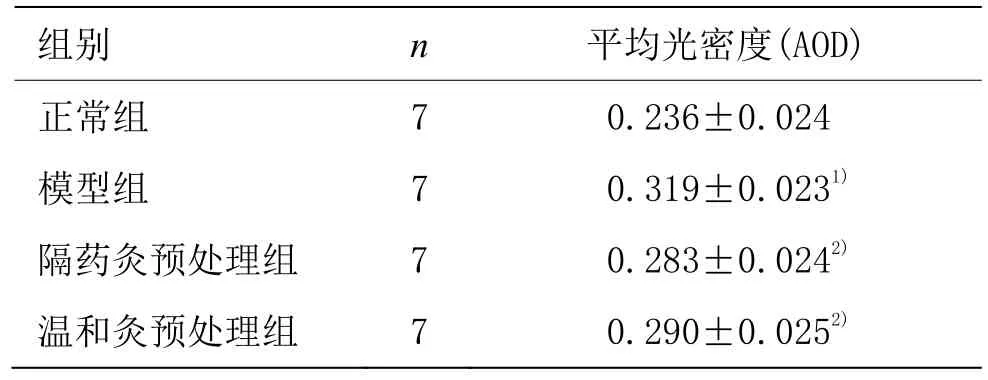
表4 各組大鼠結腸組織IRF3表達 (±s)
注:與正常組比較1)P<0.05;與模型組比較2)P<0.05
組別 n 平均光密度(AOD)正常組 7 0.236±0.024模型組 7 0.319±0.0231)隔藥灸預處理組 7 0.283±0.0242)溫和灸預處理組 7 0.290±0.0252)
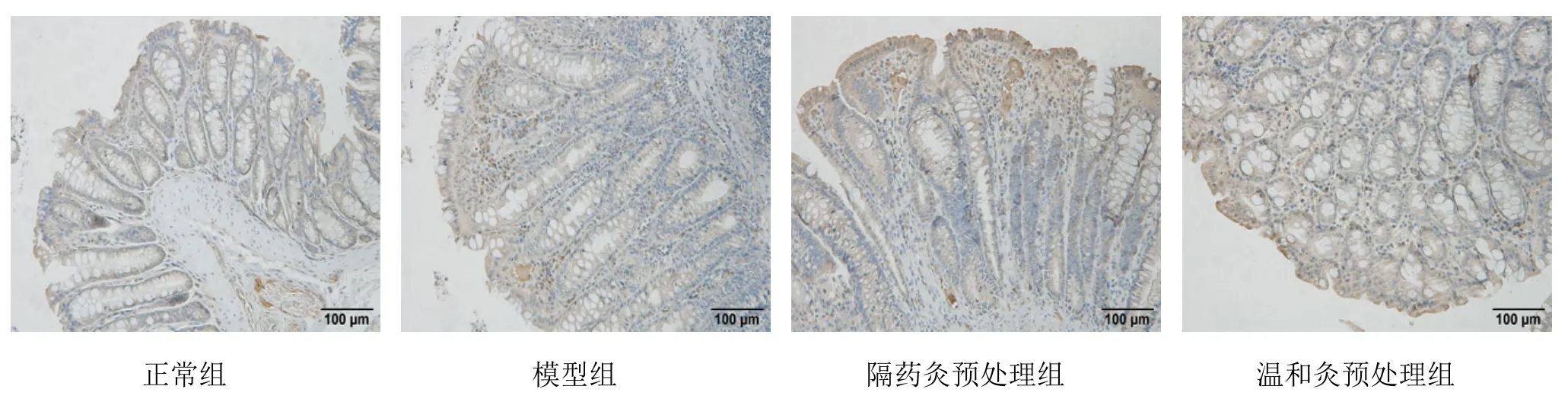
圖5 各組大鼠結腸組織IRF3免疫組化檢測結果
2.6 各組大鼠結腸組織IKK免疫印跡檢測結果
與正常組比較,模型組大鼠結腸組織 IKK蛋白表達顯著升高,差異有統計學意義(P<0.05)。與模型組比較,隔藥灸預處理組大鼠結腸組織 IKK蛋白表達顯著降低,差異有統計學意義(P<0.05);溫和灸預處理組大鼠結腸組織 IKK蛋白表達雖降低,但差異無統計學意義(P>0.05)(表5,圖6)。
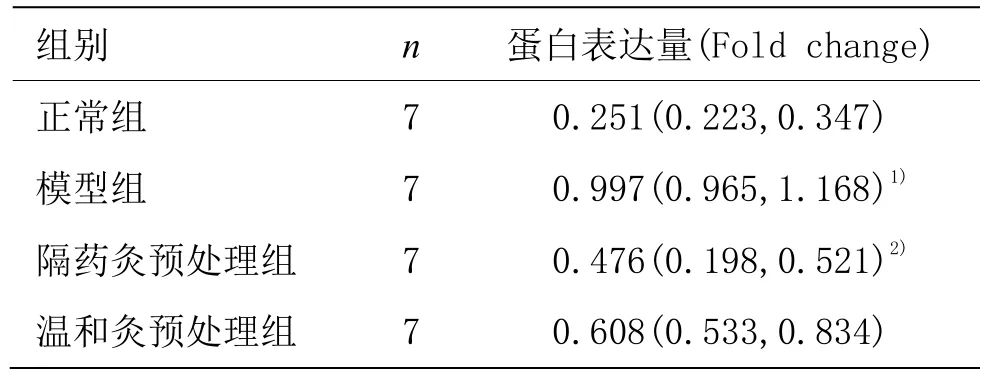
表5 各組大鼠結腸組織IKK蛋白表達[Median(P25,P75)]
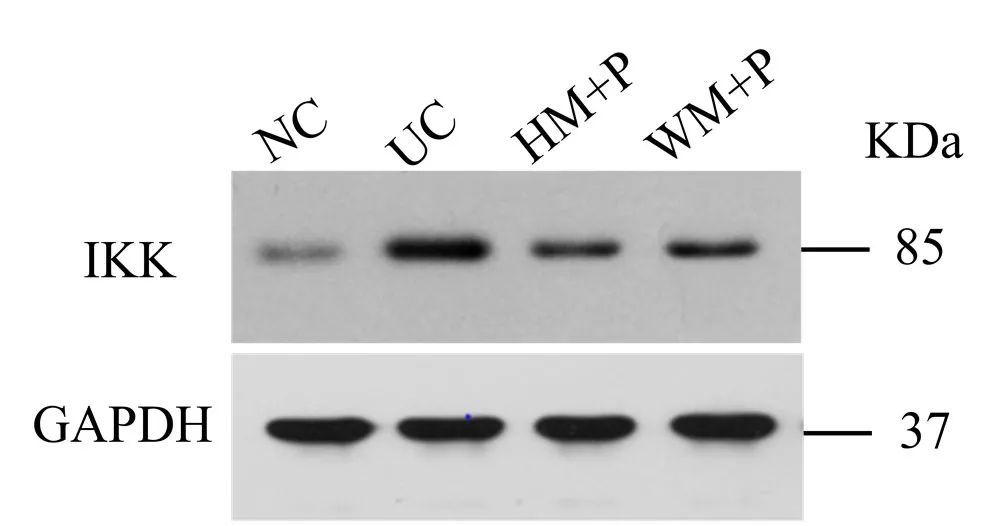
圖6 各組大鼠結腸組織IKK免疫印跡檢測結果
3 討論
潰瘍性結腸炎屬于臨床難治病,西醫治療主要采用免疫抑制劑、糖皮質激素等藥物,但此類藥物臨床療效不理想且反復使用后會打亂機體正常的免疫機制。作為中醫藥特色療法中的一種,艾灸療法經過數千年的更迭,仍生生不息。隔藥灸療法屬于艾灸療法的一種,通過艾火的溫熱之性并協同藥物功效來共同發揮治療作用[14-15];溫和灸療法因具有治療安全、有效、無毒副反應、經濟、易操作、患者依從性高等多種優點,臨床應用也較為廣泛[16-17]。兩種艾灸療法均是在經絡理論的指導下應用于臨床治療疾病,通過刺激腧穴局部,促進腧穴局部氣血的恢復,并通過經絡的作用調節全身,溫養臟腑,達到溫經散寒、活血通絡、調和陰陽的作用。天樞穴作為大腸之募穴,能疏調腸腑、理氣行滯,善治腸腑疾病。古代天樞穴常應用于泄瀉、痢疾、腹痛、便秘的治療,善于健脾和胃、理氣散寒補虛;現代研究發現,天樞穴用于治療消化系統相關性疾病的比例最高,是治療UC最常用的腧穴之一[18-20]。
艾灸治療 UC的療效顯著,在調節機體免疫平衡,改善腸道黏膜病變,控制腸道炎癥中起重要作用[21-23]。艾灸治療UC的機制研究結果提示,艾灸可糾正結腸黏膜的病理性改變,重建人體免疫系統內環境的平衡及穩定性,調整黏蛋白比例,有效地糾正結腸黏膜病變,控制 UC腸道炎癥[24-26]。艾灸預處理即“逆灸”,它以中醫學“治未病”思想為主要理論基礎,通過艾灸穴位激發經絡之氣,提高機體抗病能力,從而達到防止疾病的發生、減輕后續疾病的損害和保健延年的目的[27-29]。現代醫學研究中,“針灸良性預應激假說”較好地闡釋了艾灸預處理的作用機制,認為艾灸預處理的作用機制可能與現代應激學說密切相關[30]。
研究表明 TLRs最突出的生物學功能是促進細胞因子的合成與釋放,引發炎癥反應。TLR4是TLRs家族中研究最為廣泛的一種,與UC的發生發展密切相關。TLR4C端包含一個 Toll/IL-1受體(Toll/IL-1receptor, TIR)結構域,TIR與IL-1受體家族成員具有較高的同源性,主要用來激活下游信號通路,在免疫應答的誘導和炎性反應中發揮重要作用。TRIF是和MyD88同樣具有TIR結構域結構的接頭蛋白,因此,本研究聚焦TLR4介導的MyD88非依賴途徑開展研究,即從TLR4/TRIF通路探討艾灸預處理干預UC的免疫機制。研究結果發現UC模型組大鼠TLR4蛋白明顯升高,病理學檢測結果顯示模型組大鼠黏膜層有大量炎性細胞浸潤,潰瘍,炎癥反應明顯,與既往研究結果一致;而隔藥灸預處理組和溫和灸預處理組大鼠 TLR4蛋白明顯降低,病理學檢測結果顯示炎性細胞浸潤和潰瘍面積較模型組明顯減少,表明艾灸預處理參與調控TLR4蛋白的表達,且與UC炎癥反應相關。TRIF在TLR4介導的MyD88非依賴途徑中具有關鍵作用,其N末端結合結構域可與腫瘤壞死因子受體相關因子 6(TNF receptorassociated factor 6, TRAF6)結合,激活IKK復合體,活化IκB,導致NF-κB入核引起炎癥反應[31-33]。本研究通過對TLR4/TRIF通路中TRAF6和IKK蛋白的觀察發現,隔藥灸預處理組可以降低這兩種蛋白的表達,溫和灸預處理組能降低TRAF6蛋白表達。以上結果提示艾灸預處理可能通過調節TLR4/TRIF通路中相關蛋白的表達,降低UC的炎癥反應。
IRF3是調節Ⅰ型IFN表達的關鍵轉錄因子,能在轉錄水平調節Ⅰ型 IFN的分泌,在機體抵御外來微生物入侵的固有免疫中發揮重要作用。研究表明,當細胞受到炎癥刺激后,IRF3可被激活并發生核轉位,在核內 IRF3通過誘導目標基因的轉錄表達而發揮生物學效應[34]。IRF3參與了TLR4介導TRIF依賴的Ⅰ型IFN的分泌,TRIF通過招募TRAF3,調節IRF-3的活化和核轉位,誘導 IFN-β的表達,引起炎癥反應[35]。本研究發現模型組大鼠IRF3蛋白表達明顯增加,且部分呈核表達,而隔藥灸預處理組和溫和灸預處理組大鼠結腸IRF3蛋白的表達量較模型組均明顯減少,且僅有少量核表達,提示艾灸預處理可能通過調節 IRF-3的活化和核轉位,預防了UC的發生發展進程。
綜上所述,本研究觀察了艾灸預處理天樞穴干預UC大鼠結腸TLR4/TRIF通路的變化,結果表明艾灸預處理可調節結腸 TLR4/TRIF通路中相關蛋白的表達,減輕UC的炎癥反應,研究結果可為UC的防治提供一定的研究依據。

