高活性副干酪乳桿菌凍干菌粉的制備及工藝優化
張雅碩,侯一超,張紫薇,滿朝新,姜毓君
(東北農業大學食品學院,乳品科學教育部重點實驗室,黑龍江哈爾濱 150030)
近年來,隨著乳酸菌作用機制的不斷研究,乳酸菌被廣泛應用于食品行業、醫藥行業、輕工業及畜禽生產業等眾多領域,這也促進了發酵劑種類的更新。目前制作乳酸菌發酵劑的方法有很多,主要有真空干燥、噴霧干燥、真空冷凍干燥和流化床干燥等,但應用較為廣泛和有效的是真空冷凍干燥技術。真空冷凍干燥主要分為三步,首先是產品的預凍,讓發酵劑中的水分凍結成冰,但預凍的速度和時間因菌種而異;其次是升華干燥,也稱為第一階段干燥,通過降低真空度,使環境中水的蒸汽壓降低,冰晶直接轉化為水蒸氣從制品中溢出;最后是解析干燥階段,主要是除去產品中結合水,使制品的水分含量達到要求,利于儲藏。
在真空冷凍干燥過程中,乳酸菌主要經受兩種刺激,即冷凍和干燥,為了減少這兩個過程對微生物造成的損傷,必須采取有效的措施。其中,保護劑的應用是第一保護策略[1]。乳酸菌凍干保護劑可按照不同的方式進行分類,按相對分子量大小可分為兩類[2-3],一類是低分子量化合物(如糖類、醇類和抗氧化劑等),這類物質在冷凍干燥過程中能夠進入細胞,與水分子相互作用,增加溶液的黏度,弱化水的結晶過程,從而減少細胞損傷;另一類是高分子量化合物(如脫脂奶粉、可溶性淀粉和聚合物類等),這類物質能夠在凍干時使溶液呈過冷狀態,降低細胞外溶質濃度,避免由于鹽類濃縮而使細胞脫水,從而減少細胞發生滲透性休克、細胞壁和細胞膜塌陷、蛋白質鹽析變性等不良后果。在真空冷凍干燥過程中,低分子量保護劑發揮直接作用,高分子量保護劑起到促進前者的保護作用,因此高分子和小分子保護劑配合使用,會使乳酸菌在凍干期間維持較高的活性。由于微生物細胞結構和大小有差異,因此需要根據菌株的特異性而選擇合適的凍干保護劑[4]。此外,改變工藝參數,如預凍溫度、預凍時間等也可以減少真空冷凍干燥對細胞造成的損傷[5]。本研究以副干酪乳桿菌為研究對象,對保護劑配方和真空冷凍干燥工藝參數進行優化,以確定制備副干酪乳桿菌凍干菌粉的最佳工藝。
1 材料與方法
1.1 材料與儀器
副干酪乳桿菌(Lactobacillusparacasei) 分離自我國傳統發酵稀奶油,本實驗室保存;MRS液體培養基:葡萄糖20 g,蛋白胨10 g,牛肉浸粉8 g,乙酸鈉5 g,酵母浸粉4 g,磷酸氫二鉀2 g,檸檬酸氫二鉀2 g,硫酸鎂0.2 g,硫酸錳0.04 g,吐溫-80 1 mL,加蒸餾水至1000 mL,調pH為7.0~7.2,于121 ℃下滅菌15 min;MRS計數培養基:向MRS液體培養基中加入1.5%~2.0%(w/v)瓊脂粉;海藻糖 Sigma生物試劑有限公司;乳糖 北京索來寶科技有限公司;蔗糖 上海楷洋生物技術有限公司;麥芽糊精 上海瑞永生物科技有限公司;酵母粉 北京奧博星生物技術有限公司;可溶性淀粉 天津基準化學試劑有限公司;聚乙烯吡咯烷酮(PVP K-30)、谷胱甘肽(GSH) 生工生物工程(上海)股份有限公司;明膠 天津市永大化學試劑開發中心;維生素C 天津市光復科技發展有限公司;脫脂奶粉 市售。
3K15型高速離心機 美國SIGMA公司;ALPHA 1-4 LSC plus型真空冷凍干燥機 德國CHRIST公司;S-3400N型掃描電子顯微鏡、E-1010型離子濺射鍍膜儀 日本日立公司;酶標儀 瑞士TECAN公司;BXM-30R型立式壓力蒸汽滅菌器 上海博訊醫療生物儀器股份有限公司;PL2002型電子天平(0.01 g)、MS-TS型分析天平(0.0001 g)、Delta320型pH計 梅特勒-托利多儀器有限公司
1.2 實驗方法
1.2.1 工藝流程 菌種活化→擴大培養→菌體收集→洗滌→離心收集→菌體懸浮液配制(添加凍干保護劑溶液)→活菌計數→真空冷凍干燥→存活因子的測定。
1.2.2 工藝操作要點
1.2.2.1 菌體的活化、生長曲線的測定及擴大培養 將副干酪乳桿菌以2%的接種量接種到新鮮的MRS液體培養基中,37 ℃培養18 h,用接種環蘸取少量菌液于MRS固體平板上三區劃線,37 ℃培養48 h,挑取典型的單菌落接種于新鮮的MRS液體培養基中培養18 h,以此反復3次,第三代得到的菌液作為工作液。
將活化好的副干酪乳桿菌按2%的接種量接種至100 mL MRS液體培養基中,在37 ℃下培養24 h。每隔2 h測定一次菌液的OD620值,以時間為橫坐標,OD620值為縱坐標建立菌株的生長曲線。
將活化三次后的菌液,以2%的接種量接種至錐形瓶進行擴大培養[6]。
1.2.2.2 菌體的收集 將培養好的菌液置于離心機中,5000×g 4 ℃條件下離心10 min,棄上清液,用0.85%無菌生理鹽水洗滌菌體兩次后,再以同樣的條件離心即得菌體沉淀。
1.2.2.3 菌體細胞的真空冷凍干燥法制備 保護劑溶液的配制:將大分子保護劑、糖類、聚合物類中的一種或幾種保護劑按一定的濃度用蒸餾水溶解,攪拌均勻,于115 ℃下滅菌15 min,置于4 ℃冰箱中保存備用;維生素C、谷胱甘肽采用膜孔徑為0.22 μm的濾膜過濾除菌。
真空冷凍干燥:在5000×g 4 ℃條件下離心10 min收集菌體沉淀,按菌液(未離心前體積)與保護劑比例(v/v)為1∶1加入不同配方的保護劑溶液,計算初始細胞活菌數后分裝進行冰箱預凍(-80 ℃,2 h),凍結完全后將預凍好的樣品放入冷阱溫度為-53.2 ℃,真空度為0.162 mbar的真空冷凍干燥機內凍干24 h,然后置于-20 ℃冰箱中保存備用。
1.2.3 單因素實驗
1.2.3.1 凍干保護劑種類的選擇 單一凍干保護劑的選擇:分別選用以下保護劑[7-9]與菌體充分混勻,觀察菌體的存活情況。
大分子保護劑:分別選用脫脂奶粉、酵母粉、可溶性淀粉、麥芽糊精進行試驗,濃度均為10%。
糖類保護劑:分別選用海藻糖、蔗糖、乳糖進行試驗,濃度均為10%。
聚合物類保護劑:分別選用PVP K-30、明膠進行試驗,濃度均為5%。
抗氧化劑類保護劑:分別選用維生素C、GSH進行試驗,濃度均為1%。
1.2.3.2 凍干保護劑濃度的選擇 根據上述試驗結果,以凍干菌粉的菌體存活因子為指標,選擇保護效果最好的四種保護劑,分別設置不同的濃度梯度進行試驗,以確定其加入的最適濃度。其中脫脂奶粉、蔗糖濃度為0、5%、10%、15%、20%;PVP K-30濃度為0、1%、3%、5%、7%、9%;GSH濃度為0、0.4%、0.7%、1.0%、1.3%、1.6%。
1.2.4 復合凍干保護劑濃度的篩選 選擇單因素優化后的真空冷凍干燥保護劑及其相應濃度,以存活因子為指標,通過正交試驗L9(34)選出效果最佳的凍干保護劑配方,試驗因素水平如表1。
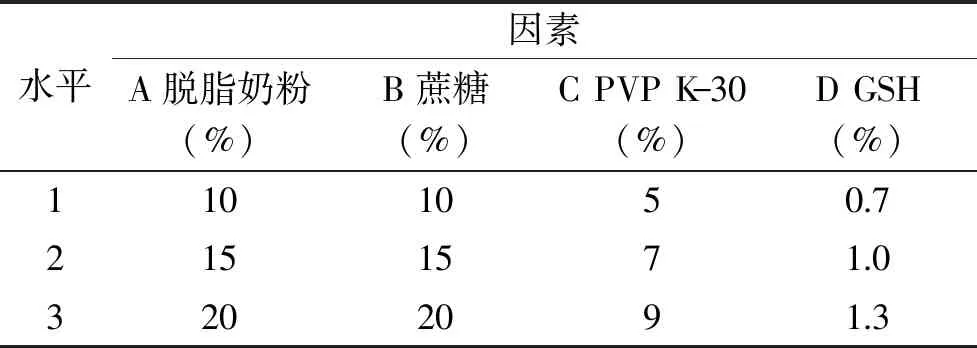
表1 保護劑正交因素水平表
1.2.5 預冷溫度的確定 取生長到指數中期的菌液,用無菌生理鹽水洗兩次,重懸于等體積新鮮的MRS肉湯中,分別放置于4、10、15、20 ℃溫度下處理2 h,再置于37 ℃培養箱中培養至穩定期。對照組為培養至穩定期的菌液。收集各處理條件下的樣品,按照1.2.2.3進行真空冷凍干燥處理,并計算菌體的存活因子。
1.2.6 真空冷凍干燥保護劑pH的選擇 將篩選出來的復合保護劑用滅菌的乙酸或氨水分別調pH為5.0、5.5、6.0、6.5、7.0、7.5,在37 ℃下與菌體平衡20 min后進行真空冷凍干燥,計算出菌體的存活因子。
1.2.7 菌液和保護劑比例的確定 按照上述優化的試驗方法,以菌液/保護劑為1∶1、1∶1.5、1∶2、1∶2.5、1∶3 (v/v)的比例,研究其對菌體凍干存活因子的影響。
1.2.8 凍干厚度的確定 在上述菌液和保護劑添加比例的基礎上,對凍干厚度進行研究。將菌泥和保護劑振蕩混勻后,以不同的厚度(0.3、0.4、0.5、0.6、0.7 cm)裝入玻璃平皿中,置于真空冷凍干燥機內進行凍干,計算其存活因子,確定出最佳的凍干厚度。
1.2.9 預凍方式的選擇 按照上述優化的試驗方法,將樣品分別置于-20 ℃冷凍2 h,-80 ℃冷凍2 h,-196 ℃冷凍15 min,然后真空冷凍干燥24 h,測菌體存活因子[10-11]。
1.2.10 菌粉電鏡觀察 將未添加保護劑組菌粉和添加復合保護劑組菌粉粘貼在樣品臺上,采用E-1010型離子濺射鍍膜儀鍍一層厚度約為150 ?的金屬鉑膜,使用S-3400N型掃描電鏡進行觀察并拍照。
1.2.11 測定方法 副干酪乳桿菌活菌數測定:將凍干前副干酪乳桿菌菌液及凍干后復水恢復活性的樣品進行10倍梯度連續稀釋,取10-6、10-7、10-8之間稀釋梯度進行平板涂布,37 ℃培養48 h,選擇菌落數在30~300 CFU/mL之間的培養皿進行計數。
凍干存活因子的測定:用上述平板計數法分別測定凍干前和凍干后的活菌數,計算菌體的凍干存活因子[12]。凍干前活菌數為菌液中的活菌數;凍干后活菌數為凍干菌粉懸浮于10%的蔗糖溶液中,于37 ℃復水30 min后,恢復活性后的活菌數。
凍干存活因子=[1-(lg凍干前活菌數-lg凍干后活菌數)/lg凍干前活菌數]
凍干前活菌數(CFU)=凍干前菌濃(CFU/mL)×v
凍干后活菌數(CFU)=凍干后菌濃(CFU/g)×m
式中:v代表凍干前菌液體積,mL; m代表凍干后菌粉質量,g。
1.3 數據處理
采用Excel 2010(Microsoft office 2010)軟件處理試驗數據,結果表示為平均值±標準差。采用SPSS statistic 20.0軟件對數據進行單因素方差分析(ANOVA)。
2 結果與分析
2.1 副干酪乳桿菌生長曲線的繪制
由圖1可知,副干酪乳桿菌生長過程中,0~4 h為延遲期,4~16 h為對數期,16~24 h為穩定期。菌體進入穩定期,結構和生理都發生了很大變化,包括應激蛋白、膜組成和細胞壁結構的表達水平的變化,使菌抗性增加[7],因此,選擇16 h為收獲期。

圖1 副干酪乳桿菌生長曲線
2.2 凍干保護劑的優化
2.2.1 不同類型保護劑對副干酪乳桿菌的凍干保護 圖2為不同種類保護劑對副干酪乳桿菌凍干存活因子的影響,從圖2可以看出,所選擇的大分子物質能夠顯著(p<0.05)提高菌體的存活因子,但不同的保護劑保護效果不同。其中脫脂奶粉的保護效果最好,顯著(p<0.05)高于酵母粉、可溶性淀粉和麥芽糊精的保護作用。這可能是因為脫脂奶粉不僅像其它大分子物質一樣在菌體表面形成保護層,并且脫脂奶粉中的乳清蛋白在菌體外形成蛋白膜,對細胞加以保護,并可以固定凍干的酶類,防止由于細胞壁蛋白質損傷而引起的胞內物質滲漏[6];同時,乳中其他成分(乳糖、鈣、磷等)也可以起到保護作用[12-13]。因此,本試驗選擇脫脂奶粉為大分子保護劑。

圖2 不同類型保護劑對副干酪乳桿菌凍干菌粉存活因子的影響
糖類保護劑也能顯著提高菌體的存活因子,其中蔗糖保護效果最優。在凍干過程中,蔗糖可以形成高粘度、低流動性的玻璃態基質,將蛋白質分子支撐起來,使之不易變性[14]。蔗糖分子的多個羥基,在凍干過程中可取代水分子與菌體表面的自由基聯結或與菌體蛋白質形成氫鍵,從而對細菌的細胞膜和蛋白質的完整性起到保護作用[15]。此外蔗糖可以促進菌體分散,還可以作為細胞今后生長用的碳源[16]。
聚合物類保護劑在凍結過程中優先析出,可以提高溶液的粘度,抑制pH的降低。在聚合物類保護劑中PVP K-30保護效果最好。作為國家批準的新型安全食品添加劑,PVP K-30可以用作保護劑、分散劑、粘合劑和給藥劑等[17]。在真空冷凍干燥過程中,PVP K-30可以提高蛋白質和氨基酸的穩定性。同時,它也是一種非滲透性保護劑,可以與糖類間氫鍵作用,抑制糖類從玻璃態轉變成結晶態,從而增加糖的物理穩定性[18]。
抗氧化劑類保護劑在凍干過程中可以通過自身氧化而消耗環境中的氧,減少乳酸菌與氧的接觸,防止樣品氧化[19]。試驗中GSH的保護效果較好。有研究表明,GSH作為凍干保護劑在保護細胞的同時減少了飽和脂肪酸的鏈長,進而保持細胞流動性。同時GSH減少細胞膜脂肪酸被氧化,并促使細菌有效地適應凍干過程[20]。
綜上所述,本試驗的單一保護劑確定為脫脂奶粉、蔗糖、PVP K-30和GSH。
2.2.2 凍干保護劑濃度篩選 分別考察了脫脂奶粉、蔗糖、PVP K-30、GSH 4種保護劑不同濃度對菌體凍干后細胞存活因子的影響,結果如圖3所示。
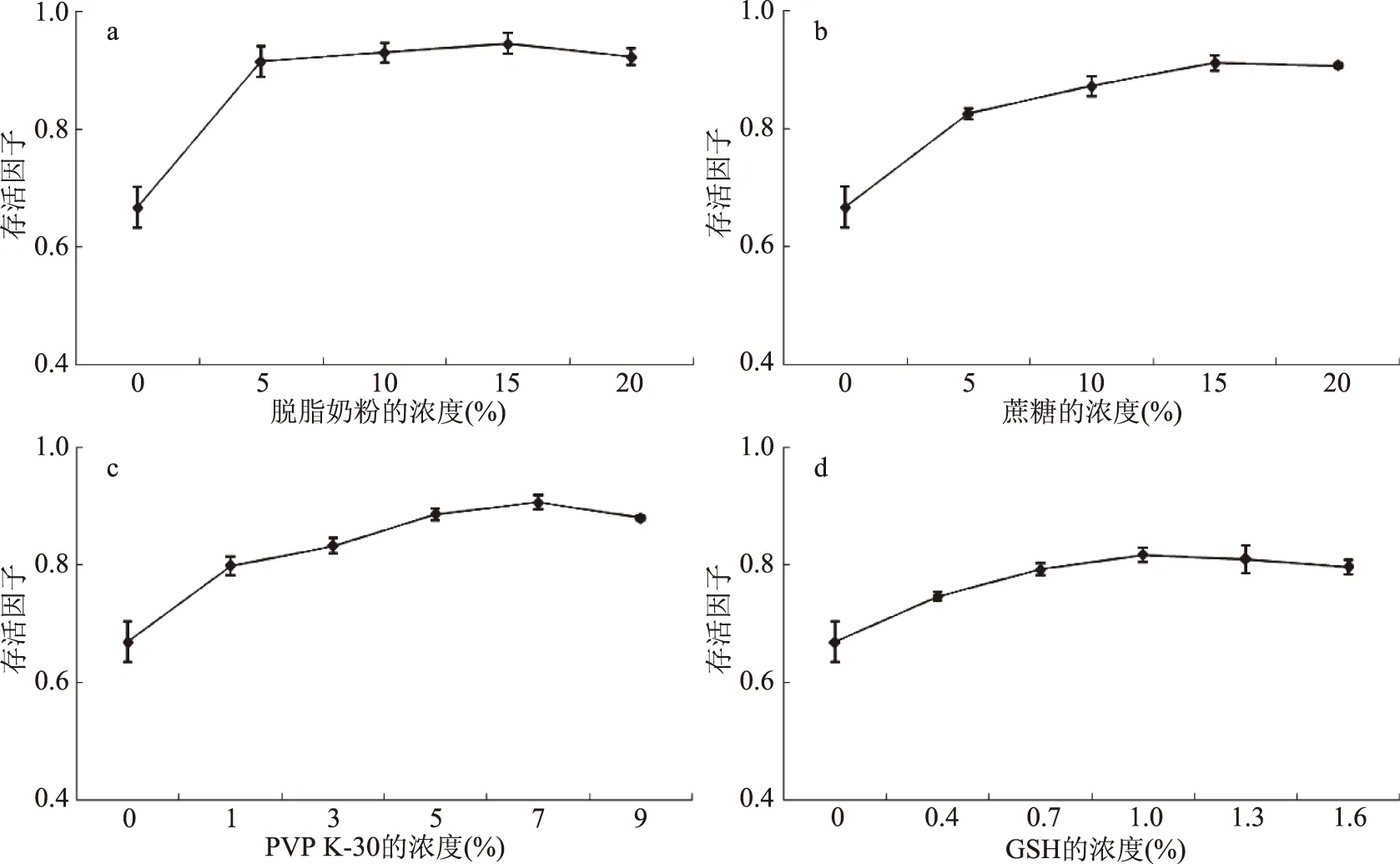
圖3 不同濃度保護劑對乳酸菌凍干活力的影響
由圖3a可以看出,脫脂奶粉的添加提高了副干酪乳桿菌凍干菌粉的存活因子,其中濃度為15%時凍干效果最好,存活因子最高,繼續增大脫脂奶粉的濃度,保護效果逐漸減少。由圖3b可知,隨著蔗糖濃度的增加,菌體凍干存活因子也提高,但蔗糖濃度高于15%時,凍干菌的存活因子出現下降趨勢,因此蔗糖濃度為15%時存活因子最高,菌的活性最好。由圖3c可以看出,當PVP K-30濃度低于7%時,隨著PVP K-30濃度的增加,凍干菌體的存活因子也呈上升趨勢,當PVP K-30濃度為7%時,保護效果最好。由圖3d可以看出,當GSH濃度為0.4%~1.0%時,凍干菌的存活因子隨濃度的增加而上升,當GSH濃度為1.0%~1.6%時,凍干菌的存活因子隨濃度的增加而下降,因此GSH濃度為1%時存活因子最高。由此可以看出,副干酪乳桿菌凍干存活因子與各保護劑濃度之間并不是線性增長關系,其趨勢為先升高后下降。保護劑濃度較低時,隨著濃度的升高,細胞活力不斷提高,但到一定濃度后,隨著保護劑質量濃度的增加,細胞活力反而下降。出現這一現象的原因可能是當保護劑濃度過高時,細胞內蛋白質聚合程度加劇,形成較強的玻璃化結構,對凍干菌粉的低溫儲藏不利,導致復水效果差[21]。因此,據圖中結果可知保護劑脫脂奶粉15%、蔗糖15%、PVP K-30 7%、GSH 1%為最佳濃度,以此作為正交試驗的依據。
2.2.3 凍干保護劑正交試驗 單獨使用某種保護劑的效果并不理想,為進一步提高菌體存活因子,需對凍干保護劑進行復配試驗。以上試驗已確定4種最佳保護劑及其濃度,采用正交試驗的優化方式,進行保護劑配方的確定。
由表2可知,四種保護劑對副干酪乳桿菌的極差R的大小順序為RA>RD>RC>RB,由直觀分析可知,凍干存活因子最高的保護劑組合為A2B3C2D3,即脫脂奶粉15%,蔗糖20%,PVP-K30 7%,GSH 1.3%。為了驗證由正交試驗得到的最佳保護劑是否能得到最高的存活因子,按照直觀分析得到的保護劑組合(A2B3C2D3)進行了驗證試驗,副干酪乳桿菌的凍干存活因子為(0.977±0.002),高于正交試驗中得到的結果,因此認為正交試驗優化結果有效[22]。
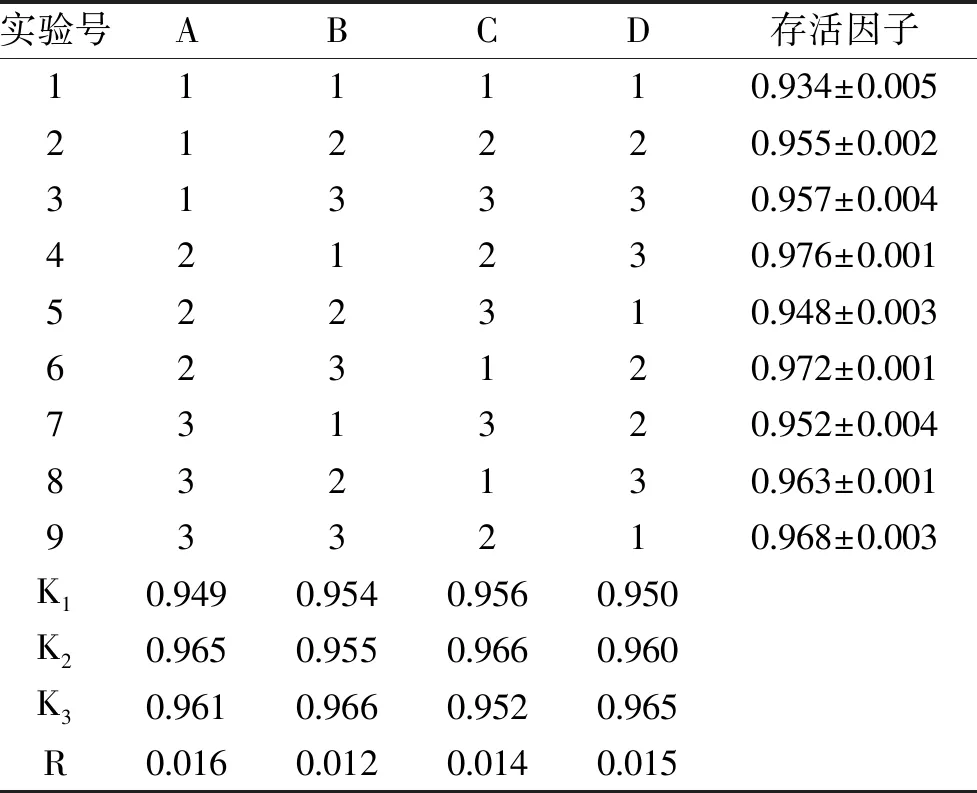
表2 副干酪乳桿菌凍干保護劑正交試驗結果
2.3 預冷溫度對副干酪乳桿菌凍干活力的影響
國內外研究表明,影響乳酸菌凍干存活的因素有很多,如菌株間的差異,培養方式的不同,凍干前的預處理,保護劑的選擇等都會影響乳酸菌活力。在凍干之前,對乳酸菌進行脅迫處理,可以提高其對環境的抗性。各種脅迫包括溫度脅迫(熱脅迫和冷脅迫)、滲透壓脅迫、酸脅迫和饑餓脅迫等[23]。乳酸菌在生長過程中受到脅迫,會引起細胞的某種生理變化,這些變化可以促進乳酸菌提前產生抵御冷凍干燥的細胞機制,適應不良環境,從而提高干燥的活力。Shao等[24]通過冷脅迫提高了德氏乳桿菌亞種保加利亞乳桿菌ND02的凍干活性。Zhang等[25]發現,在冷凍干燥之前,對酒類酒球菌進行冷脅迫、乙醇脅迫和酸脅迫后,菌體細胞膜不飽和脂肪酸/飽和脂肪酸的比例上升,環丙烯脂肪酸含量增加,增強細胞應激能力,提高了酒類酒球菌的冷凍干燥活性。
由圖4可以看出,經過預冷處理后的細胞,真空冷凍干燥后存活因子都普遍升高。當冷脅迫溫度為4 ℃時,與未處理組相比,菌體存活因子升高幅度不大。可能是在4 ℃下,細胞的代謝遲緩,不會或很少產生應激反應。10 ℃冷激的菌體細胞存活因子較對照組提高0.003,效果比4 ℃稍好。15 ℃冷激效果最佳,菌體細胞凍干后存活因子達到0.984,但20 ℃時冷激產生效果有所下降,可能是預冷溫度升高,乳酸菌受到的刺激減小,從而產生抗冷凍干燥的物質減少所造成的。所以選擇15 ℃ 2 h作為預冷處理。
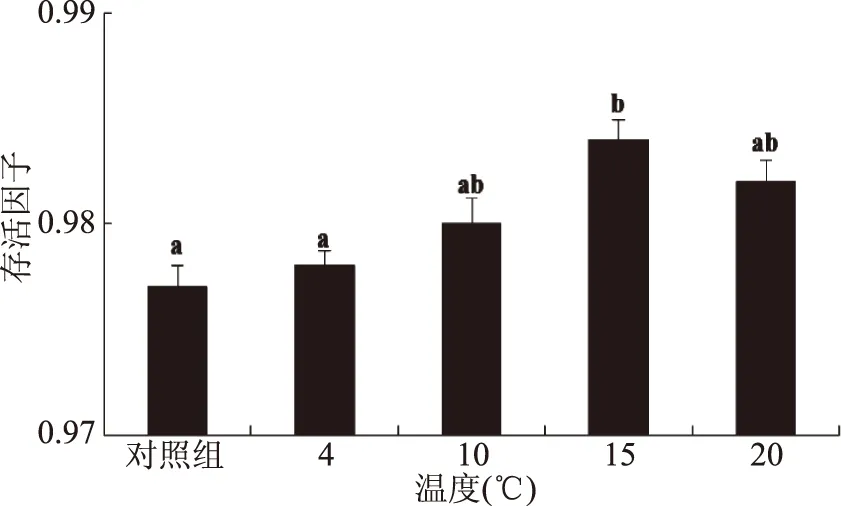
圖4 不同預冷條件對副干酪乳桿菌凍干存活因子的影響
2.4 復合保護劑pH的選擇
保護劑的pH對乳酸菌的凍干存活有一定的影響,適宜的pH有利于菌體在凍干過程中保持較高活力[26]。如圖5所示,在pH為6.5時,菌體凍干后存活因子最高,pH過低時不利于菌體保持活力,當pH高于6.5時,菌體存活因子下降,可能是因為偏離乳酸菌生長的最適pH,不利于菌體冷凍干燥,所以最終選擇保護劑pH為6.5。

圖5 保護劑pH對副干酪乳桿菌凍干存活的影響
2.5 菌液和保護劑比例對菌體凍干存活的影響
菌液和凍干保護劑比例會影響乳酸菌的凍干活性。由圖6可知,當菌液和保護劑比例為1∶1.5 (v/v)時,菌體的凍干存活因子最大,隨著保護劑比例的增加,菌體存活因子下降,一方面可能是因為保護劑濃度過高,細胞的通透性下降,水分揮發受阻,導致較多冰晶生成,從而造成細胞死亡率增大;另一方面可能是因為保護劑過多,單位體積或質量菌粉活菌數減少。因此,選擇菌液和保護劑比例為1∶1.5 (v/v)時為最佳配比。
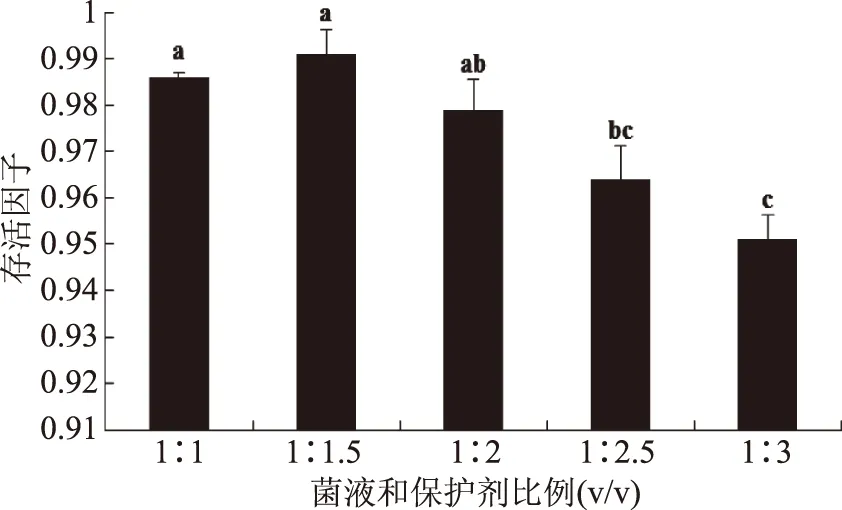
圖6 菌液和保護劑比例對副干酪乳桿菌凍干存活的影響
2.6 凍干物料厚度對菌體凍干存活因子的影響
如圖7所示,從凍干厚度來看,隨著厚度的增加,菌體存活因子不斷上升,當厚度達到0.5 cm時,存活因子達到最大值,為(0.994±0.004),但繼續增加厚度,菌體的凍干活性下降。當物料厚度不足時,冷凍的菌體從低溫冰箱中取出放入真空冷凍干燥機過程中容易融化,再重新凍結時,造成菌體損傷,而物料厚度足夠厚時,相對不易融化,減少了二次凍結對菌體的損傷。而當物料厚度過厚時,細胞失去結合水難度增加,菌粉的水分含量增加,不利于儲存。因此,選擇0.5 cm為最佳凍干厚度。
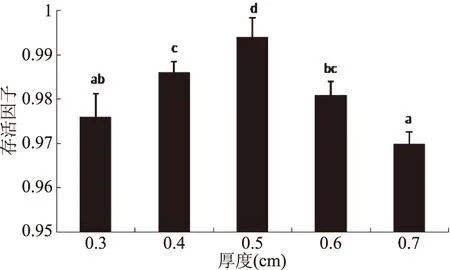
圖7 物料凍干厚度對菌體存活因子的影響
2.7 預凍方式的確定
預凍溫度是制作凍干菌粉的關鍵參數之一,細胞外冰晶的形成可能會破壞細胞膜,從而降低乳酸菌細胞的活力[1]。并且,冷凍速率會影響冰晶的成核,快速冷凍可以產生較小的冰晶,對細胞的不利影響減小[27]。所以,預凍溫度的確定對乳酸菌凍干發酵劑的制備有重要意義。由圖8結果顯示,當用液氮預凍時,副干酪乳桿菌的存活因子達到(0.998±0.001),顯著(p<0.05)高于-20 ℃預凍效果,也高于-80 ℃預凍(0.995±0.002)效果。這可能是因為在-20 ℃條件下預凍,形成的冰晶大,在干燥階段,升華速度慢,從而導致菌體活力下降。此外,液氮預凍所需時間比-80 ℃短,因此選擇液氮下處理15 min為最佳預凍方式。

圖8 預凍方式對副干酪乳桿菌存活因子的影響
2.8 凍干菌粉微觀結構的電鏡觀察
通過掃描電鏡圖9可知,未添加保護劑的菌粉部分細胞明顯破裂,變形嚴重,細胞之間相互堆積,胞間有絲狀物相互黏連,這可能是由于細胞變形或破裂后內容物泄露所造成的。而添加保護劑的凍干菌粉中保護劑與菌體分布均勻,菌體清晰,形態飽滿,呈桿狀,菌體均被覆蓋在薄的涂層下,這在一定程度給細胞膜提供了保護效應,減少了與外界的接觸,避免了氧化損傷,從而維持細胞結構的完整性。
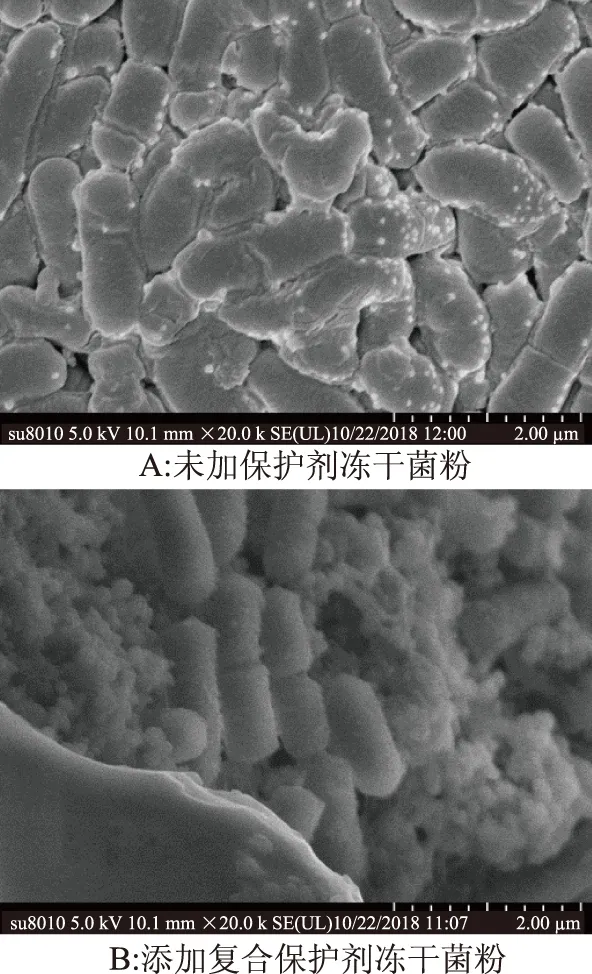
圖9 掃描電鏡圖(×200000)
3 結論
本研究以副干酪乳桿菌為對象,對其凍干菌劑的制備進行探究。單一保護劑因其作用的局限性而不能滿足保護的要求,通過正交試驗,確定了副干酪乳桿菌凍干保護劑最佳配方為:脫脂奶粉15%,蔗糖20%,PVP K-30 7%,GSH 1.3%。單因素試驗確定了副干酪乳桿菌真空冷凍干燥的工藝參數為:在15 ℃下預冷2 h,保護劑pH為6.5,菌液和保護劑的比例(v/v)為1∶1.5,凍干厚度為0.5 cm,預凍方式采用液氮(-196 ℃)冷凍15 min。在此條件下,副干酪乳桿菌經真空冷凍干燥后存活因子達(0.998±0.001),活菌數為(2.35±0.02)×1011CFU/g。通過掃描電鏡觀察發現,未添加保護劑的菌粉細胞表面褶皺破裂,造成細胞內容物泄露,而添加了復合保護劑的細胞經過真空冷凍干燥后,細胞仍保持完整結構,菌體結合相對疏松,有利于凍干菌粉復水。

