具有潛在降血糖作用乳酸菌的篩選
劉 順,謝遠紅,張紅星,金君華
(北京農學院食品科學與工程學院,食品質量與安全北京實驗室,農產品有害微生物及農殘安全檢測與控制北京市重點實驗室,北京 102206;)
近年來,糖尿病發病率呈現爆發式增長,成為21世紀全球面臨的最嚴重、最危急的健康問題之一[1]。世界衛生組織的數據顯示,中國糖尿病的患病率至2017年已居世界首位,人數約1.1億,約占中國成年人總數的1/10。依照目前發展趨勢,到2040年,我國患者將超過1.5億[2],快速增長的糖尿病人群將會加大各國醫療系統的壓力,據研究報道,2015年,全球糖尿病花費為6730億美元,預測在2040年將達到8020億美元[3]。
目前,治療Ⅱ型糖尿病主要方法是藥物治療,如二甲雙胍、格列汀類藥物、α-葡萄糖苷酶抑制劑等,其中,二甲雙胍和格列汀類藥物對人體具有一定的副作用[4],而α-葡萄糖苷酶抑制劑具有較好的降糖作用而且對人體臟器無明顯毒副作用[5]。
α-葡萄糖苷酶的作用是參與碳水化合物的分解,抑制α-葡萄糖苷酶的活性可以降低人體血液中的血糖水平[6]。目前已經上市的α-葡萄糖苷酶抑制劑類降糖藥僅有阿卡波糖、伏格列波糖和米格列醇三種,且均為外國知識產權的產品,國內具有自主知識產權的該類藥物鮮有報道,所以研發出具有自主知識產權的α-葡萄糖苷酶抑制劑類藥物具有一定意義。
乳酸菌具有多種益生功能,因其性質溫和、作用效果明顯且持久穩定的特點成為了國內外的研究熱點,其對α-葡萄糖苷酶的抑制作用已被證實。Zeng等[7]發現7株乳桿菌無細胞分泌上清具有α-糖苷酶的抑制能力,Panwar等[8]證明存在于人腸道中的乳桿菌菌株具有α-葡糖苷酶和β-葡萄糖苷酶抑制活性,并且可以降低體內血糖反應[2]。并且有研究表明,乳酸菌對大鼠的高血糖癥狀以及人的Ⅱ型糖尿病有一定的改善作用[1,5,9-10]。
為了得到具有良好抑制α-葡萄糖苷酶作用和益生效果的乳酸菌,本實驗以被證實具有降血糖作用的商業菌株鼠李糖乳桿菌LGG[11]為對照,對分離自天然食品的36株乳酸菌進行體外篩選,初步研究其降血糖作用,可為進一步研究開發新型功能性乳酸菌產品提供一定的理論依據。
1 材料與方法
1.1 材料與儀器
乳酸菌 詳細信息見表1;植物乳桿菌Zhang-LL(CGMCC 6936) 由北京農學院(功能性乳品實驗室)凍藏保存;鼠李糖乳桿菌LGG(ATCC 53103) 由中國農業大學教育部-北京市共建功能乳品重點實驗室饋贈;4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)、α-葡萄糖苷酶 美國Sigma;MRS培養基 北京路橋技術股份有限公司;無水碳酸鈉(分析純)、牛膽鹽(純度70%) 國藥集團化學試劑有限公司;鹽酸、氫氧化鈉 分析純,北京化工場;人工胃液、人工小腸液 北京欣華綠源科技有限公司。
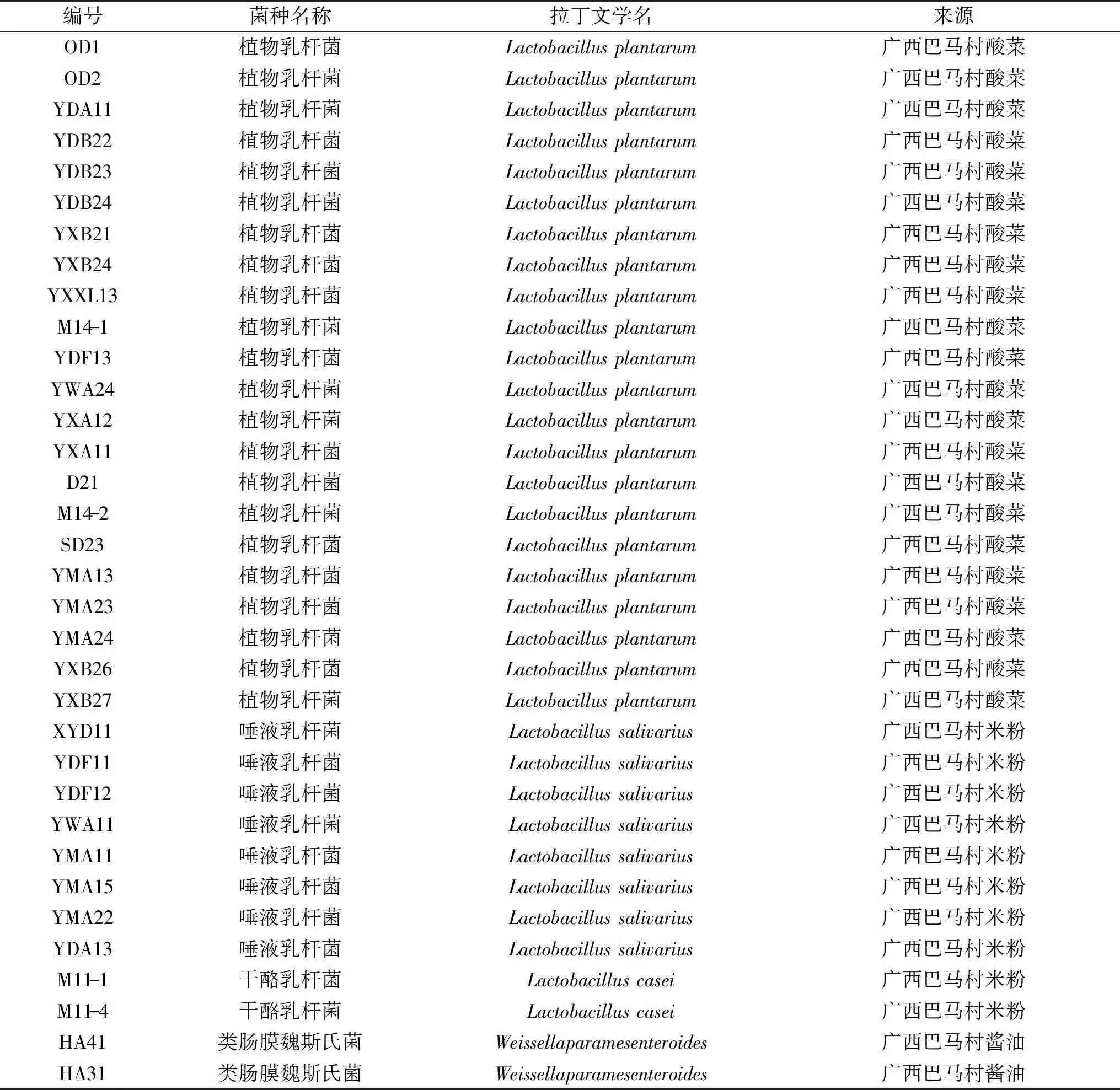
表1 不同來源乳酸菌
DL-CJ-2ND I型潔凈操作臺 北京東聯哈爾儀器制造有限公司;SCILOGEX MX-S型漩渦振蕩器海門市其林貝爾公司;BSA224S型精密電子天平 賽多利斯科學儀器北京有限公司;ELx808型酶標儀 美國基因有限公司;SKP-03B型恒溫培養箱 蘇州培英實驗設備有限公司;Eppendoef centrifuge 5417R型冷凍離心機 北京博宇寶威實驗設備公司;MLS-3750型高壓滅菌鍋 日本SANYO公司。
1.2 實驗方法
1.2.1 菌株活化 將在-80 ℃保菌管中保藏的乳酸菌以2%接種量接種于MRS培養基中37 ℃培養12 h,共活化三代。
1.2.2 樣品的制備 菌株活化三代后,調整菌懸液密度為1×109CFU/mL,4 ℃下6000 r/min離心10 min,收集發酵上清液。發酵上清液用0.22 μm水系濾膜過濾得發酵上清液樣品。
1.2.3α-葡萄糖苷酶抑制率的測定 參考Pierre等[12]和Zhang等[13]的方法并進行修改,以被證實具有降血糖作用的商業菌株鼠李糖乳桿菌LGG的α-葡萄糖苷酶抑制率為對照。在96孔板210 μL的反應體系中,加入50 μL PBS溶液(0.1 mol/L,pH=6.8)和50 μL濃度為2.5 mmol/L的PNPG溶液,37 ℃孵育10 min。然后加入30 μL濃度為0.4 U/mL的α-葡萄糖苷酶溶液37 ℃繼續反應30 min,最后加入50 μL的濃度為1 mol/L的Na2CO3溶液終止反應。反應完成后,于酶標儀405 nm處測定吸光值。用PBS溶液(0.1 mol/L,pH=6.8)作為α-葡萄糖苷酶溶液和待測樣品的空白對照,每組設定3個平行。
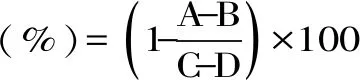
式中:A為樣品組,含有樣品溶液和α-葡萄糖苷酶溶液;B為樣品空白組,含有樣品溶液不含α-葡萄糖苷酶溶液;C為對照組,不含樣品溶液含α-葡萄糖苷酶溶液;D為空白組,不含樣品溶液不含α-葡萄糖苷酶溶液。
1.2.4α-淀粉酶抑制率的測定 以LGG的α-淀粉酶抑制率為對照,對具有較好α-葡萄糖苷酶抑制率的菌株進行α-淀粉酶抑制率的測定。參考龍楚媚等[14]方法。用0.25 mL樣品溶液與1 mg/mL的α-淀粉酶溶液等體積混合,于37 ℃孵育10 min,然后將反應液加入至37 ℃的0.5 mL的1.5%的可溶性淀粉溶液中,于37 ℃反應5 min,再加入1 mL DNS溶液,在沸水浴中反應5 min后迅速冷卻至室溫,稀釋10倍后靜置30 min,并于540 nm處測定吸光值。用PBS溶液(0.1 mol/L,pH=6.8)作為α-淀粉酶溶液和待測樣品的空白對照,每組設定3個平行。
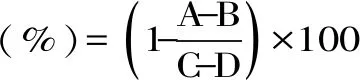
其中:A為樣品組,含有樣品溶液和α-淀粉酶溶液;B為樣品空白組,含有樣品溶液不含α-淀粉酶溶液;C為對照組,不含樣品溶液含α-淀粉酶溶液;D為空白組,不含樣品溶液不含α-淀粉酶溶液。
1.2.5 耐酸實驗 配制MRS肉湯,用HCl調節pH分別為2.5和3.0,121 ℃高壓滅菌15 min。將具有較好α-葡萄糖苷酶抑制率的菌株活化后以2%接種量分別接入pH為2.5、3.0的MRS肉湯中,37 ℃培養8 h后用平板菌落計數法測定其活菌數,以pH為6.8的MRS肉湯作為對照,每組3個平行,分別測定其存活率。
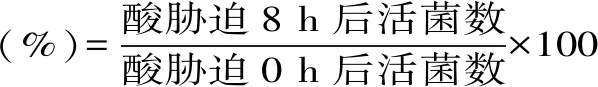
1.2.6 耐膽鹽實驗 參考周曉瑩[15]的方法并進行修改,將具有較好α-葡萄糖苷酶抑制率的菌株活化后以2%接種量分別接入含0.2%、0.3%、0.4%牛膽鹽的MRS肉湯中,37 ℃培養4h后用平板菌落計數法測定其活菌數,以不加膽鹽的MRS肉湯作為對照,每組3個平行,分別測定其存活率。

1.2.7 耐人工胃腸液實驗 將具有較好α-葡萄糖苷酶抑制率的菌株活化后以2%接種量接入pH=3的人工胃液中,37 ℃培養3 h后用平板菌落計數法測定活菌數,以0 h時活菌數對比計算存活率。將在人工胃液中培養了3 h的菌液以2%接種量接入pH=8的人工腸液中,37 ℃培養8 h后用平板菌落計數法測定活菌數,以3 h時人工胃液中活菌數作為對比。每組三個平行,分別測定其存活率。
胃液中菌株存活率(%)=胃液培養8 h后活菌數/胃液培養0 h時活菌數×100
腸液中菌株存活率(%)=腸液培養8 h時活菌數/胃液培養8 h時活菌數×100
1.3 數據處理
采用SPSS 18.0軟件對實驗結果進行統計分析,組間數據比較采用單因素方差分析(one-way ANOVA)以p<0.05表示有顯著性差異。
2 結果與分析
2.1 乳酸菌α-葡萄糖苷酶抑制率實驗結果
由表2可知,發酵上清液對α-葡萄糖苷酶抑制率最高的4株菌分別為YDA11、OD1、OD2和YDB24,其抑制率分別為28.37%、30.26%、30.26%和33.18%,對照菌株LGG抑制率為31.78%,且這4株菌均與對照菌LGG抑制率無顯著性差異(p>0.05),不同菌株發酵上清液的α-葡萄糖苷酶抑制率相差較大,這可能是具有α-葡萄糖苷酶抑制能力的為菌株的胞外產物,而不同菌株產生該類胞外物質的能力不一。選取對α-葡萄糖苷酶抑制率較高的YDA11、OD1、OD2和YDB24做進一步研究。
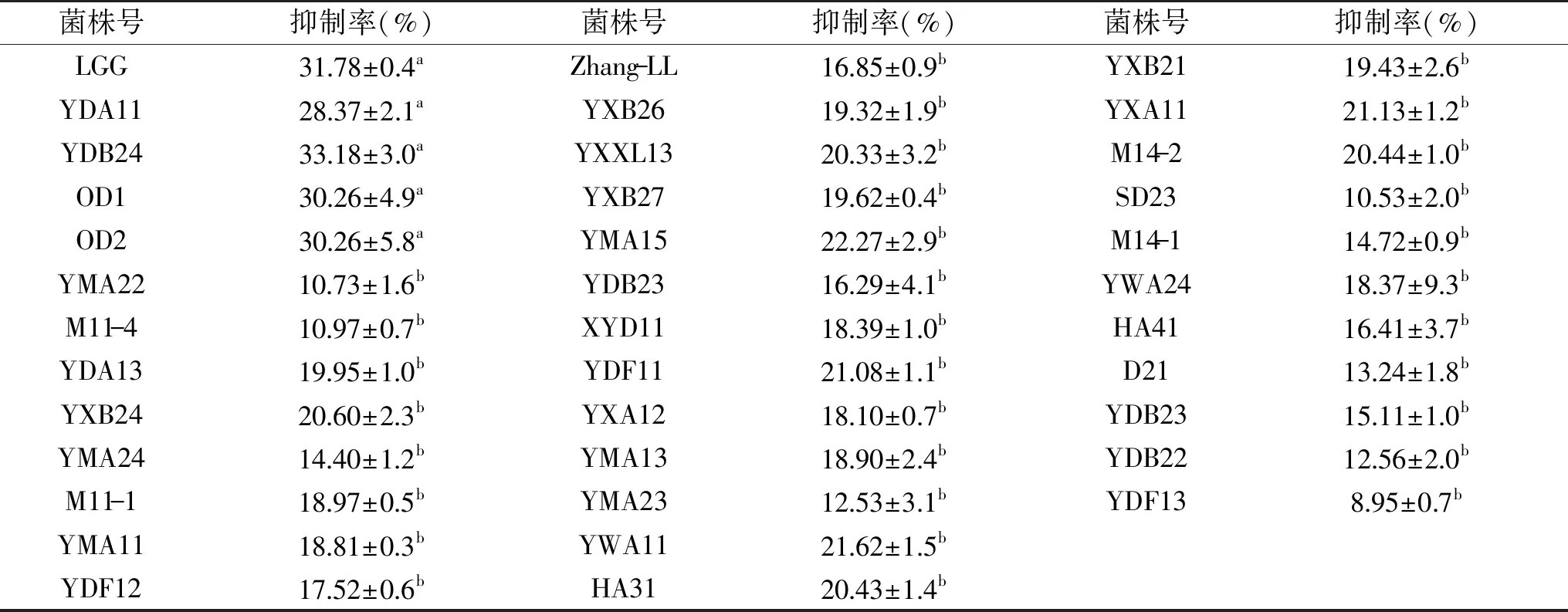
表2 菌株發酵液對α-葡萄糖苷酶抑制率
2.2 菌株α-淀粉酶抑制率實驗結果
α-淀粉酶是一種重要的淀粉水解酶,它能夠切斷淀粉內部的糖苷鍵,產生糊精、低聚糖和葡萄糖等[16]。能夠促進食物中碳水化合物的水解和消化,促進糖分的攝入,從而提高了血糖和血脂含量水平[17]。人體進食后,α-葡萄糖苷酶和α-淀粉酶協同促進血糖的升高,,進而引發高血糖癥狀。具有良好α-葡萄糖苷酶抑制率的四株菌YDB24、YDA11、OD2和OD1對α-淀粉酶的抑制率見表3。其中菌株YDA11與對照菌株LGG抑制率無顯著性差異(p>0.05)。同時,菌株OD1和OD2對α-淀粉酶的抑制率顯著高于LGG(p<0.05),由此可見,菌株OD1和OD2對α-淀粉酶具有較強的抑制作用。

表3 菌株發酵液對α-淀粉酶抑制率
2.3 菌株耐酸實驗結果
能夠耐受胃部酸性環境是益生菌能夠進入腸道發揮作用的一大前提,人體空腹時胃液pH在2.0以下,進食后胃液pH在3.0左右,因此,本實驗分別以pH為2.5和3.0的酸性環境對菌株耐酸能力進行測定。由圖1可知,菌株YDB24、YDA11、OD2和OD1經過體外耐酸性實驗8 h的培養,表現出了不同的耐酸能力。在pH2.5的環境中,菌株YDA11與菌株OD1耐酸能力較差,存活率分別為84.49%與89.04%,且與菌株LGG具有顯著性差異(p<0.05);菌株YDB24與菌株OD2耐酸能力較好,存活率分別為96.01%與96.83%;在pH3.0的環境中,全部4株菌的存活率都在100%以上,菌株OD2存活率顯著高于LGG(p<0.05)。所以,菌株YDB24、YDA11、OD2和OD1均表現出良好的耐酸能力。
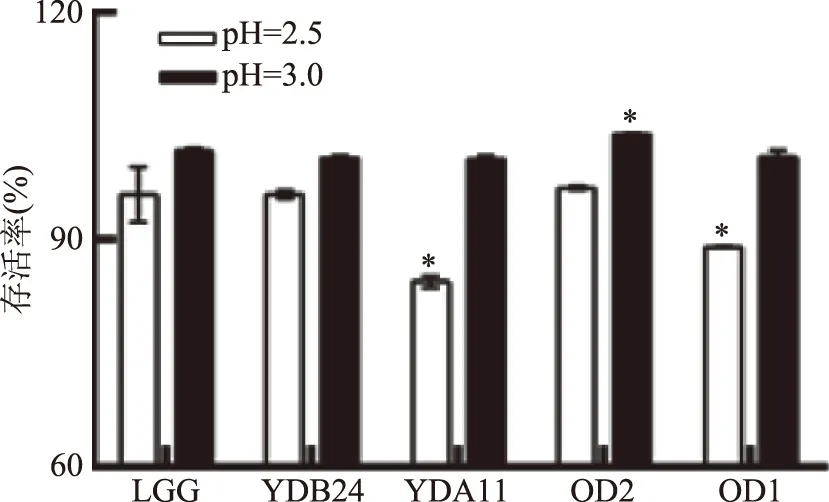
圖1 乳酸菌耐酸實驗結果
2.4 菌株耐膽鹽實驗結果
由圖2可知,菌株YDB24、YDA11、OD2和OD1在含不同濃度的牛膽鹽MRS肉湯中脅迫4 h后,表現出不同的耐受能力。菌株OD2在0.3%牛膽鹽培養基中存活率可達到94.81%,與對照菌株LGG無顯著性差異(p>0.05);在0.4%的高濃度膽鹽環境下,菌株OD2存活率依然能夠達到68.48%,植物乳桿菌OD2表現出最強的膽鹽耐受能力。
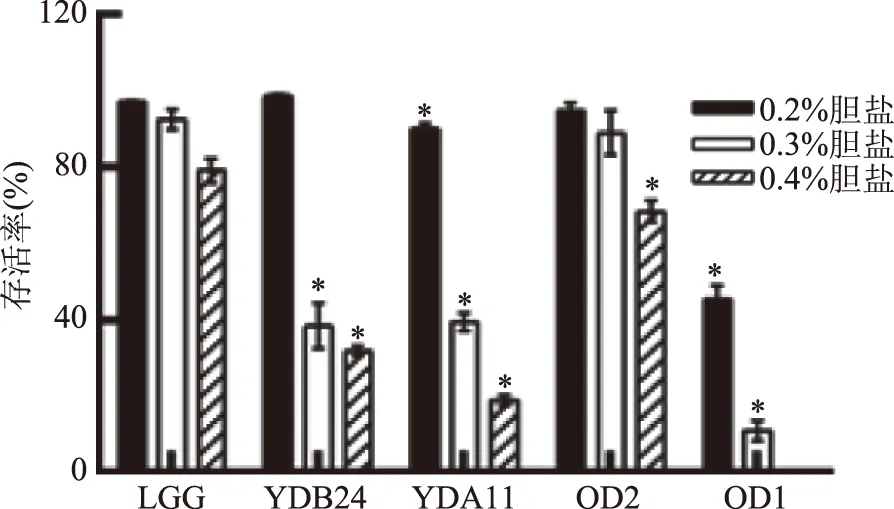
圖2 菌株耐膽鹽實驗結果
2.5 菌株耐人工胃腸液實驗結果
人體胃液中的HCl和胃蛋白酶以及腸道中堿性環境和胰蛋白酶是對益生菌發揮作用的一大考驗。由圖3可知,實驗菌株在pH=3.0的人工胃液中脅迫3 h后,菌株YDB24與OD2存活率分別為91.48%和94.22%,與對照菌株LGG無顯著性差異(p>0.05),表現出良好的耐受能力;轉入人工小腸液中繼續脅迫8 h后,菌株YDB24、YDA11和OD1存活率均顯著低于LGG(p<0.05),菌株OD2存活率為79.99%與LGG無顯著性差異(p>0.05)。
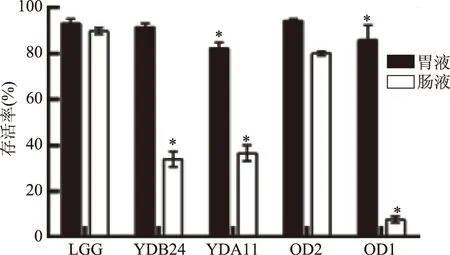
圖3 菌株耐人工胃腸液實驗結果
3 結論與討論
益生菌來源的α-葡萄糖苷酶抑制劑是當下研究降血糖問題的熱點,具有良好的α-葡萄糖苷酶抑制率從側面也反映了該益生菌的潛在降血糖價值。以上實驗結果表明,36株乳酸菌對α-葡萄糖苷酶抑制率能力不一,以菌株YDA11、OD1、OD2、YDB24表現最佳,而在進一步的篩選實驗中菌株OD2綜合性能與對照菌株LGG最接近,因此,篩選出植物乳桿菌OD2為具有潛在降血糖能力的菌株。
目前國內有關微生物來源的α-葡萄糖苷酶抑制劑的研究不多。陳佩等[18]研究的干酪乳桿菌CCFM0412對α-葡萄糖苷酶的抑制率為29.61%;張軍蒙等[19]發現從傳統乳酸菌發酵食品中篩選出來的乳雙歧桿菌1號BA01對α-葡萄糖苷酶的抑制率達到37.48%。而在測定α-淀粉酶抑制率的實驗中,植物乳桿菌OD2抑制率顯著高于對照菌株LGG(p<0.05),說明植物乳桿菌OD2在同類特性菌株中表現良好。
乳酸菌能發揮自身益生功能的前提就是能以有效的活菌數進入腸道并在腸道中正常的生長代謝,所以就要求篩選出的乳酸菌具有一定的耐受能力。刑良英等[20]研究發現乳酸菌WHH734在pH=2.5的環境下存活率可達96.85%;而唐雅茹[21]發現植物乳桿菌KLDS1.0386在pH3.0的酸性環境中培養3 h的存活率為84.62%,本實驗中篩選的植物乳桿菌OD2在pH為2.5和3.0的環境中存活率分別能達到96.83%和104.06%,對比表明植物乳桿菌OD2具有良好的耐酸能力。
胃腸道中的環境是對益生菌的一大考驗。人體腸道中膽鹽濃度一般為0.3%左右,菌株OD2在0.3%膽鹽環境中脅迫4 h后存活率與對照菌株LGG無顯著性差異(p<0.05),且在0.4%的膽鹽中存活率仍能達到68.48%;在耐人工胃腸液實驗中,植物乳桿菌OD2在胃液中和腸液中存活率分別為94.22%和79.99%,而云月英等[22]研究發現從自然發酵肉制品中分離的乳酸菌M12H和M13在pH=3的人工胃液中存活率為68.66%和56.72%,陳佩等[18]研究發現干酪乳桿菌CCFM0412在pH=8的人工腸液中可存活8h,存活率達到90.98%。說明植物乳桿菌OD2具有良好的胃腸道耐受能力。
乳酸菌在食品行業以及發酵工業等具有廣闊的發展前景,而本實驗中植物乳桿菌OD2良好的α-葡萄糖苷酶抑制率和胃腸道環境耐受能力,使其在實際應用中價值更加廣泛。

