小葉苦丁茶多酚提取物對鹽酸/乙醇誘導小鼠胃損傷的預防效果
母健菲,趙 欣,龍興瑤,3,周先容,潘妍霓,3,劉必慧,*
(1.重慶市功能性食品協同創新中心,重慶市功能性食品工程技術研究中心,功能性食品研發重慶市工程實驗室,重慶第二師范學院生物與化學工程系,重慶 400067;2.西南大學食品科學學院,重慶 400715;3.車醫科學大學食品生命工學專業,韓國京畿道 487-010)
小葉苦丁茶又稱作“青山綠水”,其原植物為木犀科女貞屬的粗壯女貞及其同屬植物麗葉女貞、總梗女貞等,廣泛分布于中國西南地區,尤其是貴州、四川和云南。研究表明,小葉苦丁茶具有保健功效,其功能性成分主要包括萜類、多酚類、苯丙素類、黃酮類物質[1]。由于這些功能性成分的存在,小葉苦丁茶具有散風熱、清頭明目、生津止渴、降血壓、降血脂、降低膽固醇、抗菌消炎以及調節免疫系統等作用[1-2]。小葉苦丁茶多酚是從茶葉中提取的一類非常重要的成分,包括兒茶素類、黃酮類和酚酸類等[3],有研究表明小葉苦丁茶的降血脂、保肝等活性及清熱解毒的傳統療效與其具有很強的抗氧化活性密切相關,而大葉苦丁茶的功效與其具有很強的抗菌及抗炎活性相關。小葉苦丁茶多酚對氧自由基有很強的清除能力,能攫取在新陳代謝作用和脂質過氧化過程中產生的自由基,并轉化成活性較低的自由基,破壞自由基氧化鏈反應,同時茶多酚能夠激活和提高機體中許多抗氧化酶(如 SOD、GSH、CAT等)的活性,高效清除自由基[4-5]。天然植物中包含多酚在內的多種抗氧化成分,已經逐步被應用于抗氧化保健產品的開發中。
胃是人體重要的消化器官,胃部疾病主要表現為胃損傷,常出現胃不適、胃痛甚至胃出血等癥狀,臨床表現為胃酸過多、胃部灼燒、消化不良、腹部疼痛等。酒精、刺激性物質以及一些藥物可能引起胃損傷[6]。近年來,酒精引發的疾病發病率明顯增加,其中酒精性胃炎尤為突出,主要原因是酒精進入胃部,刺激胃粘膜,增加上皮組織細胞膜通透性,破壞胃粘膜屏障導致損傷。同時,酒精還會刺激胃組織,造成其嚴重蠕動,并引起機械損傷[7]。SOD是機體內重要的抗氧化酶,是體內唯一一種能夠清除超氧陰離子的酶類物質,其活力能夠反映機體清除自由基的能力,在抗氧化方面起著重要作用[8-9]。MDA是脂質過氧化代謝產物,可以破壞核酸、蛋白等生物大分子,造成機體損傷和疾病的發生,其產生還能加劇膜的損傷,可通過MDA了解膜脂過氧化的程度,間接測定膜系統的受損程度[10-11]。CAT是機體中一種重要的抗氧化酶,與SOD在機體內保持著動態平衡狀態[12-13],機體發生氧化應激時以上物質就會受到影響。此外,機體炎癥因子隨機體也會發生改變,誘導型一氧化氮合酶(iNOS)和環氧合酶-2(COX-2)都是炎癥相關基因,正常生理條件下,在多數器官中均檢測不到表達,當機體受到各種病理刺激或損傷時,兩者都會被迅猛誘導,表達量迅速上升[14-15]。NOS的另外兩種神經型一氧化氮合酶(nNOS)和內皮型一氧化氮合酶(eNOS)是通過其s編碼基因和對鈣的依賴性進行區別的,主要存在于上皮和血小板中,兩者可產生NO對機體進行調節。以上四種基因的表達升高或降低的特性可以作為判斷炎癥和組織損傷的標準[16-17]。有相關研究表明,茶多酚具有“七抗(抗氧化、抗炎、抗腫瘤、抗輻射、抗病毒、抗過敏、抗菌)、三降(降血脂、降血糖、降體重)、二防、(防動脈粥樣硬化、防老年癡呆)、一解(解毒)”功能[3],其作用機制主要是茶多酚能夠顯著減少中性粒細胞的滲透物、腫瘤壞死因子-α,可有效減少血清中丙氨酸轉氨酶、IL-6水平,并且可以在一定程度上降低多形核白細胞的滲透、IκBa的磷酸化,增加SOD活性,防止反應氮、氧自由基對細胞、DNA的功能結構造成損傷,進而有效防治急性炎癥,減少刺激性物質對機體組織的損壞[18-19]。小葉苦丁茶含有多酚類物質種類較多,含量也豐富,且不同地區產小葉苦丁茶的多酚種類和含量也存在差異,并且苦丁茶的使用范圍有限,目前針對其生物活性作用的研究不夠深入,缺乏動物體內研究、臨床研究和深入的分子層面的機制研究。
本文以小葉苦丁茶多酚提取物為研究對象,利用酒精與鹽酸對胃的疊加損傷作用,建立小鼠胃損傷模型,觀察小葉苦丁茶多酚對酒精鹽酸溶液誘導小鼠胃損傷的預防作用,以期為小葉苦丁茶保健功能的開發利用奠定理論依據。
1 材料與方法
1.1 材料與儀器
小葉苦丁茶 安徽省蕪湖市徽茶品茶業有限公司;沒食子酸、福林-酚試劑、ABTS 都萊生物-中國生化試劑網;DPPH 南京化成工業株式會社;總超氧化物歧化酶(SOD測定試劑盒、丙二醛(MDA)測定試劑盒、谷胱甘肽(GSH)測定試劑盒 南京建成生物工程研究所;DNase/Rnase-Free Water 北京索萊寶科技有限公司;Trizol試劑、SYBR Select Master Mix、RevertAid First Stand cDNA Synthesis Kit 美國Life techmologies公司;qPCR引物COX-2、iNOS、eNOS、nNOS、Cu/Zn-SOD、Mn-SOD、CAT、GAPDH 美國Thermo Scientific公司;其余試劑 均為國產分析純;清潔級6周齡雄性昆明小鼠50只(體質量20~25 g) 購于重慶醫科大學實驗動物中心(動物許可證SCXK(渝)2017-0001),在控溫(22±4) ℃并保濕(50±20)%條件下,用標準飼料飼養,自由飲水,1周后進行實驗。
LUX多功能性酶標儀、StepOne Plus定量PCR儀 美國Thermo Fisher Scientific公司;ICEN-24R高速冷凍離心機、MPC-P25微孔板離心機、Bioprep-24生物樣品均質儀、Nano-300微量分光光度計 杭州奧盛儀器有限公司;OLYMPUS-BX43生物顯微鏡 日本奧林巴斯公司;LDZM-60KCS-Ⅱ立式壓力蒸汽滅菌器 上海儀電科學儀器股份有限公司。
1.2 實驗方法
1.2.1 小葉苦丁茶茶多酚的提取 參考胡蓉[20]的多酚提取工藝,略有改動。稱取100 g小葉苦丁茶打碎成粉,加入400 mL的45%(V/V)乙醇溶液,90 ℃浸提30 min,再重復1次,收集2次浸提液后調節提取液pH至6.0,然后加入160 mL 的AlCl3(6 g)和ZnCl2(12 g)混合沉淀劑進行沉淀,接著對混合液進行離心分離(3000 r/min、10 min),將200 mL鹽酸(12%,V/V)加入收集到的沉淀中轉溶,分離出上清液,分別加入2次200 mL乙酸乙酯進行萃取。最后對萃取液進行旋轉蒸發(60 ℃)得到多酚提取物干物質。
1.2.2 小葉苦丁茶多酚含量的測定 分別取1、2、3、4、5 mL已知濃度為0.1 mg/mL的標準沒食子酸溶液溶于蒸餾水中,配制成不同濃度的沒食子酸溶液,按Folin-Ciocalteu比色法[21]在1 mL不同濃度的沒食子酸溶液中加入3 mL的Folin-Ciocalteu顯色劑和4.5 mL的飽和Na2CO3溶液后定容至25 mL。取顯色后溶液于747 nm處測定吸光度,計算沒食子酸的標準曲線。將樣品溶于蒸餾水中采用以上方法測定吸光度,根據標準曲線求得小葉苦丁茶多酚的含量。
1.2.3 小葉苦丁茶多酚的體外抗氧化活性測定
1.2.3.1 清除DPPH活性的測定 DPPH是一種穩定的自由基,常應用于抗氧化物對自由基清除能力的測定[22-23]。取3.9 mL 25 μg/mL DPPH溶液分別與100 μL 200、400、600和800 μg/mL的SCKPE(small-leaf kudingcha polyphenol extract)溶液混勻(A1),取3.9 mL無水乙醇與分別與100 μL濃度為200、400、600和800 μg/mL的SCKPE溶液混勻(A2),取3.9 mL濃度為25 μg/mL DPPH溶液與100 μL80%甲醇溶液混勻(A3),然后室溫下暗處靜止反應30 min,在517 nm波長處測定吸光度。每個樣品平均三次,取平均值,以100 μL濃度為200、400、600和800 μg/mL維生素C(VC)為陽性對照,計算清除率,公式如下:
1.2.3.2 清除ABTS活性的測定 根據Ren等[24]的方法,取5 mL 7 mmoL/L ABTS溶液和88 μL 140 mmoL/L的過硫酸鉀溶液避光反應12 h,用時再用無水乙醇稀釋到在波長為732 nm光下吸光值為0.70±0.02。取5 mL ABTS反應液分別與200 μL 200、400、600和800 μg/mL的SCKPE溶液混勻(A1),取5 mL無水乙醇與分別與200 μL濃度為200、400、600和800 μg/mL的SCKPE溶液混勻(A0),取5 mL濃度為ABTS反應液與200 μL 80%甲醇溶液混勻(A空),在室溫下避光反應6 min,在波長734 nm處測定吸光度。重復三次取平均值,以200 μL濃度為200、400、600和800 μg/mL VC為陽性對照,計算清除率,公式如下:
1.2.3.3 清除羥自由基活性的測定 根據Zhang等[25]的方法,取300 μL 80%甲醇溶液加入2 mL FeSO4(9 mmol/L)和50%水楊酸乙醇溶液(9 mmol/L)1.0 mL,再加入H2O2(8.8 mmol/L)1.0 mL混勻(A0);反應混合物(Ai)(4.30 mL)含FeSO4(9 mmol/L)2.0 mL、H2O2(8.8 mmol/L)1.0 mL、樣品溶液(1.0、2.0、4.0、6.0、8.0 mg/mL)0.3 mL、50%水楊酸乙醇溶液(9 mmol/L)1.0 mL;反應混合物(Aj)(4.30 mL)含FeSO4(9 mmol/L)2.0 mL、1.0 mL 80%甲醇、樣品溶液(1.0、2.0、4.0、6.0、8.0 mg/mL)0.3 mL、50%水楊酸乙醇溶液(9 mmol/L)1.0 mL。最后將反應混合液置于37 ℃水浴鍋中加熱1 h后,吸取200 μL最終反應液于96孔板中在510 nm波長處測定吸光度。重復三次取平均值,以0.3 mL(1.0、2.0、4.0、6.0、8.0 mg/mL)VC為陽性對照,計算清除率,公式如下:
1.2.3.4 還原力的測定 采用鐵離子還原力測定法[26],分別取200 μL不同濃度(200、400、600、800 μmol/L)的VC溶液和樣品液,各加入0.2 mol/L pH6.6的PBS緩沖液2.5 mL,分別加入2.5 mL 1%的K3Fe(CN)6溶液充分混勻,置于50 ℃水浴鍋加熱20 min,取出快速冷卻。加入2.0 mL體積分數為10%的三氯乙酸,進行終止反應。分別取混合液與2.5 mL蒸餾水混勻,再加入0.5 mL 0.1%的三氯化鐵,充分混合,并在室溫下靜置10 min。對照組用2.5 mL甲醇溶液反應的混合液代替VC溶液和樣品液。于700 nm處測定吸光度。重復三次取平均值,以VC為陽性對照。
1.2.4 動物實驗 將小鼠平均分為5組,每組10只,分別為正常組、模型組、雷尼替丁灌胃組(50 mg/kg)、SKCPE低濃度組(100 mg/kg)、SKCPE高濃度組(200 mg/kg)。正常組和模型組小鼠不作任何處理;雷尼替丁灌胃組每天50 mg/kg灌胃雷尼替丁溶液0.2 mL;SKCPE灌胃高、低濃度組小鼠每天按200和100 mg/kg分別灌胃SKCPE溶液0.2 mL,以上灌胃進行14 d,每次灌胃都使用12號灌胃針通過小鼠口腔緩慢插入食道,不對小鼠胃部造成機械損傷。實驗期間小鼠自由攝食和飲水,每天進行稱重,記錄飲食、飲水量。第14 d灌胃上述樣品后對小鼠進行禁食,但允許自由飲水。禁食24 h后,第15 d以60%的酒精和40%150 mmol/L鹽酸混合液為誘導劑,按小鼠體重每10 g灌胃0.1 mL對小鼠進行胃損傷誘導[27](正常組不誘導)。誘導0.5 h后,眼球取血并取胃組織用一次性注射器吸出胃液測定胃液量和胃液pH。
1.2.5 小鼠胃損傷水平測定 小鼠解剖后取胃組織平鋪拍照,通過ImageJ 1.44軟件測定胃損傷面積,根據公式計算抑制率,對各組小鼠胃組織損傷程度進行分析。
抑制率(%)=(模型組小鼠胃損傷面積-試驗組小鼠胃損傷面積)/模型組小鼠胃損傷面積×100
1.2.6 小鼠血清及胃組織水平測定 將小鼠血漿于4 ℃、4000 r/min離心10 min收集血清,按照試劑盒說明書測定小鼠血清以及胃組織勻漿液中超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)、丙二醛(MDA)含量。
1.2.7 胃組織病理學觀察 取小鼠胃組織于裝有10%的福爾馬林溶液中進行固定,并用不同濃度乙醇脫水,用二甲苯置換胃組織中乙醇使組織透亮,再用石蠟包埋切片,采用H&E染色法對切片染色,并用光學顯微鏡進行觀察。
1.2.8 qPCR實驗測定小鼠胃組織mRNA表達 取小鼠胃組織100 mg勻漿,用Trizol試劑提取胃組織細胞中總RNA,通過微量紫外分光光度計檢測RNA濃度并稀釋為1 μg/mL,取2 μL稀釋后的總RNA提取液,依次加入1 μL的OligodT18、RNase、dNTP、MLV酶和10 μL的5×Buffer,在37 ℃ 120 min,99 ℃ 4 min,4 ℃ 3 min條件下合成cDNA。然后以反轉錄-聚合酶鏈反應法擴增nNOS、eNOS、iNOS、COX-2、Mn-SOD、Gu/Zn-SOD和CAT(引物表1),同時以持家基因(GAPDH)作為內參照按同樣條件進行擴增。用ImageJ 1.44軟件進行半定量分析[28]。

表1 引物的序列Table 1 Primer sequences
1.3 數據統計
對每只小鼠的血清和組織測定實驗進行三次平行實驗后取平均值,采用SPSS 17.0統計軟件中One-Way ANOVA 法進行單因素方差分析,多組均數的兩兩比較采用LSD法檢驗,分析各組數據在p<0.05水平上相互是否具有顯著差異。
2 結果與分析
2.1 小葉苦丁茶多酚提取物的含量
按照1.2.2方法繪制沒食子酸標準液的標準曲線,得出標準曲線的回歸方程為y=6.7059x-0.2294(R2=0.9983),小葉苦丁茶多酚吸光度為0.792,通過計算得小葉苦丁多酚提取物含量為5.082 μg/ml。
2.2 小葉苦丁茶多酚提取物體外抗氧化效果
2.2.1 小葉苦丁茶多酚提取物(SKCPE)的DPPH自由基清除能力 DPPH自由基有單電子體,當有自由基清除劑存在時,與其單電子配對而使其吸收逐漸消失,其褪色程度與其接受的電子數量成定量關系,從而間接定量自由基清除劑的含量。樣品對DPPH自由基清除能力的大小可反映該樣品抗氧化能力的大小[29]。由圖1可以看出,小葉苦丁茶和VC在一定濃度范圍內都對DPPH有一定的清除作用,隨著濃度的增加對DPPH清除能力也增強。從整個濃度增加趨勢看,VC對DPPH自由基的清除率緩慢增強,小葉苦丁茶多酚對DPPH的清除率在600 μg/mL處急劇上升,當濃度800 μg/mL 時,小葉苦丁茶多酚的清除能力達到32.15%,VC的清除能力達到11.56%。由此說明小葉苦丁茶多酚對DPPH的清除能力較VC強。
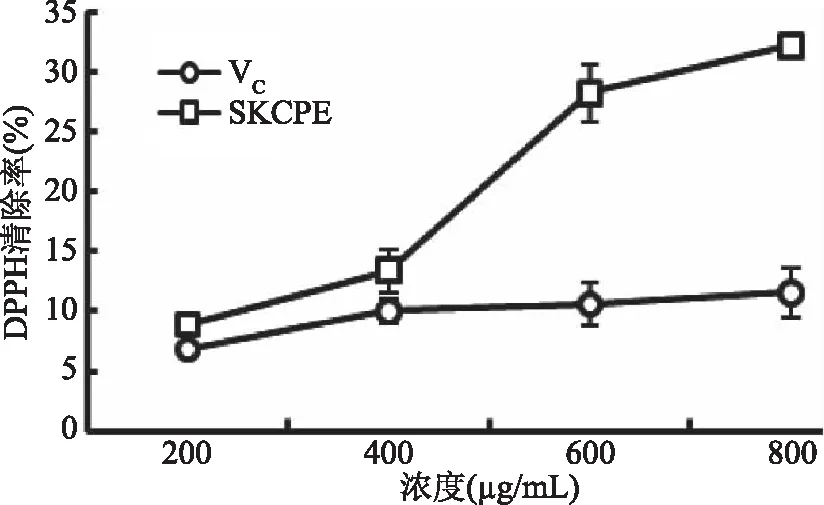
圖1 小葉苦丁茶多酚提取物(SKCPE)的DPPH自由基清除能力
2.2.2 小葉苦丁茶多酚提取物(SKCPE)的ABTS自由基清除能力 ABTS法用于親水性和親脂性物質抗氧化能力測定,在適當的氧化劑作用下氧化成綠色的ABTS+·,在抗氧化物存在時ABTS+·的產生受到抑制,自由基減少,使其藍綠色褪去,褪色越明顯,表明該物質的抗氧化能力越強[30]。由圖2可以看出,不同的樣品不同的濃度對ABTS自由基有不同的清除效率,清除率和質量濃度呈正相關的關系。在相同條件下,小葉苦丁茶多酚的ABTS自由基清除率均高于VC。在實驗濃度范圍內,當樣品濃度為800 μg/mL時,小葉苦丁茶多酚和VC對ABTS自由基的清除率分別為37.47%和25.88%。由此說明小葉苦丁茶多酚對ABTS自由基有較強的清除能力,清除效果優于同濃度下的VC。
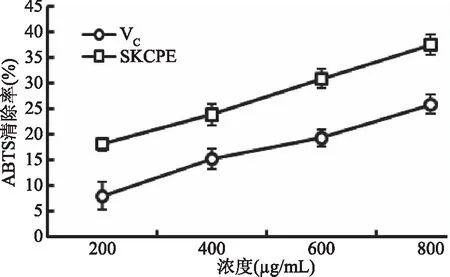
圖2 小葉苦丁茶多酚提取物(SKCPE)的ABTS自由基清除能力
2.2.3 小葉苦丁茶多酚提取物(SKCPE)的羥自由基清除能力 自由基損傷機體的心、腦、肝等細胞組織,是機體產生某些疾病和衰老癥狀的主要原因,尤其是羥自由基對機體的損傷尤為嚴重[31]。羥自由基屬于活性氧的一種,能導致許多有害效應,當加入羥自由基去除劑時,去除效果顯著。實驗對小葉苦丁茶多酚和VC在2、4、6、8 mg/mL的濃度條件下對羥基自由基的清除能力進行分析。由圖3可看出,隨著樣品質量濃度的增加,各樣品對羥自由基的清除率逐漸加強,在濃度為8 mg/mL時,小葉苦丁茶多酚和VC的清除率最高,分別為48.40%和44.32%,由此表明小葉苦丁茶多酚清除率明顯高于VC。

圖3 小葉苦丁茶多酚提取物(SKCPE)的羥自由基清除能力
2.2.4 小葉苦丁茶多酚提取物(SKCPE)的鐵離子還原能力 還原能力能夠表征物質在氧化還原反應中給出電子自身發生氧化的能力,通過三價鐵離子還原法觀察物質的還原能力,以吸光度表示結果,吸光度值越大,說明樣品的還原能力越強[32]。由圖4可看出,隨著樣品質量濃度的增加,吸光度逐漸增加,即還原力逐漸增強。在濃度為200 μg/mL時,小葉苦丁茶多酚的還原力與VC相近,但小于VC;在濃度為800 μg/mL時,小葉苦丁茶和VC較200 μg/mL時的還原力有所上升,上升趨勢較緩慢,VC隨濃度增加還原力增強,且趨勢較明顯。總體上看,VC、小葉苦丁茶多酚的還原力與濃度呈正相關,變化趨勢為VC強于小葉苦丁茶多酚。

圖4 小葉苦丁茶多酚提取物(SKCPE)的鐵離子還原力
2.3 小葉苦丁茶多酚提取物對胃損傷小鼠胃損傷水平的影響
小鼠經鹽酸/乙醇誘導劑誘導后,小鼠胃部上皮頂端胞漿膜受到破壞,細胞脫落,出現糜爛和潰瘍,損傷嚴重則會累及血管引起胃出血,并引起胃黏膜上皮層發生改變[33-34]。由圖5可知,與正常組相比,模型組小鼠胃黏膜出現明顯的糜爛和出血,而SKCPE低劑量組、SKCPE高劑量組和雷尼替丁組小鼠胃黏膜的出血和糜爛面積均明顯小于模型組,損傷程度為SKCPE低劑量組>SKCPE高劑量組>雷尼替丁組。

圖5 小葉苦丁茶多酚提取物對鹽酸/乙醇誘導胃黏膜損傷小鼠的胃外觀觀察
由圖5和表2可知,胃損傷模型組小鼠的損傷程度顯著高于其余組(p<0.05)。藥物治療雷尼替丁組小鼠的胃損傷程度顯著低于SKCPE高、低劑量組和模型組,抑制率顯著高于SKCPE高、低劑量組和模型組(p<0.05),SKCPE高、低劑量組小鼠的胃損傷程度顯著低于模型組,抑制率顯著高于模型組(p<0.05),SKCPE高劑量組的抑制率達到40.54%,與雷尼替丁組相差21.62%。由此可知,小葉苦丁茶多酚對小鼠胃損傷有一定的預防作用,SKCPE高劑量組的效果更為顯著。

表2 小葉苦丁茶多酚提取物治療鹽酸/乙醇誘導胃損傷小鼠的胃損傷程度Table 2 Gastric injury levels of HCl-ethanol-induced gastric injury in rats with polyphenols of small-leaved kudingcha extract treatment
2.4 小葉苦丁茶多酚對胃損傷小鼠胃液量和胃液pH的影響
小鼠胃受到刺激和損傷時會出現胃液分泌過多,胃酸pH下降[35]。由表3可知,與正常組相比,模型組、SKCPE高、低劑量組和雷尼替丁組的胃液量顯著增加(p<0.05),胃液pH顯著降低(p<0.05),模型組pH最低為1.70±0.67,而雷尼替丁組和SKCPE高劑量組小鼠的胃液量和胃液pH不存在顯著性差異,都與正常組的各項指標更為接近。由此說明,小葉苦丁茶多酚對小鼠胃液量分泌及胃液pH以及對小鼠胃部黏膜具有一定的保護作用,其中高劑量的SKCPE與雷尼替丁對小鼠胃損傷的預防保護效果相近。

表3 各組小鼠的胃液量及胃液pH Table 3 Gastric fluid volume and gastric juice pH of each group of mice
2.5 小葉苦丁茶多酚提取物對小鼠胃組織病理學變化的影響
在光學顯微鏡下觀察由鹽酸/乙醇誘導胃損傷小鼠的胃組織病理切片如圖6所示。正常組小鼠胃粘膜組織結構完整,未出現充血和炎性細胞浸潤[36];模型組小鼠胃粘膜大量上皮細胞脫落,腺體結構雖未受到破壞,但細胞受損嚴重,有大量炎性細胞浸潤,區域內可見較多紅細胞,充血情況嚴重;雷尼替丁組小鼠胃粘膜同模型組相比損傷情況明顯改善;低濃度小葉苦丁茶多酚灌胃組小鼠胃粘膜組織結構變化同模型組相比,仍有上皮細胞結構脫落,但胃粘膜炎性細胞浸潤程度顯著降低,紅細胞數量也明顯減少,損傷狀況有所緩解;高濃度小葉苦丁茶多酚灌胃組小鼠胃黏膜組織結構比較完整,炎性細胞及紅細胞數量明顯下降,較低濃度組改善程度更明顯。由此可看出,小葉苦丁茶多酚對小鼠胃損傷有預防作用,并存在劑量效應關系。

圖6 小葉苦丁茶多酚提取物對鹽酸/乙醇誘導胃損傷小鼠的胃組織形態學變化的影響(200×)
2.6 小葉苦丁茶多酚提取物對小鼠血清及胃組織SOD、GSH、MDA水平的影響
從表4、表5可知,正常組小鼠血清及胃組織中SOD活性和GSH含量均最高,脂質過氧化終產物MDA含量最低,而模型組小鼠血清及胃組織中SOD活性、GSH含量和MDA含量與正常組相反,并存在顯著性差異(p<0.05)。低劑量小葉苦丁茶多酚灌胃組小鼠的SOD、GSH水平與正常組相比顯著降低(p<0.05),但與模型組相比其SOD活性和GSH含量顯著上升(p<0.05),MDA含量在血清和胃組織中都顯著低于模型組、高于正常組(p<0.05)。高劑量小葉苦丁茶多酚灌胃小鼠血清及胃組織中SOD活性和GSH含量較低劑量組顯著升高(p<0.05),MDA含量顯著降低(p<0.05),各指標水平與雷尼替丁組灌胃小鼠相當,都趨近于正常組水平。高劑量組小鼠血清中SOD與正常組僅相差33.04 U/mL,組織中僅相差6.96(U/mg prot);雷尼替丁組小鼠的SOD、MDA、GSH水平都顯著優于模型組和高、低小葉苦丁茶多酚灌胃組小鼠,基本接近正常組。由此可看出,小葉苦丁茶多酚能顯著上調胃損傷小鼠血清及胃組織中SOD活性和GSH含量,下調MDA含量,且濃度越高,效果越顯著。

表4 小葉苦丁茶多酚提取物對小鼠血清SOD、GSH、MDA水平的影響Table 4 Effect of SKCPE on the level of SOD,GSH,MDA in serum of mice

表5 小葉苦丁茶多酚提取物對小鼠胃組織SOD、GSH、MDA水平的影響Table 5 Effect of SKCPE on the level of SOD,GSH,MDA in gastric tissue of mice
2.7 小葉苦丁茶多酚提取物對相關基因轉錄水平的影響
2.7.1 小葉苦丁茶多酚提取物對小鼠胃組織中Cu/Zn-SOD、Mn-SOD、CAT mRNA表達的影響 從表6可知,與正常組相比,模型組和經處理過的SKCPE低劑量組、SKCPE高劑量組和雷尼替丁組中CAT、Cu/Zn-SOD、Mn-SOD的表達量均顯著降低(p<0.05)。其中模型組中相對表達量最低,小葉苦丁茶多酚高、低劑量組中Mn-SOD、CAT表達量都顯著高于模型組低于正常組,且與模型組之間存在顯著差異(p<0.05),小葉苦丁茶多酚低劑量組小鼠胃組織中CuZn-SOD在mRNA水平上的相對表達量與模型組不存在顯著性差異,但SKCPE低劑量組的相對表達量(1.53±0.38)高于模型組。SKCPE低、高劑量組中Cu/Zn-SOD、Mn-SOD、CAT mRNA表達存在顯著性差異(p<0.05),且高劑量組相對表達量高于低劑量組。雷尼替丁組與正常組小鼠胃組織中Cu/Zn-SOD、Mn-SOD、CAT mRNA表達存在顯著性差異(p<0.05),但與SKCPE高劑量組不存在顯著性差異。由此說明,小葉苦丁茶多酚能顯著提高由鹽酸/乙醇誘導的胃損傷小鼠模型胃組織中Cu/Zn-SOD、Mn-SOD、CAT的表達量,高劑量的小葉苦丁茶多酚對小鼠胃損傷的預防效果與雷尼替丁效果相當,均能有效降低小鼠胃損傷程度。

表6 小葉苦丁茶多酚提取物對小鼠胃組織中Cu/Zn-SOD、Mn-SOD、CAT相對表達量的影響Table 6 Effect of polyphenols of SKCPE on Cu/Zn-SOD,Mn-SOD,CAT relative experssion in gastric tissue of mice
2.7.2 小葉苦丁茶多酚提取物對小鼠胃組織中eNOS、nNOS、iNOS、COX-2 mRNA表達的影響 胃損傷模型小鼠胃組織相關炎癥因子相對表達量如表7所示。由表7可知,模型組的iNOS和COX-2表達最強(p<0.05),正常組的表達最弱;小葉苦丁茶多酚灌胃小鼠胃組織中iNOS和COX-2基因的 mRNA 表達量與其他組具有顯著性差異(p<0.05),小葉苦丁茶多酚灌胃組iNOS和COX-2的相對表達量顯著低于模型組,其中高劑量組顯著低于低劑量組(p<0.05),灌胃組和陽性藥物雷尼替丁組高于正常組。eNOS和nNOS的相對表達量則與iNOS和COX-2相反,正常組的相對表達量最高,模型組最低,小葉苦丁茶多酚灌胃組的表達量均顯著高于模型組(p<0.05),低于正常組和陽性藥物雷尼替丁組(p<0.05),SKCPE高劑量灌胃組小鼠的eNOS和nNOS的相對表達量顯著高于SKCPE低劑量組(p<0.05),且與雷尼替丁組小鼠的相對表達量差距較小。由此說明小葉苦丁茶多酚能較好地抑制炎癥,對鹽酸/乙醇誘導胃損傷模型小鼠胃組織具有保護作用,在高濃度時效果更佳。
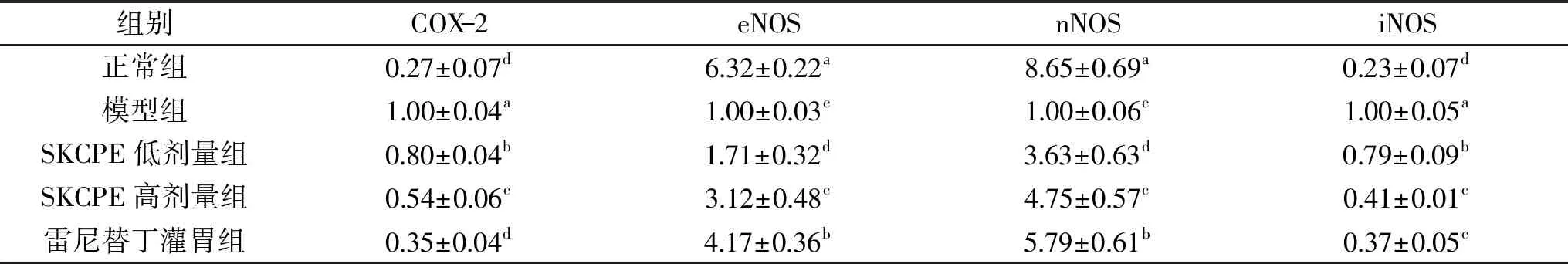
表7 小葉苦丁茶多酚提取物對小鼠胃組織中eNOS、nNOS、iNOS、COX-2相對表達量的影響Table 7 Effect of polyphenols of SKCPE on eNOS,nNOS,iNOS,COX-2 relative experssion in gastric tissue of mice
3 結論
本研究以小葉苦丁茶多酚提取物作為研究對象,測定其在體外的抗氧化效果,觀察了SKCPE對鹽酸/乙醇誘導胃損傷的預防作用,針對其多酚物質的胃損傷預防效果進行了相關基因的轉錄水平研究,從胃損傷抑制率、胃液分泌量、胃液pH、胃組織病理切片、血清及胃組織中SOD活性和GSH、MDA含量、胃組織中Cu/Zn-SOD、Mn-SOD、CAT、eNOS、nNOS、iNOS、COX-2的mRNA表達等方面進行了研究,結果顯示,SKCPE有較強的體外抗氧化能力,在動物實驗中相對模型組小鼠,SKCPE能抑制鹽酸/酒精對小鼠胃組織造成的影響,緩解胃黏膜受損,使小鼠機體各項指標向正常狀態轉變,充分展示了SKCPE可以降低鹽酸/乙醇誘導的胃損傷程度,且存在質量效應關系,高濃度小葉苦丁茶多酚的作用更為強烈。基于體外和動物實驗結果可以看出,小葉苦丁茶多酚提取物作為有效的天然活性物質,對胃損傷有顯著預防效果,其作用機理和人體實驗有待進一步挖掘。

