應用達芬奇機器人切除原發性腹膜后巨大腫瘤的臨床研究
汪金榮,何樂業,劉斌
(中南大學湘雅三醫院 泌尿外科,湖南 長沙 410013)
達芬奇機器人手術系統(Da Vinci surgical system,DVSS)已廣泛運用于外科、婦產科和耳鼻喉科等臨床科室,尤其是復雜腫瘤手術,達芬奇機器人優勢明顯。腹膜后腫瘤位置深,周圍毗鄰大血管和臟器較多,腫塊較大時,開放手術和腹腔鏡手術暴露和分離腫瘤難度大。達芬奇機器人擁有4個機械臂和7個自由度的內腕,靈活而精準,且有10倍以上放大效果,處理腹膜后巨大腫瘤優勢較大。本院2015年10月-2018年1月實施達芬奇機器人原發腹膜后巨大腫瘤切除術5例,手術均完成順利,術后恢復好。現報道如下:
1 資料與方法
1.1 一般資料
本組患者共5例。其中,男3例,女2例,年齡45~59歲,平均50.6歲,體質指數(body mass index,BMI)<24 kg/m2的 2例,24~ 28 kg/m2的 3例。合并高血壓3例,合并糖尿病1例,1例患者術前有間歇發熱2個月的癥狀。腫瘤位于盆腔以上腹膜后3例,其中2例位于腎蒂旁,1例位于左腎上方;盆腔腹膜后腫瘤2例,分別位于膀胱后方和盆腔右側。腫瘤長徑為6.0~13.0 cm,長徑平均9.0 cm,切除最大腫瘤約13.0 cm×10.0 cm(圖1)。術前檢查均無腫瘤遠處轉移。
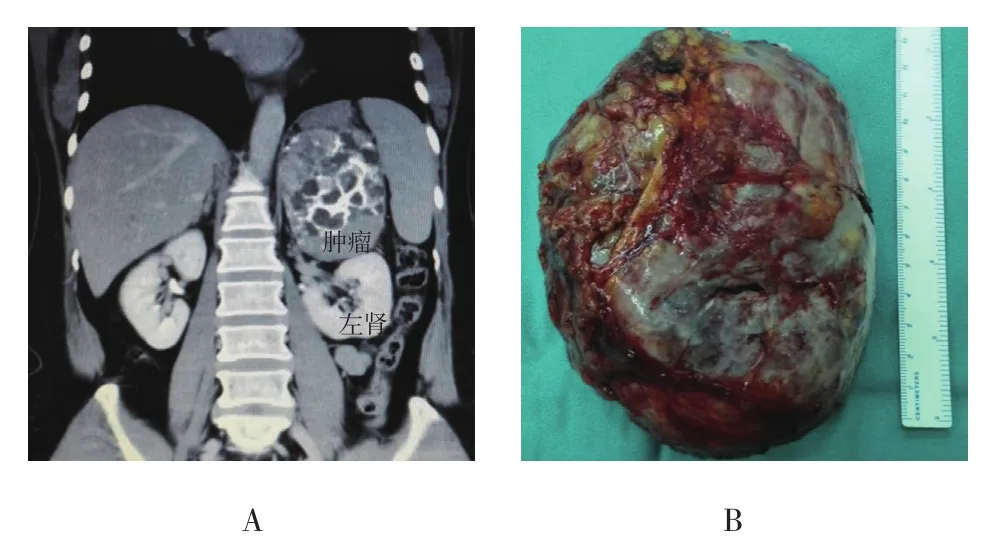
圖1 腹膜后巨大腫瘤CT影像與手術切除標本Fig.1 Imaging of CT and surgical specimen of huge retroperitoneal tumor
1.2 手術方法
1.2.1 經腹途徑盆腔以上腹膜后腫瘤經腹途徑體位。氣管插管全身麻醉,健側側臥位或60~70°斜側臥位,抬高腰橋。以Veress針穿刺建立氣腹,保持氣腹壓12~14 mmHg。鏡頭孔Trocar位于臍部或臍部附近,1、2號器械孔Trocar位于鎖骨中線附近,分別距鏡頭孔8.0~10.0 cm,輔助孔位于鏡頭孔與1號器械孔連線中點內下方,置入12 mm Trocar(圖2A)。機器臂從患者背側進入,連接機器臂與各Trocar,器械安裝好后,沿結腸旁溝打開后腹膜,離斷肝(脾)結腸韌帶,將結腸翻向內側,顯露腫瘤,沿腫瘤表面游離,供應腫瘤較粗血管以鈦夾或Hemo-lock夾閉后離斷,完全游離腫瘤,擴大穿刺通道后,將腫瘤完整取出送病理檢查。
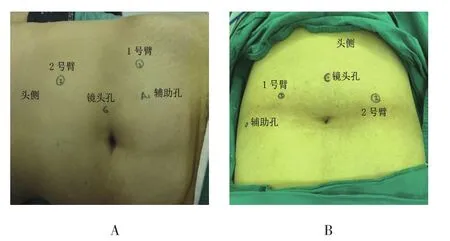
圖2 機器人輔助腹膜后腫瘤切除術經腹途徑Trocar定位Fig.2 The Trocar location of robot-assisted laparoscopic retroperitoneal tumor resection through transperitoneal approach
盆腔腫瘤經腹途徑。全身麻醉,下肢剪刀位,頭低腳高15~30°,以Veress針穿刺建立氣腹。鏡頭孔Trocar位于臍部上方1.0~2.0 cm,左右器械孔位于左右鎖骨中線上,距鏡頭孔8.0~10.0 cm,留置10 mm Trocar,輔助孔位于右器械孔外下方,留置12 mm Trocar(圖2B)。安裝好器械后,于膀胱直腸凹或膀胱左(右)側打開盆腔腹膜,顯露腫瘤后游離,術中注意保護膀胱、直腸及閉孔神經。
1.2.2 經腹膜后途徑全身麻醉,健側側臥位,抬高腰橋。于腋中線內側2.0 cm髂嵴上方2.0 cm處作一小切口,置入12 mm Trocar作鏡頭孔,以鏡體直接分離腹膜后間隙,將腹膜推向內下方,直視下于腋后線12肋下、腋前線內側2.0 cm處留置10 mm Trocar,作1、2號器械孔,輔助孔位于鏡頭孔與腋前線內側器械孔連線中點內下方約8.0 cm,留置12 mm Trocar。見圖3。清除腹膜外脂肪后,打開Gerota筋膜,游離腎周脂肪,找到腹膜后腫瘤,沿腫瘤表面游離,夾閉后離斷腫瘤較粗供應血管,完整取出腫瘤。
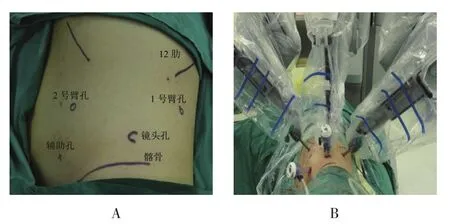
圖3 機器人輔助腹膜后腫瘤切除術經腹膜后途徑Trocar定位Fig.3 The Trocar location of robot-assisted laparoscopic retroperitoneal tumor resection through retroperitoneal approach
2 結果
5例患者均順利完成手術,無中轉開放。經腹手術入路3例,經腹膜后手術入路2例。手術時間100~160 min,平均122 min;術中出血20~800 ml,平均404 ml,2例術中輸濃縮紅細胞300 ml,3例未輸血,術后5例患者均未再輸血。術中術后無ClavienⅡ級以上并發癥。住院時間12~18 d,平均15 d。術后病理檢查結果顯示淋巴瘤、神經鞘瘤、血管周上皮樣細胞腫瘤(perivascular epithelioid cell tumor,PEComa)、副神經節瘤和間葉源性腫瘤各1例。
隨訪6~33個月,術后1個月復查CT與生化檢查,然后每3個月復查1次。隨訪至2018年7月,1例腹膜后淋巴瘤患者,殘留少許腫瘤附著于腔靜脈壁,出院1個月后轉腫瘤科行化療,經4個療程化療后,殘留腫瘤明顯縮小,達部分緩解。其他4例患者腹膜后腫瘤完整切除,無復發。
3 討論
腹膜后腫瘤是指發生于腹膜后間隙的原發腫瘤,來源于脂肪組織、血管、神經、淋巴管、肌肉和胚胎殘留組織等,不包括腹膜后臟器(腎、腎上腺等)來源的腫瘤和轉移腫瘤[1],60%~80%的腹膜后腫瘤為惡性腫瘤。腹膜后間隙空間小、位置深,腹膜后腫瘤手術顯露相對困難。傳統的腹膜后腫瘤手術方式主要有開放手術和腹腔鏡手術。為充分暴露腫瘤,開放手術切口長、創傷大,且恢復慢。當腹膜后腫瘤較小時,腹腔鏡手術基本能順利切除腫瘤,但腫瘤較大時,由于普通腹腔鏡器械為直桿式、僅有4個自由度,分離腫瘤背側時,往往需用力擠壓腫瘤與周圍臟器,會導致腫瘤破裂、出血或相鄰臟器損傷,如果手術時間長,術者較易疲勞。大于6.0 cm的腹膜后腎上腺腫瘤腹腔鏡切除術,手術難度顯著增加,術中失血、中轉開放手術率、包膜破裂和種植轉移風險明顯增加[2]。近年來,隨著我國引進手術機器人越來越多,在一些大型醫院中,機器人輔助腹膜后腫瘤手術開展逐漸增多,由于其發病率低,機器人輔助腹膜后原發腫瘤切除報道較少,多數為個案報道[3-5]。相對普通腹腔鏡,DVSS具有以下優勢:①采用雙攝像頭,形成高清晰度的三維立體影像,且為裸眼3D,放大倍數可達10~15倍,手術視野更加清晰、結構層次更加清楚,可減少腫瘤周圍血管、組織損傷;②有4個機械臂,每個機械臂有6個關節7個方向自由度,每個關節活動范圍超過90°,操作更加靈活,可深入狹小空間進行精細操作;③通過操控機械臂進行手術,可避免人的生理震顫,增加了手術的穩定性和安全性;④動作縮減系統能按比例(5∶1和3∶1)縮小術者的動作幅度[4],術者移動操作桿5 mm或3 mm,器械末端僅移動1 mm,使操作更加精細;⑤術者可操控各機械臂和鏡頭,使術者的意圖得到充分貫徹,減少了術者和助手之間的不協調;⑥人機分離,操作桿的設計符合人體工程學,術者可舒適地坐著手術,極大地減輕術者的疲勞度;⑦學習曲線比腹腔鏡短[6-8]。由于以上優點,使DVSS在復雜腫瘤手術運用中優勢明顯。DVSS仍存在一些缺點,如:無觸覺反饋,機器占地面積大,設備昂貴,手術費用高。因此,尚無法在基層醫院普及。本組5例原發性腹膜后腫瘤患者,腫瘤直徑均≥6.0 cm,平均直徑達9.0 cm,5例患者均成功實施DVSS輔助腹膜后腫瘤切除術,無中轉開放手術。其中4例完整切除腫瘤,1例腹膜后淋巴瘤患者,腫瘤與腔靜脈粘連,質地較脆,無法完整切除,殘留少許腫瘤附著于腔靜脈壁。本組患者術后均恢復良好,除2例患者術中輸血外,所有患者無Clavien Ⅱ級以上并發癥。術后隨訪6~33個月,淋巴瘤患者術后行化療,殘余腫瘤明顯縮小,達部分緩解,余患者均無復發,由于隨訪時間短,長期療效還需進一步觀察。
DVSS腹膜后腫瘤手術可采用經腹與腹膜后入路,經腹入路空間大,建立穿刺通道比較方便,國外術者多采用此途徑,但術中腸道及肝脾等臟器會影響腫瘤暴露,術后有發生粘連性腸梗阻的風險。經腹膜后入路空間較經腹入路小,但腹膜外器官少,有時可直接抵達腫瘤位置,術后腸道功能恢復快。本科早期均采用經腹途徑,在對DVSS操作熟練后,經腹膜后途徑手術逐漸增多,由于機械臂關節較粗,如果穿刺通道Trocar之間距離較近,手術時可造成機械臂之間碰撞和干擾。因此,兩穿刺通道距離最好>8.0 cm。筆者采用直視下鏡體直接擴張腹膜后空間的方法,而非用球囊擴張法。首先建立鏡頭孔Trocar,在直視下以鏡體直接鈍性分離腹膜后間隙,然后置入腋后線12肋下Trocar,通過此Trocar以吸引器或剝離棒將腹膜盡量向內側推開,以便建立腋前線內側Trocar和下腹部輔助孔Trocar,1個輔助孔即可。腹膜后機器人手術建立穿刺通道比較關鍵,當腹膜被充分推開后,穿刺通道間距合適,即可獲得滿意的手術空間。腹膜后空間建立后,手術步驟與傳統腹腔鏡類似,機器人專用鉗和剪的末端關節較靈活,可彎曲、旋轉,活動度>90°,使其可深入狹小的空間和腫瘤的背側進行精細游離。腹膜后巨大腫瘤供應血管較多,且腫瘤常與腹主動脈、腔靜脈、髂血管和腎動靜脈等大血管關系密切,在分離腫瘤與周圍血管時,機器人鏡頭可將術野放大10倍以上,且無手臂震顫的干擾,可清晰地進行精細游離,明顯減少周圍重要血管的損傷,術中出血少。3D打印可提供腫瘤與周圍血管和器官三維圖像和模型,術者可據此制定手術方案,選擇最佳手術入路,還可在模型上進行模擬手術,提高手術熟練度,在術中分離時,可預知何處有重要血管、器官,以避免損傷。蘇昭杰等[9]進行了3D打印在腹膜后腫瘤手術中運用的研究,取得了滿意效果。如有條件,術前可行腹膜后腫瘤3D打印,對手術幫助較大。
腹膜后腫瘤病理來源廣泛,本組5例腹膜后巨大腫瘤病例,其病理來源各不相同,包括:淋巴瘤、神經鞘瘤、PEComa、副神經節瘤和間葉源性腫瘤各1例。腹膜后淋巴瘤罕見,無特異性癥狀,腫瘤可累及多個淋巴結,融合成團,形態不規則,常包繞血管但不侵犯,手術切除往往比較困難,對化療敏感[10-11],術前可在B超或CT引導下穿刺活檢或手術取材定性。本組1例淋巴瘤患者體檢發現腹膜后腫塊,無明顯癥狀,術前血常規與骨穿檢查均無明顯異常,CT掃描示肝腎隱窩處腫塊,由于腫瘤被血管和周圍臟器遮擋,術前無法行穿刺活檢。術中見腫瘤包膜菲薄,且與腔靜脈和腎蒂血管緊密粘連,分離困難,采取緊貼腔靜脈和腎動靜脈切除腫瘤,有少許腫瘤殘留。術后患者體溫恢復正常,確診淋巴瘤后繼續行化療。血管周上皮樣細胞分布于毛細血管周圍,是一種多潛能細胞,其發生的腫瘤稱為PEComa,PEComa家族包括:血管平滑肌脂肪瘤(angiomyolipoma,AML)、肺透明細胞“糖”瘤(clear cell “sugar” tumor of the lung,CCST)、淋巴管平滑肌瘤(lymphangioleiomyoma,LAM)、鐮狀韌帶透明細胞肌黑色素瘤(clear cell myomelanocytic tumor,CCMMT)和少見的發生于胰腺、直腸、腹膜、子宮、陰道、大腿和心臟的透明細胞腫瘤,非AML、CCST和LAM的PEComa相當罕見[12]。本組1例腹膜后PEComa患者,腫瘤巨大,大小11.0 cm×10.0 cm×10.0 cm,位于膀胱與直腸之間,外觀呈囊狀,內含清亮液體。腹膜后間葉源性腫瘤、副神經節瘤和神經鞘瘤報道相對稍多,多數有包膜或假包膜。
DVSS具有高倍放大的3D視野、靈活的機械臂和除顫功能,使其能安全地完成復雜的腹膜后巨大腫瘤手術,術后并發癥少、恢復快。在熟練掌握機器人操作后,經腹和腹膜后途徑均能很好地完成手術。

