永生化肝臟前體樣細胞可用于生物人工肝治療的研究
李偉建 王振宇 袁天杰 景宏舒 代孟君 彭媛 鄢和新 翟博
生物人工肝(bioartificial liver,BAL)可以暫時替代肝臟發揮相應的功能。種子細胞是BAL的核心,目前用于BAL的細胞有人原代細胞、C3A、豬肝細胞、誘導分化肝細胞等。但是由于種種原因,BAL臨床推進緩慢,因此急需尋找到用于生物人工肝的新種子細胞。2018年,在前期的小鼠肝前體樣細胞(HepLPC)可逆轉化的基礎上通過小分子組合將人原代細胞轉化為前體樣細胞,實現人原代肝細胞體外快速增殖[1]。本實驗對前體樣細胞進行永生化并進行功能驗證,尋找新的用于生物人工肝治療的細胞,為臨床生物人工肝治療提供參考。
資料與方法
一、材料與試劑
肝臟組織標本來自上海交通大學醫學院附屬仁濟醫院腫瘤介入科患者血管瘤旁組織。DMEM/F12購自美國Invitrogen公司;N-2 無血清添加劑、100X和B-27 無血清添加劑、50X以及雙抗購自上海源培生物科技股份有限公司;Trizol和Sybgreen購自上海碧云天生物科技公司;FBS購自于BI公司;相關引物合成自上海華津生物。HGF、EGF、Y27632、CHIR99021、A83-01購自于美國TargetMol公司;0.25% T/E購自上海源培生物科技股份有限公司;Large T抗原慢病毒購自吉凱基因。
二、實驗方法
(一)人原代細胞的分離與純化與培養 血管瘤旁切除(1~5 g)正常肝組織,通過改良的兩步膠原酶灌注法分離原代人肝細胞,熒光激活細胞分選術(FACS)純化肝細胞以排除CD24 +或EpCAM +陽性祖細胞獲得HepLPC[1-2]。將細胞以0.5~2×104cells/cm2接種在有Matrigel(約0.87 μL/cm2)包被的培養皿上,采用增殖與擴增培養基(TEM)培養,接種后6~12 d,用0.25%T/E消化重懸后以1∶3~6的比例傳代,每隔24 h更換1次培養基。將1 000個細胞接種在6孔Matrigel包被的平板上,用0.25%T/E消化后在指定的天數進行細胞計數。
(二)永生化的建立 2~3×105cells/孔的濃度接種于用Matrigel鋪板后的6孔板中, 24 h后待細胞匯合率到達80%時開始永生化的建立。MOI=20加入慢病毒Large T antigen(約50 μL/孔)轉染細胞,加入8 μg Polybrene增強感染效果。感染8 h后更換培養基,轉染病毒72 h后,以1∶1 000加入腺嘌呤素(puro)至TEM培養進一步篩選成功轉染細胞。24~48 h后換TEM培養基,并重新傳代至已用Matrigel鋪板的6孔板。細胞以1∶3的密度穩當細胞傳代超過20代的一般認為永生化建系成功。永生化建立過程中注意對細胞凍存與復蘇進行保種,同時進行細胞計數。
(三)細胞分化 將3×105iHepLPC接種到Matrigel包被好的6孔板中,增殖1~2 d,直至達到90%以上的細胞覆率。然后更換為M7分化培養基分化7 d。
(四)實時PCR 使用Trizol試劑從培養的細胞中提取RNA,進行反轉錄,得到cDNA使用7 300實時PCR系統,Sybgreen并以GAPDH為內參進行內部控制計算相關基因的表達量。PCR系統設置參數為20 μL體系,95℃ 5 min,95℃ 15 s、60℃ 15 s、72℃ 35 s,共40個循環;循環后使用機器默認程序進行熔解曲線采樣。后按照△△CT方式進行數據分析,每個樣本重復3次。引物序列見表1。

表1 引物序列
(五)尿素生成 iHepLPC培養基中加入3 mmol NH4Cl,24 h后吸取細胞上清,3 000 rpm離心5 min去除沉淀,檢測細胞上清中的NH4+的含量,從而判定iHepLPC細胞的氨清除速率。尿素含量檢測方法按試劑盒說明書進行。
(六)白蛋白ELISA 細胞更換培養基后24 h收集上清,3 000 r/min離心5 min去除沉淀,培養液中的白蛋白和AAT分別用人白蛋白ELISA試劑盒和人AAT ELISA試劑盒進行檢測,操作按照試劑盒內說明書進行。
(七)急性肝衰竭小豬血漿以及對細胞的功能反應 采用0.5 g/kg氨基半乳糖氨(D-gal)誘導小豬急性肝衰竭,24 h后小豬出現ALF的相關癥狀與體征,血氨、出凝血以及肝腎功能達到急性肝衰竭指標。取小豬血液,4 500 r/min離心15 min,收集上清作為急性肝衰竭血漿-80℃保存備用。將細胞分化培養基更換成急性肝衰竭血漿,反應6 h,計算細胞活率,同時驗證細胞的功能基因以及合成與解毒功能。
三、統計學處理
使用軟件GraphPad Prism 7。數值均以均值±標準差表示,兩組數據比較使用Student′sttest。使用One-way analysis of variance (ANOVA)進行3組及以上的比較。P<0.05為差異有統計學意義。
結 果
一、HepLPC細胞永生化建立
選取Passage 0~20的細胞,每間隔10代觀察細胞形態和細胞計數,增殖過程中細胞之間的形態保持一致,無任何改變,每間隔10代還具有相似的增殖速度,說明永生化細胞建立成功,見表2。在增殖過程中對細胞的反應合成,尿素生成,藥物代謝Alb,AAT,CPS1,CYP3A4等主要肝功能基因做檢測,每個代次之間表達量保持穩定。
尿素生成是反應器肝細胞解毒功能的主要指標,對每10代次的細胞進行尿素生成的檢驗。發現細胞每個代次之間的尿素生成保持穩定。白蛋白分泌是肝細胞特有的功能,不同代次之間白蛋白分泌穩定。說明Large T永生化保持細胞的合成與解毒功能也相對穩定。見表3。
二、采用分化培養基M7對iHepLPC進行分化
iHepLPC細胞建立好后進行分化,分化以后肝臟功能基因有了顯著上調。同時檢測了M7分化以后的iHepLPC細胞的尿素生成,Alb分泌水平,發現合成與解毒功能有了顯著的提高。見表4。
三、小豬急性肝衰竭血漿對細胞毒性實驗
分化后iHepLPC細胞的活率逐漸降低,6 h后細胞活率降到50%左右(圖1A),但是反映細胞解毒功能的尿素生成不斷增加(圖1B),同時Alb分泌水平隨著時間而不斷增加(圖1C),這說明分化后iHepLPC對于肝衰竭血漿不僅具有一定的耐受性還發揮解毒與合成功能。

表2 不同代次細胞的增殖能力比較(±s)

表3 不同代次間細胞功能基因和尿素生成、白蛋白比較(±s)

表4 分化前后功能基因、尿素,白蛋白比較(±s)
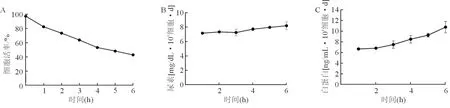
圖1急性肝衰竭血漿對分化后iHepLPC的影響 A:急性肝衰竭血漿對分化后iHepLPC活率的影響;B:急性肝衰竭血漿對分化后iHepLPC尿素合成;C:急性肝衰竭血漿對分化后iHepLPC白蛋白合成分泌變化
討 論
種子細胞是生物人工肝支持系統的靈魂,細胞功能的好壞直接關系到生物人工肝的治療效果。人肝母細胞瘤細胞系C3A雖然具有蛋白分泌功能,然而它們缺乏尿素循環的相關基因,表現出尿素生成和氨清除能力下降[3]。體外肝臟輔助裝置(ELAD)可測試C3A細胞的功能,然而,裝載有C3A細胞的ELAD系統的臨床療效有限,不能顯著延長患者的生存期[4]。將人原代肝細胞轉化為永生化前體樣細胞(iHepLPC)可使人原代肝細胞實現體外快速多代次的增殖。常見的人肝細胞永生化的方法有Large T antigen、hTERT、Cre-loxp等[5]。Large T antige抑制pp2A的磷酸酶活性,實現細胞的無限增殖。本研究采用Large T antige對HepLPC進行永生化,對不同代次的細胞進行檢測,發現細胞的增殖速度、形態、功能基因以及合成解毒功能保持一致。Large T antige建立的永生化細胞成熟且穩定,獲得尿素生成功能強的細胞,在后期的BAL應用中可以減輕患者肝性腦病的癥狀。
對于建系好的iHepLPC進行分化,發現細胞功能可以進一步提高,細胞分化是促進成熟,提高功能的又一有效辦法。分化后的細胞具有更加規則的細胞形態,同時解毒與合成功能有了顯著提高。值得提出的是,iHepLPC具有極強的尿素生成與氨清除能力,用于BAL可以顯著減輕肝性腦病的癥狀和體征。
細胞在生物人工肝內發揮需要驗證其對ALF血漿的耐受性以及在ALF血漿中的解毒與合成能力。結果顯示雖然ALF血漿對iHepLPC有一定的損傷,但是隨著時間的變化細胞在血漿中發揮一定的解毒與合成功能。
綜上所述,永生化后的iHepLPC不僅可以快速無限增殖還可以在ALF血漿中發揮解毒與合成功能,其可以成為新的生物人工肝種子細胞。
iHepLPC在ALF血漿體現一定的治療效果,對于慢加急性肝衰竭的治療效果還需要進一步驗證。慢加急性肝衰竭是比較常見的肝衰竭,擴大iHepLPCs的應用范圍,造福廣大肝衰竭患者[6, 7]。本實驗采用單一的細胞治療,可以與MSC以及HUVEC共培養提高細胞功能,驗證共培養對ALF血漿的效果[8]。
iHepLPC在小豬ALF血漿實驗上體現出良好的治療效果,然而機體是一個復雜的系統,接下來需要驗證其在急性肝衰竭ALF小豬的治療效果。通過動物實驗研究,驗證其對ALF具有一定的治療效果,為臨床試驗做準備。希望新的細胞源可以為廣大ALF患者帶來福音。