外周血單個核細胞干擾素刺激基因表達水平與慢性乙型肝炎HBV復制的關系
張曉飐 宋銳鋒 李芙蕾
慢性乙型肝炎病毒學發病機制主要是乙型肝炎病毒(HBV)感染,而HBV屬不完全環狀雙鏈DNA病毒范疇,細胞毒性并不明顯,可誘發急或慢性肝炎發生[1]。其中外周血單個核細胞干擾素刺激基因(Stimulator of interferon gene,STING)基于雙鏈DNA刺激下,其介導細胞產生白細胞介素6等細胞因子,誘導細胞發揮抗細菌及病毒作用,并且其自身可直接作為模式識別受體,引發IFN反應。近幾年,有報道發現STING蛋白水平高低與天然免疫反應強度有關[2]。基于此,本文主要圍繞外周血單個核細胞STING表達水平以及HBV復制兩者的相關性進行分析,為臨床HBV感染治療提供參考依據,報道如下。
資料與方法
一、 一般資料
納入2016年12月至2018年12月于我院收治的68例慢性乙型肝炎患者及同期54例健康體檢者,研究對象均知情,納入標準:(1)符合慢性乙型肝炎相關診斷標準[3],均經肝穿刺組織等檢查確診,乙肝表面抗原陽性≥6個月;乙型肝炎病毒脫氧核糖核酸≥2 000 IU/mL;血清總膽紅素≥171 μmol/L,國際標準化比率≥1.5(凝血酶原活動度≤40%);年齡>18歲;(2)正常對照組:年齡>18歲;身體健康,肝腎功能等基礎實驗室檢測指標均正常,精神行為正常;自身免疫性疾病診斷標志物呈陰性;乙肝表面抗原呈陰性。排除標準:(1)伴心、肺、腦等嚴重原發疾病;(2)合并肝癌等惡性腫瘤;(3)合并肝硬化及酒精性、藥物性、遺傳代謝性、自身免疫性肝病;(4)伴甲、丙、戊型等其他肝炎病毒感染;(5)入組前半年內接受抗病毒、肝移植等干預;(6)伴非嗜肝病毒感染引起的肝組織炎癥;(7)精神疾患;(8)孕婦及哺乳期婦女。觀察組68例患者中,男45例,女23例,年齡18~75(53.78±9.56)歲;正常對照組中男34例,女20例,年齡20~78(54.12±9.71)歲。兩組性別、年齡一般資料比較差異無統計學意義(P>0.05)。本試驗經倫理委員會批準。
二、方法
(一)主要儀器及試劑 主要儀器包括2720型聚合酶鏈反應PCR基因擴增儀(美國ABI公司)、ViiATM7型實時熒光定量聚合酶鏈反應(Real-time quantitative polymerase chain reaction,RT-PCR)儀(美國Life Technologies公司)、Q300高精度紫外分光光度計(美國Quawell公司)、Fluor Chem FC2凝膠成像系統(美國Alpha公司),其他儀器如臺式高速離心機、電子天平等均購自德國Eppendorf公司。主要試劑包括9mL二胺四乙酸抗凝真空采血管(美國Becton Dickinson公司)、Trizol試劑和逆轉錄試劑盒(美國Thermo公司)、SYBR Premix Ex TaqⅡ(日本TaKaRa Bio株式會社)、Thermo Scientific反轉錄試劑盒(美國Thermo公司)、HBV DNA病毒載量檢測試劑(凱杰生物工程有限公司)。
(二)引物設計 引物設計參考美國國立生物技術信息中心網站提供的STING mRNA序列(確保PCR擴增產物溶解曲線顯示單峰,預期設計長度與瓊脂糖凝膠電泳結果提示的目的基因片段長度一致,且目的條帶單一清晰,則示引物特異性較好),見表1。

表1 PCR引物設計
(三) mRNA提取、逆轉錄 收集空腹靜脈血2 mL,置入二胺四乙酸抗凝真空采血管中,參考淋巴細胞分離液說明書,行外周血單個核細胞分離。采用Trizol法提取單個核細胞總mRNA,行RNeasy Mini Kit純化。采用Q300高精度紫外分光光度計測定RNA濃度和A260/A280吸光度比值(確保在1.8~20.0之間)。逆轉錄時,取RNA模板1 μL,將oligo引物1 μL加入其中,混勻后離心,65℃ 5 min,于冰上加入逆轉錄反應體系(Mix 2 μL,Reaction Buffer 4 μL,RT、RI各1 μL)。反應條件:42℃ 60 min,72℃ 10 min,4℃保存。cDNA產物獲取后置-20℃條件下保存。
(四)STING mRNA、IFN-α mRNA、IFN-β mRNA檢測 RT-PCR反應體系:總體積為20 μL,上、下游引物均1 μL,cDNA 1 μL,SYBR Premix Ex TaqⅡ 10 μL,ddH2O 7.6 μL,ROXⅡ 0.4 μL。GAPDH、STING、IFN-α、IFN-β、內參基因擴增反應設置相同,如下:30s 94℃下預變性,后20s內在94℃下變性,60℃變性20 s,72℃延伸35 s,PCR循環50個。同時,于60~95℃時行溶解曲線分析。以相對表達量△Ct比較所有基因mRNA表達,△Ct=Ct目的-Ct內參。進行擴增效率驗證,GAPDH、STING、IFN-α、IFN-β基因10倍稀釋(梯度5個),目的基因和內參基因擴增效率相差<5%,處于98%~102%間,擴增效率類似。
三、觀察指標
統計兩組IFN-α mRNA、STING mRNA以及IFN-β mRNA 的相對表達量,分析不同乙型肝炎病毒DNA(HBV DNA)載量與STING及干擾素基因相對表達量的相關性。
四、 統計學方法

結 果
一、 兩組STING mRNA、IFN-α mRNA、IFN-β mRNA 相對表達量比較
觀察組STING mRNA、IFN-α mRNA、IFN-β mRNA 相對表達量顯著高于正常對照組(P<0.05),見表2。

表2 兩組STING mRNA、IFN-α mRNA、
二、HBV DNA載量與STING及干擾素基因相對表達量的關系
按HBV DNA不同載量分為≤104IU/mL組(19例)、104IU/mL~組(18例)、105IU/mL組(14例)、>106IU/mL組(17例)。HBV DNA載量>106組、105組、104組STING mRNA相對表達量均顯著高于HBV DNA載量≤104組(P<0.05),見表3。

表3 慢性乙型肝炎患者不同HBV DNA載量與STING及干擾素基因相對表達量的關系(±s)
注:與>106組比較,①P<0.05;與105~組比較,②P<0.05;與104~組比較,③P<0.05
三、慢性乙型肝炎患者STING mRNA與HBV DNA載量及干擾素基因相對表達量的相關性
經直線相關分析顯示,慢性乙型肝炎患者STING mRNA相對表達量與HBV DNA載量呈弱相關性(r=0.340,P=0.000),與IFN-α mRNA、IFN-β mRNA相對表達量均呈正相關(r=0.517、0.511,P=0.000、0.000),見圖1~3。

圖1 STING mRNA與HBV DNA載量線性相關圖

圖2 STING mRNA與IFN-α mRNA線性相關圖
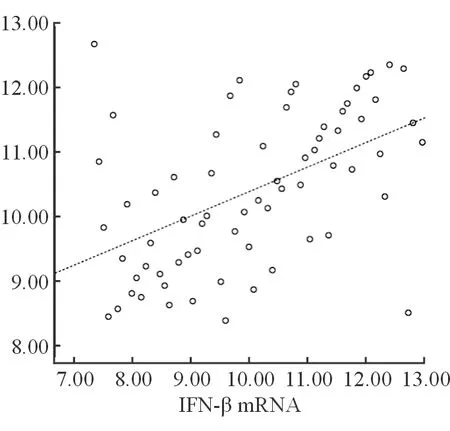
圖3 STING mRNA與IFN-β mRNA的線性相關圖
討 論
細胞質DNA屬重要免疫刺激物質,多源自病原微生物侵入人體后復制所致外源性DNA及機體組織、細胞受損后所致內源性DNA,可誘導機體天然免疫反應被激活,形成大量IFN及其他細胞因子。IFN主要包括兩種亞型,即IFN-α、IFN-β,前者主要源于白細胞(如樹突狀細胞)中,后者起源于成纖維細胞。STING屬DNA傳感器環鳥苷-腺苷酸合成酶和RNA傳感器人視黃酸誘導基因下游細胞信號級聯中銜接蛋白,其介導信號傳導通路可識別多種入侵病毒[4-6]。其中,HBV病毒基因組屬部分雙鏈環狀DNA,宿主體內可演變為超螺旋環狀、閉合、共價DNA分子,可作為模板轉錄出前基因組RNA及其他mRNA,被認為是隱形病毒。
本研究發現,觀察組STING mRNA、IFN-α mRNA、IFN-β mRNA 相對表達量明顯高于正常對照組,且慢性乙型肝炎患者體內HBV DNA載量越高,其STING mRNA相對表達量也明顯增多,這與Pépin G[7]等報道結論一致,證實體外或體內STING過度表達均可抑制HBV復制,且除固有免疫反應外,STING調節機體對HBV的適應性免疫反應。另外,本研究結果顯示,慢性乙型肝炎患者STING mRNA相對表達量與HBV DNA載量呈弱相關性,與IFN-α mRNA、IFN-β mRNA 相對表達量均呈正相關。Hua X[9]等也認為激活cGAS-STING通路,可抑制HBV復制。cGAS屬細胞質dsDNA感受器,與細胞質中DNA結合,催化作用下產生cGAMP;而cGAMP可誘導STING激活,導致下游IFN生成及抗病毒效應被激活。考慮到HBV復制期間可形成d3DNA、ssDNA,故筆者推測STING參與識別HBV復制中間體及HBV清除調節過程,其過度活化會破壞機體免疫耐受,誘發慢性乙型肝炎。
綜上,慢性乙型肝炎患者機體內STING相對表達量明顯升高,且STING過度表達干擾HBV復制,證實慢性乙型肝炎患者機體抗HBV免疫應答中STING起著重要作用,臨床應引起足夠重視。但本研究中由于樣本量偏小,STING抗HBV感染具體機制有待今后進一步深入研究。