球毛殼菌與枯草芽孢桿菌組合對抗黃瓜枯萎病防御酶活性的影響
魏滟潔 田葉韓 王炎峰 高克祥
摘要:黃瓜枯萎病是一種毀滅性的土傳真菌病害,其病原菌為尖孢鐮刀菌黃瓜專化型(Fusarium oxysporum f. sp. cucumerinum),在黃瓜整個生長周期均可發生。本試驗研究球毛殼菌(Chaetomium globosum)菌株ND35與枯草芽孢桿菌(Bacillus subtilis)菌株J2組合對黃瓜苗期枯萎病的防治效果,并對生防菌處理條件下黃瓜的根系活力、防御酶活性及防御酶相關基因表達進行初步研究。結果顯示,球毛殼菌 ND35處理對黃瓜枯萎病的防效為25.36%,枯草芽孢桿菌J2處理對黃瓜枯萎病的防效為54.27%,菌株ND35與菌株J2組合處理對黃瓜枯萎病防效達到70.02%。病原菌脅迫下,生防菌組合處理的黃瓜葉片CAT、SOD、POD、PAL和PPO活性明顯提高,峰值分別達91.60、3 239.15、165.80、201.03、256.38 U/gFW;與上述酶活力相關的酶活基因相對表達水平峰值分別為2.94、2.39、5.01、4.49和7.96,分別達到病原菌處理下酶活基因表達量的3.27倍、6.98倍、98%、5.27倍、 2.31倍。組合處理下黃瓜根系活力、平均防御酶活性和相關酶活基因表達水平總體高于單一生防菌處理。綜之,生防菌組合對黃瓜枯萎病的防治效果高于單一生防菌防治效果。該結果可為復合微生物防治黃瓜苗期枯萎病提供理論支持。
關鍵詞:黃瓜枯萎病菌;球毛殼菌;枯草芽孢桿菌;根系活力;防御酶
中圖分類號:S436.421.1+3文獻標識號:A文章編號:1001-4942(2019)07-0072-08
由于黃瓜連年種植以及病蟲害積累等一系列原因,黃瓜病害有日趨加重的趨勢[1]。尖孢鐮刀菌黃瓜專化型(Fusarium oxysporum f. sp. cucumerinum)是一種嚴重危害黃瓜生產的毀滅性土傳真菌,可導致黃瓜枯萎病,在世界范圍內嚴重影響黃瓜生產。黃瓜枯萎病一般導致黃瓜減產15%~25%,嚴重時達到50%以上甚至絕產[2]。
目前,防治黃瓜枯萎病的方法主要有化學防治、農業防治以及生物防治等[3]。化學防治上,蔣荷等[4]通過使用磷酸三鈉或甲醛處理黃瓜種子、段廣榮等[5]通過使用甲氧基丙烯酸酯類殺菌劑與多菌靈、甲基硫菌靈復配在防治黃瓜枯萎病上均取得良好防效;農業防治上,丁潮洪等[6]使用黑籽南瓜做黃瓜嫁接砧木防治黃瓜枯萎病。但是,使用化學藥劑處理種子可能會對種子造成永久性損傷,長期使用也會對環境造成污染;枯萎病病原菌的變異也會造成品種抗性下降;通過嫁接技術防治枯萎病會存在黃瓜品質下降、嫁接前病菌侵染發病等一系列不可控因素。而生物防治對環境友好、可改善土壤質量、對病原菌特異性強,因此是防治該病措施的重要補充。但是生物防治也有自身的局限,例如使用單一生防菌效果不穩定、抑菌譜較窄、易受環境影響等,所以對于生物防治措施的優化改良也亟待進行。
據研究,相比單一生防菌,合理的生防菌復配具有諸多優點,例如廣譜抑菌性、田間作用效果持久、促生效果更加明顯等[7,8]。劉蘇閩等[9]將毛殼屬真菌與多種生防菌復配用于防治草莓枯萎病取得良好效果,劉東岳等[10]將叢枝菌根真菌與根圍促生細菌組合用來提高黃瓜枯萎病抗病性。本試驗所用生防菌球毛殼菌(Chaetomium globosum)ND35是一株分離自健康毛白楊的內生優勢菌株,具有廣譜拮抗性,可產生多種抗生素[11],能夠從植物相鄰細胞間隙侵入或在表面形成附著胞,提高植物防御酶活性[12,13]。枯草芽孢桿菌(Bacillus subtilis)分離自山東農業大學南校區枯萎病試驗田,經驗證對黃瓜枯萎病具有良好的促生防病作用,并且枯草芽孢桿菌是土壤以及植物微生物生態中的優勢菌群,對多種果蔬作物病害具有防治作用,促生作用也十分顯著,具有防病效果穩定、對環境人畜無害等一系列優點[14]。本試驗將球毛殼菌ND35與枯草芽孢桿菌J2組合防治黃瓜枯萎病菌,探究組合生防菌對黃瓜枯萎病的協同防治機理,為組合生防菌的推廣應用提供參考。
1 材料與方法
1.1 試驗材料
供試黃瓜品種:津春4號。
生防菌與病原菌:枯草芽孢桿菌(Bacillus subtilis)J2、球毛殼菌(Chaetomium globosum)ND35、尖孢鐮刀菌黃瓜專化型(Fusarium oxysporum f. sp. cucumerinum),均由本實驗室分離,于PDA斜面4℃保存培養基: PDA、 PDB培養基以及LA、LB培養基。
1.2 試驗方法
1.2.1 盆栽條件下不同生防菌處理對黃瓜枯萎病的防病效果 本試驗共設置4組處理,分別為枯草芽孢桿菌與病原菌處理(J2+FOC),球毛殼菌與病原菌處理(ND35+FOC),枯草芽孢桿菌、球毛殼菌以及病原菌處理(J2+ND35+FOC),黃瓜枯萎病病原菌處理(FOC),以清水處理為對照(CK)。每個處理3次重復,每重復5盆植株。其他管理措施相同,14 d后統計發病率。
在高17 cm、下底寬14 cm的花盆中裝自然土200 g,移栽前3 d加入200 mL孢子濃度為1×107 cfu/mL黃瓜枯萎病病原菌懸浮液。枯草芽孢桿菌J2在28℃、160 r/min培養20 h后,離心重懸浮,向每株黃瓜根部澆灌OD260為1.0~1.1的菌懸液30 mL。球毛殼菌ND35的使用濃度為3×107 cfu/g,其使用方法為將該菌劑與育苗基質混勻,制成每克含有3×107 cfu球毛殼菌孢子的育苗基質,在黃瓜育苗階段應用。
黃瓜苗期枯萎病分級標準:0級,無癥狀;1級,真葉、子葉黃化面積或枯萎面積不超過總面積的50%;2級,真葉、子葉黃化面積或枯萎面積超過總面積的50%;3級,葉片枯萎或枯死,僅生長點存活;4級,植株枯死。
病情指數(%)=∑(各級病株數 × 該病級值)/ (調查總株數 × 最高級值)× 100;
防病效果(%)=(對照組病情指數-處理組病情指數)/對照組病情指數 × 100。
1.2.2 黃瓜根系活力測定 取 0.4% TTC 溶液 0.25 mL 放入 10 mL 試管中,加少許Na2S2O4(保險粉)搖勻后立即產生紅色的三苯甲腙(TTF),用含25、50、100、150、200 μg的TTF標準比色系列溶液繪制標準曲線,橫坐標為吸光值,縱坐標為TTF含量,標準曲線的r2=0.9991,線性關系良好。
稱取不同處理的黃瓜根尖0.3 g,放于50 mL錐形瓶中,加入0.4%的TTC溶液和磷酸緩沖液(1/15 mol/L,pH = 7)各5 mL,用保鮮膜封口后在37℃條件下暗處理1 h立即加入1 mol/L硫酸2 mL振蕩后靜置幾分鐘以終止反應(同時做空白對照,先加入硫酸,再加入根樣品,其他同上)。之后將根取出,吸干水分后放入研缽,加入4 mL乙酸乙酯進行研磨以提取甲腙。將研磨的液體轉移至10 mL容量瓶中,用乙酸乙酯定容,使用酶標儀在485 nm波長下測定吸光值。根據測定的吸光值求出所取樣品的根系活力,根系活力計算公式如下:
定義每一小時單位質量鮮根的四氮唑還原強度為1個根系活力單位。
單位質量鮮根四氮唑還原強度/根系活力[mg/(gFW·h)]=C/(W·t)。式中,C為根據標準曲線查出的四氮唑還原量(mg);W為根樣品重量;t為反應時間(h)。
1.2.3 黃瓜防御酶活性測定 待黃瓜長到2-3片真葉后進行移栽處理,選擇長勢一致的植株分別于1、3、5、7、9、11、13 d采集各處理黃瓜葉片3~5 g,分裝于錫箔紙中液氮速凍,并放入-80℃下保存,供酶活測定使用。
嚴格按照試劑盒說明書要求,提取黃瓜葉片組織粗酶液,使用酶活試劑盒(南京建成生物工程研究所)測定PPO、PAL、POD、SOD、CAT的活性。
1.2.4 黃瓜酶活基因表達量測定 采樣方法同1.2.3。總RNA的提取、純化以及RNA的反轉錄嚴格按照試劑盒說明書進行。反應體系:cDNA 9 μL、上下游引物各0.5 μL、2×TransStart Tip Green qPCR SuperMix 10 μL、ddH2O 6 μL。反應條件為:95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,共35個循環;72℃ 10 min。內參基因參照文獻[15],根據引物設計原則使用Primer 5軟件設計修飾。每樣品重復3次,計算平均循環閾值Ct和標準差。根據2-△△Ct法分析不同處理下黃瓜葉片不同防御酶基因的相對表達量。引物序列信息參照表1。
1.3 數據分析
采用Microsoft Excel 2007作圖,用SPSS 19.0統計軟件對數據進行顯著性分析。
2 結果與分析
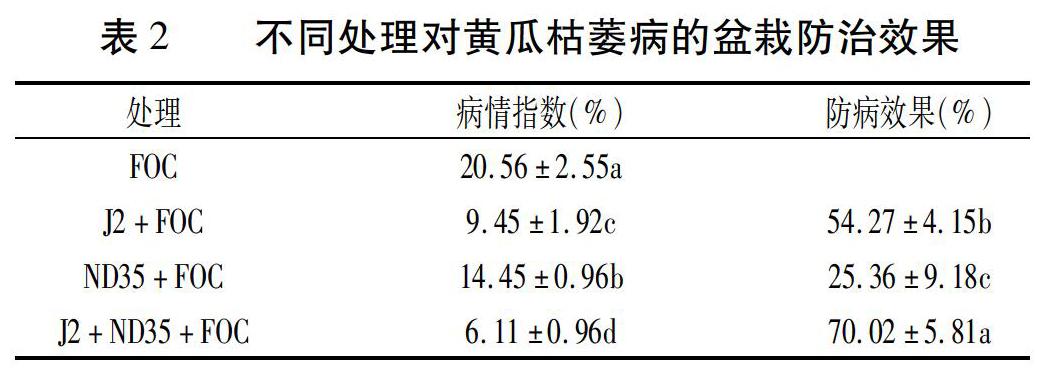
2.1 不同處理對黃瓜枯萎病的盆栽防治效果
由表1可知,J2+ND35+FOC處理的植株發病率遠低于FOC處理。J2+FOC處理和ND35+FOC處理防病效果分別為54.27%和25.36%,J2+ND35+FOC處理防病效果達70.02%。
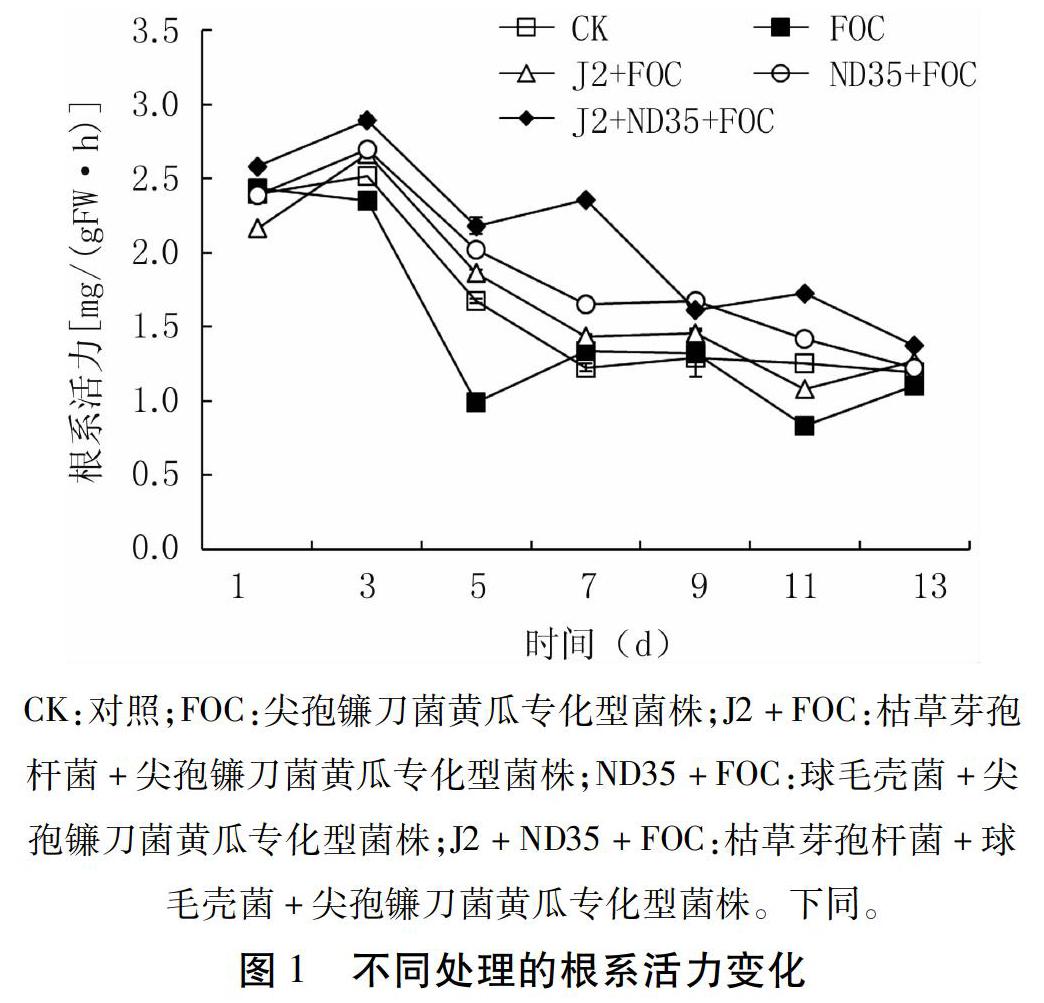
2.2 不同生防菌處理對黃瓜植株根系活力的影響
由圖1可知,黃瓜苗的根系活力在1~3 d略有上升,3~5 d迅速下降,隨后趨于平穩。其中J2+ND35+FOC處理3~7 d的根系活力明顯高于其它處理,第5 d與FOC處理差異最大,第7 d與J2+FOC、ND35+FOC處理差異最大。空白CK的平均根系活力高于FOC處理,但低于生防菌處理下的根系活力。由此可知,枯草芽孢桿菌J2與球毛殼菌ND35能夠減緩根系活力的下降,其根系活力高于對照,并且生防菌組合處理的根系活力明顯高于其它處理。
2.3 不同處理黃瓜防御酶活性變化
由圖2A看出,J2+ND35+FOC、ND35+FOC和J2+FOC處理的CAT均在第3、7、11 d出現活性峰,其中以第3 d的峰值最高,FOC處理在第3 d達到活性高峰后迅速降低,隨后一直保持在比較低的水平。相比FOC處理,J2+ND35+FOC處理在第3 d與其差異最大,CAT酶活性提高34.13%,相比J2+FOC和ND35+FOC處理,CAT酶活性提高16.55%和9.03%。CK處理酶活性一直保持在較低水平且無明顯變化。
由圖2B可知,不同處理的SOD活性水平具有明顯差別,且活性峰值出現的時間不同,其中J2+ND35+FOC處理在第5 d和第11 d出現活性峰,并且總體SOD活性高于J2+FOC、ND35+FOC處理以及FOC處理,處理第5 d時高于FOC處理 33.71%。CK的SOD活性變化不大,但總體高于FOC處理。
由圖2C可知, J2+FOC和J2+ND35+FOC處理的POD活性迅速上升,J2+FOC處理在第5 d達到峰值,J2+ND35+FOC處理在第13 d達到活性峰值,但是低于J2+FOC處理第5 d的活性。ND35+FOC處理在第3 d和第11 d形成活性峰,FOC處理在第3 d時POD活性迅速升高隨后回落到CK水平,CK的酶活變化不大。在所有處理中,J2+ND35+FOC的POD平均酶活力最高,第13 d時高于FOC處理12.43%。
由圖2D可知,各處理PAL活性在第3 d時形成第一個活性峰。J2+ND35+FOC處理在3~7 d保持較高的PAL活性水平,FOC處理在第5 d和第9 d形成活性峰,且平均酶活性水平略高于CK。J2+ND35+FOC與FOC處理第7 d酶活性差別最大,高于FOC處理10.46%。

