水通道蛋白-4與腦水腫的相關性研究進展
水通道蛋白(aquaporin,AQPs)是最近幾年研究較多的與水通透性相關的一類跨膜蛋白。至今在哺乳動物體內共發現13種水通道蛋白(AQP0-AQP12),其中AQP4是腦組織中分布最廣泛的一種水通道蛋白[1]。近年來研究表明AQP4在各種顱腦疾病(腦血管病、腦外傷、腦腫瘤、炎癥等)所致的腦水腫形成和消散中起著關鍵作用。正確認識AQP4和腦水腫的關系可為臨床病人治療腦水腫提供新思路。
1 AQP4的概述及分子結構
Peter Agre于1988年發現第一個AQP,并獲取了2003年諾貝爾獎[1]。迄今在哺乳動物體內至少已經發現13種AQPs蛋白亞型,有8種在腦組織中表達,AQP4最為豐富[2],與腦水腫的聯系也最密切。AQP4最早于1994年由Hasegawa等從大鼠肺組織中克隆出來[3],其蛋白單體由經過6次跨膜之后的多肽鏈構成,共形成3個胞外環(A、C、E)和2個胞內環(B、D),其游離N端和C端均位于胞內[4](見圖1A)。每個蛋白單體的B環和E環上均有一個高度同源的精氨酸-脯氨酸-丙氨酸序列(Asn-Pro-Ala,NPA序列),為AQPs家族的特征性結構,決定了水的通透性,研究發現B環和E環的改變可引起對水通透性的改變[3]。兩個NPA結構分別從胞膜的相對面折疊成一個能夠允許水分子通過的孔道,直徑約0.38 nm,且單線僅允許一個水分子通過,這種結構被稱為水通道蛋白“沙漏模型”三維結構[5](見圖1B)。AQP4的四級結構是由4個單體組成的四聚體,且每個單體都有各自獨立的水通道[6](見圖1C)。
AQP4根據翻譯起始位點的不同分為3種功能亞型:M1、M23和Mz。分別含有323、301和364個氨基酸殘基[7]。其中M23是腦組織中最常見的一種亞型, 且可在胞膜上排列成更高的結構-正交列陣結構(orthogonal arrays of particles,OAPs)[8],可以增強水分子通透性,促進AQP4在星形膠質細胞的極化,輔助AQP4定位于細胞膜,且該結構為AQP4特有的結構。目前關于OAPs與四聚體形式在功能上的區別尚未清楚,但可肯定的是OAPs可增強水分子通透性,加快AQP4通道對水的轉運[3]。
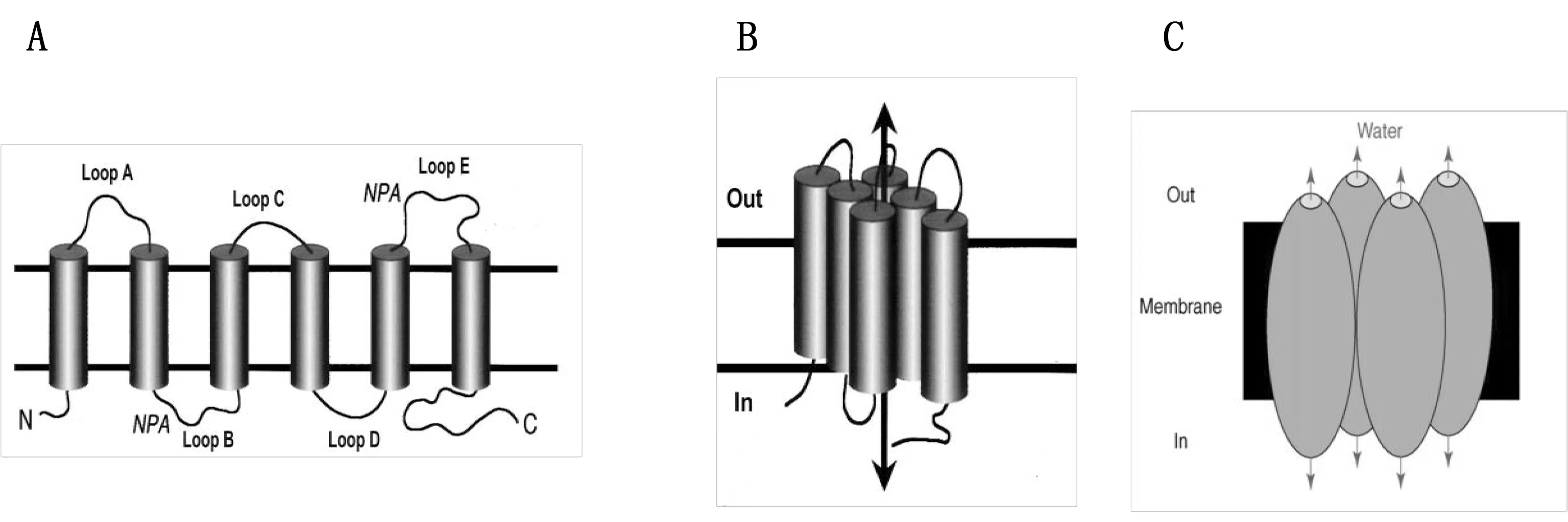
圖1 AQP4的結構
2 AQP4的分布及功能
AQP4主要分布于星形膠質細胞、室管膜上皮細胞、脈絡叢上皮細胞、血管內皮細胞等支持細胞中,尤其在與蛛網膜、軟腦膜、毛細血管等相鄰的星形膠質細胞足突上表達最豐富[9]。此外,Yool[10]研究發現,AQP4在小膠質細胞上表達上調,但在神經元、少突膠質細胞、腦膜成纖維細胞上均未見其表達,可以看出AQP4主要表達在腦實質與腦內液體成分相鄰的細胞膜上。AQP4的這種極性分布提示在腦內水平衡中發揮重要作用,可能是膠質細胞與腦脊液以及血液之間水分子轉運的重要結構單元[11]。如前所述,AQP4表達在腦室系統周圍的室管膜細胞和脈絡叢細胞,與腦脊液的分泌和重吸收的位置大致相同,說明腦脊液可能通過AQP4參與自身循環[12]。AQP4在下丘腦視上核和室旁核高度表達,該部位的大分泌細胞對細胞內容量變化非常敏感,當滲透壓變化1%時可引起抗利尿激素釋放,所以AQP4可能是滲透壓感受器或受體,通過自身對微小滲透壓的變化改變細胞容量,從而參與全身的水平衡[13]。此外,AQP4還表達在胼胝體、海馬、小腦、腦干等部位,主要調節胞外間隙大小和鉀離子濃度[11]。
3 AQP4的調控機制
AQP4在大腦中表達受到嚴格的調控,AQP4對水分子的通透性及在細胞膜上的數量是可以調控的,調控方式主要有長期調節和短期調節,長期調節是通過缺氧、滲透壓、氨、轉錄等長時間的調節機制,短期調節是通過一些受體介導的磷酸化和去磷酸化以及AQP4在胞內運輸實現的[14]。
3.1 短期調節
3.1.1 磷酸化調節 AQP4磷酸化調節是發生在翻譯之后的一種調節方式,當發生磷酸化時,磷酸化蛋白被轉運至細胞膜,進而進入細胞內,最終指導磷酸化蛋白在細胞內發生降解的一種方式[15]。研究表明,AQP4有多個磷酸化位點,其中最主要的為Ser180和Ser111兩個殘基位點[16]。
Ser180位點位于AQP4分子胞質內D環,其磷酸化可降低AQP4對水分子的通透性,該位點磷酸化是通過Ca2+濃度-磷脂依賴性蛋白激酶信號通路(PKC)實現的。Mccoy等[17]研究表明,PKC主要在轉錄水平對AQP4-mRNA進行調控,當AQP4的Ser180殘基發生變異時,AQP4卻不會被PKC磷酸化,此外用PKC活化劑二丁酸佛波醇酯可顯著減少AQP4的數量,而該作用可被PKC抑制劑RO-31-8220消除,Ser180發生點突變時同樣可以阻斷二丁酸佛波醇酯的作用。Zeuthen等[18]用PKC活化劑對星形膠質細胞分別做長時間和短時間孵育,發現AQP4分子表現出不同的內化現象,提示PKC除了作用AQP4的Ser180位點還作用于其他的位點(如Ser267和Thr273),共同導致AQP4水通透性降低。
Ser111位點位于AQP4分子胞質內B環,其磷酸化可增加水分子的通透性,與Ser180不同的是,該磷酸化是通過cAMP-蛋白激酶信號通路(PKA)和GAMP-蛋白激酶(PKG)途徑實現的。Gunnarson等[19]研究表明,鈣調蛋白并不是直接作用于Ser111位點,而是先作用于一氧化氮合酶產生NO和下游PKG的活化調節AQP4磷酸化。在腎臟和爪蟾某些細胞中發現Ser111位點的磷酸化是通過PKA途徑實現,并且增強AQP4水透過率[20]。所以,抑制Ser111位點可降低水通透性進而減輕相應部位水腫。
3.1.2 胞內運輸調節 Carmosino等[21]在研究胃腺癌細胞中發現,用組胺處理的細胞其OAPs結構減少,水通透性也降低, 猜測這可能與AQP4分子內吞有關,去除組胺后,AQP4又重新分布胞膜上,說明AQP4可在胞膜和胞內之間運輸,調控水分子通透性。
3.2 長期調節
3.2.1 氧化應激調節 大量研究表明氧化應激損傷機制上調AQP4表達[22],且途徑較復雜。氧化應激能迅速誘導早期基因C-Jun和C-Fos表達,后形成蛋白激酶-1(AP-1),AP-1激活MAPKS從而上調AQP4的表達;氧化應激也可作用于調控炎癥反應的轉錄因子(NF-κB)調節AQP4;Hsu等[23]研究表明通過P38絲裂原活化蛋白激酶信號通路(MAPKS)和胞外信號調節激酶信號(ERK)通路能夠激活半胱氨酸白三烯受體(CysLT2)上調AQP表達,所以氧化應激可以通過白三烯誘導AQP表達;氧化應激通過轉錄因子NF-E2相關因子(NRF2)激活AQP4基因啟動子中抗氧化反應元件(ARE)基因上調AQP4表達,Mao等[24]研究發現蘿卜硫素(NRF2的激活劑)可上調AQP4表達。
3.2.2 蛋白相互作用 研究發現肌營養不良蛋白聚糖復合物(dystrophin-associated complex,DGC)是AQP4呈極性表達在血管周圍星形膠質細胞足突上的重要蛋白,Dmytrenko等[25]研究α-互養蛋白(α-syntrophin,DGC的一種)時發現,α-syntrophin基因缺失的小鼠其極化現象發生改變;Mahmood等[26]研究低鈉血癥時發現與野生型小鼠相比α-syntrophin基因敲除后的小鼠其腦水含量顯著減少,提示AQP4定位和表達在細胞結構與某種蛋白關聯。
3.2.3 精氨酸加壓素(AVP) AVP主要由下丘腦視上核和室旁核分泌,主要作用為維持體內水鹽平衡。近年來研究發現,AVP可以促進腦水腫,Taya等[27]發現,在腦外傷中V1αR拮抗劑可以通過降低AQP4表達減輕腦水腫;張波等[28]在研究精氨酸加壓素1α受體(V1αR)與AQP4表達之間的關系時發現,在腦水腫不同時間段AQP4表達與V1αR之間呈正相關,提示V1αR 的調節可能導致AQP4表達升高。此外,重組人促紅細胞生成素、OAPs等都參與AQP4的表達調控,但具體調節機制仍需進一步實驗研究。
4 AQP4與腦水腫
腦水腫為液體過度聚集在腦實質內(腦組織細胞內或細胞間隙中),可認為當腦組織中的含水量超過其正常含量的80%時就是腦水腫。神經系統各種疾病所致的腦水腫主要為細胞毒性和血管源性腦水腫。許多實驗證實AQP4與腦水腫發生相關,在腦水腫形成和消散中起主導作用。
4.1 細胞毒性腦水腫 細胞毒性腦水腫多是由于細胞代謝功能紊亂,導致鈉鉀泵、鈣泵等功能失調,無法正常調節水和離子,導致細胞內水超載的一種病理性水腫,主要發生于腦缺血、缺氧、中毒等損傷因素,主要特點為星形膠質細胞發生腫脹而血腦屏障是完整的。Hirt等[29]在研究腦缺血小鼠時證實,與野生型小鼠相比,AQP4缺失的小鼠其細胞壞死程度、炎性反應及病灶大小均較輕;Huang等[30]在腦膜炎模型中也發現,實驗組腦水含量及AQP4表達明顯增加。可以看出AQP4加重細胞毒性腦水腫的發生。
4.2 血管源性腦水腫 血管源性腦水腫是指由于血腦屏障破壞,過多液體集聚在細胞外間隙,多見于腦外傷、腦腫瘤、腦凍傷等相關疾病。與細胞毒性腦水腫不同的是AQP4有利于血管源性腦水腫消除,尤其在室管膜、膠質界膜和血腦屏障等富含AQP4的部位。在血管源性水腫中,水分子進入腦組織不需要借助AQP4,相反,水腫的消除卻借助AQP4分子。Papadopoulos等[31]研究發現敲除AQP4基因后的小鼠腦組織水腫消散速度遠低于野生型,同時在黑色素腫瘤引起的水腫中,缺乏AQP4基因小鼠顱內壓與腦水含量都較重;在腦凍傷模型中,同樣發現AQP4可減輕水腫和顱內壓[32];Tourdias等[33]研究血管源性水腫時發現,AQP4在腦水腫消退期表達增加。可以看出AQP4減輕血管源性腦水腫,促進水腫的吸收,減輕疾病的發展。
4.3 腦水腫治療新靶點 目前治療腦水腫的藥物僅局限于對癥治療(激素、甘露醇、高滲液等),AQP4是近年來研究比較多的藥物作用靶點。細胞毒性腦水腫時AQP4表達增加并可加重腦水腫而血管源性腦水腫時水分子可通過AQP4通道排泄,其抑制劑和激動劑可減輕對應的腦水腫。研究發現亞低溫和去骨瓣治療都能通過抑制AQP4表達減輕腦水腫,所以AQP4作為靶點治療腦水腫是可行的。有實驗表明,2-尼克酰胺-1,3,4-噻二唑(TGN-020)、吡羅昔康和乙酰唑胺(AZA)可下調腦組織中AQP4的表達和分布,具備作為AQP4抑制劑的可能。Abed等[34]在腦缺血模型中發現,與模型組相比,TGN-020干預組腦水腫和梗死程度顯著降低;Viskupicova等[35]發現,吡羅昔康可通過減少AQP4表達減輕腦水腫達到神經保護作用。目前關于AQP4抑制劑和激動劑的研究甚少,其作用于臨床仍需更多的實驗證實。
5 結語與展望
近年來神經系統發病率越來越高,其病理改變-腦水腫,是導致病人致殘致死的主要原因。許多實驗已證實AQP4在腦水腫中發揮重要作用。細胞毒性腦水腫中,AQP4促進腦水腫發展,加重疾病,而血管源性腦水腫中,AQP4促進腦水腫消散,降低病人顱內高壓,延緩病情發展,所以探索AQP4抑制劑或激動劑以及使用的時機對治療腦水腫至關重要,并能挽救病人生命,但目前對于AQP4的各種研究僅局限于一些基礎性研究,與臨床相差甚遠,所以其臨床應用價值仍需進一步的實驗探索。

