miR-378對異體移植過程中骨髓間充質干細胞存活的影響①
葉 勖 陳明偉 高 宇 李夢潔 王 彤 邢珊珊 黃 暢 沈益民
(浙江醫院血液科,杭州 310030)
1 材料與方法
1.1材料
1.1.1試劑 DMEM/F12培養基購自美國Invitrogen公司;抗體CD29-PE、CD44-FITC、CD105-FITC、CD45-PE、CD34-FITC、IgG1-FITC和IgG2a-PE均購自美國Becton Dickinson公司;一抗anti-caspase-3和anti-GAPDH 購自美國Cell signaling technology公司;二抗HRP AffiniPure Goat Anti-Rabbit 購自武漢三鷹生物技術有限公司;Annexin-FITC/PI細胞凋亡檢測試劑盒購自上海碧云天生物技術有限公司;噻唑藍(MTT)、二甲亞砜(DMSO)購自美國Sigma公司;Europium標記試劑盒購自美國Abnova公司;Lipofectamine?RNAiMAX轉染試劑購自美國Thermo Fisher Scientific公司;miR-378 mimic、inhibitor及陰性對照由上海吉瑪制藥技術有限公司提供。
1.1.2實驗動物 SPF級健康雄性SD大鼠20只,鼠齡4~5周,體質量100~150 g,購自湖南斯萊克景達實驗動物有限公司,合格證號:SCXK (湘)2013-0004,同一條件下標準飼養。
1.2方法
1.2.1rBMSCs的分離與培養 采用10%水合氯醛(500 mg/kg)腹腔注射麻醉大鼠,無菌條件下暴露大鼠雙側股骨,使用20 ml注射器針頭在股骨兩端鉆直徑約1.5 mm的小孔,使用規格為5 ml的注射器吸取5 ml含10%FBS的DMEM/F12(1∶1)完全培養基,從股骨一端緩慢沖洗骨髓腔,另一端收集細胞懸液,縫合大鼠皮膚,術后肌肉注射慶大霉素抗菌。采用200目篩網對收集的細胞懸液進行過濾,1 500 r/min 離心5 min,吸取乳白色、云霧狀液體層,PBS重懸后再次離心,1 400 r/min離心4 min,棄上清,重復操作2次。采用DMEM/F12完全培養液重懸細胞,并接種到細胞培養瓶中,置于37℃、5% CO2的培養箱中培養,48 h后半量換液,隨后2~3 d換液1次,待細胞達到90 %的密度時進行傳代。
1.2.2rBMSCs的鑒定 取第3代生長狀態良好的rBMSCs,制成細胞懸液(1×105個/ml),分別加入異硫氰酸熒光素(FITC)或藻紅蛋白(PE)熒光標記的CD29-PE、CD44-FITC、CD105-FITC、CD45-PE、CD34-FITC和同型陰性對照IgG1-FITC和IgG2a-PE,避光冰上孵育45 min,PBS洗滌細胞3次,流式細胞儀檢測rBMSCs表面抗原CD29、CD44、CD105、CD45和CD34的表達情況。另取第3代生長狀態良好的rBMSCs,接種于6孔板中培養,待生長達到60%融合后,在各種誘導孔中加入成骨誘導培養基2 ml(內含誘導劑1 mmol/L地塞米松、1 mol/L β-甘油磷酸鈉和50 mmol/L抗壞血酸)。每隔3 d更換一次成骨誘導培養基,誘導21 d后,經4%多聚甲醛固定,對誘導分化的成骨細胞進行茜素紅和堿性磷酸酶染色觀察。
1.2.3細胞轉染及miR-378 檢測取第3代生長狀態良好的rBMSCs接種于6孔板,按照Lipofectamine?RNAiMAX轉染試劑說明書分別轉染miR-378 mimic、miR-378 inhibitor以及陰性對照(NC),終濃度為10 μmol/L。37℃培養4~6 h后更換完全培養基繼續培養,細胞轉染24 h后進行后續實驗。按照Trizol試劑盒說明書提取各轉染后細胞總RNA,按照逆轉錄試劑盒說明書進行逆轉錄反應(16℃,30 min;42℃,40 min;85℃,5 min)合成cDNA,并配置PCR反應體系進行PCR擴增,PCR反應條件:95℃,30 s;95℃ 5 s,60℃ 30 s,40個PCR循環。以U6作為內參,采用2-ΔΔCt法計算miR-378相對表達量。引物序列,miR-378-RT:5′-GTCGTAATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGAT-ACGACGCCTTCT-3′;miR-378-F:5′-GGGACTGGAC TTGGAGTCA-3′;miR-378-R:5′-GTGCGTGTCGTGG-ACTCG-3′。
1.2.4血清制備及分組處理 大鼠頸靜脈取血3 ml,加入0.2 ml抗凝劑EDTA·Na2混勻,靜置30 min,4℃,3 500 r/min,離心15 min,取上層血清,-20℃保存備用。按照后續實驗需要分組如下:①空白對照組(Control):rBMSCs不與大鼠異體血清(Allogeneic rat serum,ARS)共孵育;②異體血清組(ARS):rBMSCs與10%的ARS共孵育;③miR-378 inhibitor+ARS組(inhibitor+ARS):轉染miR-378 inhibitor后的rBMSCs與10%的ARS共孵育;④miR-378 mimic+ARS組(mimic+ARS):轉染miR-378 mimic后的rBMSCs與10%的ARS共孵育;⑤陰性對照+ARS組(NC+ARS):轉染miR-378 陰性對照后的rBMSCs與10%的ARS共孵育。
黨的十八大以來,習近平總書記鮮明提出了新時代好干部標準和忠誠干凈擔當、“三嚴三實”、“四有”、“四個鐵一般”等要求,特別是在2018年全國組織工作會上,他進一步指出,選干部就是要堅持好干部標準,把政治標準放在第一位。政治標準是硬杠杠,如果政治標準不合格,能耐再大也不能用。習近平總書記這些選人用人思想,歸結起來就是干部首先要在政治上達標,選人用人首先要看政治素質。
1.2.5MTT檢測 取對數生長期的各組細胞,以1×103個/孔接種于96孔板中,待生長達到90%融合后分組處理,37℃共孵育2 h。棄培養基,每孔加入20 μl MTT (5 mg/ml),避光孵育4 h,棄上清再加入100 μl DMSO,輕輕振蕩10 min,待紫色甲瓚顆粒完全溶解后,使用酶標儀在波長為570 nm處測量OD值,取均值計算細胞存活率。細胞存活率=(實驗組OD-空白組OD)/(對照組OD-空白組OD)×100%。
1.2.6流式細胞術檢測細胞凋亡 取對數生長期的各組細胞,以3×105個/孔接種于6孔板中,待生長達到90%融合后分組處理,37℃共孵育2 h。按照細胞凋亡檢測試劑盒說明書,0.25%胰酶消化收集細胞,制備細胞懸液,調整細胞濃度為1×105個/ml,經離心、洗滌后加入500 μl incubation buffer懸細胞,再分別加入5 μl Annexin-FITC和5 μl PI充分混勻,避光孵育15 min,上流式細胞儀進行檢測。
1.2.7Western blot檢測caspase-3蛋白的表達 取各組細胞種植于培養皿中,待生長達到90%融合后分組處理,37℃共孵育2 h。收集細胞沉淀,加入適量RIPA全蛋白裂解液,冰上充分裂解30 min后,4℃,12 000 r/min離心20 min,收集上清,采用Bradford法進行蛋白定量。取25 μg蛋白進行SDS-聚丙烯酰胺凝膠電泳,將蛋白轉移至PVDF膜上后,使用5%脫脂牛奶室溫孵育1 h,根據蛋白marker顯示的位置進行裁膜,分別加入一抗 anti-caspase-3(1∶1 000)和anti-GAPDH(1∶1 000),4℃孵育過夜。TBS洗滌3次,加入二抗HRP AffiniPure Goat Anti-Rabbit IgG(1∶10 000)室溫孵育1 h,TBS洗滌3次,ECL發光顯色,采用全自動數碼凝膠圖像分析系統自動顯影與數據分析。
1.2.8BMSCs活體移植的殺傷檢測 取生長狀態良好的rBMSCs以及轉染miR-378 inhibitor、mimic和 NC后的rBMSCs進行培養,0.25%胰酶消化,4℃,1 500 r/min 離心5 min,制備成3×106個/ml的細胞懸液,分別加入10 μmol/L的Europium,37℃共孵育30 min。被Europium標記的各組細胞,取0.5 ml 細胞懸液(5×105個)通過尾靜脈移植到異體大鼠體內,每組3只大鼠。分別于注射后20、40、60和80 min眼眶靜脈取血,分離血清。按照1∶50比例使用PBS稀釋血清,熒光分光光度計在激發波長650 nm和發射波長660 nm處檢測rBMSCs破損后泄露到大鼠體內的Europium濃度,以泄露到血清中Europium濃度的高低間接評估rBMSCs異體移植到活體內的存活率。計算活體移植細胞殺傷率,其計算公式如下:殺傷率=(A-B)/(C-B)×100%,其中A為釋放的平均量,B為最低釋放量,C為最大釋放量。
2 結果
2.1rBMSCs的鑒定 由圖1可見,第3代rBMSCs細胞表面CD29、CD44和CD105呈陽性表達,陽性表達率依次為(83.4±4.3)%、(93.1±3.9)%和(75.9±2.3)%;而CD45和CD34呈陰性表達,表達率僅為(3.0±0.9)%和(4.6±1.1)%。rBMSCs體外成骨誘導21 d后,茜素紅染色結果顯示rBMSCs礦化能力顯著增強,存在大量紅色陽性克隆的鈣化結節;堿性磷酸酶染色結果顯示rBMSCs出現較多藍黑色顆粒和塊狀深染顆粒,部分細胞膜呈現黑色線狀,如圖2所示。
2.2rBMSCs中miR-378表達 如圖3所示,miR-378 mimic及inhibitor轉染rBMSCs后,與Control組比較,miR-378 mimic可顯著提高rBMSCs中miR-378的表達(P<0.05)。同時,與Control組比較,miR-378 inhibitor也可顯著抑制rBMSCs中miR-378的表達(P<0.05)。NC組rBMSCs中miR-378與Control組比較差異無統計學意義(P>0.05)。
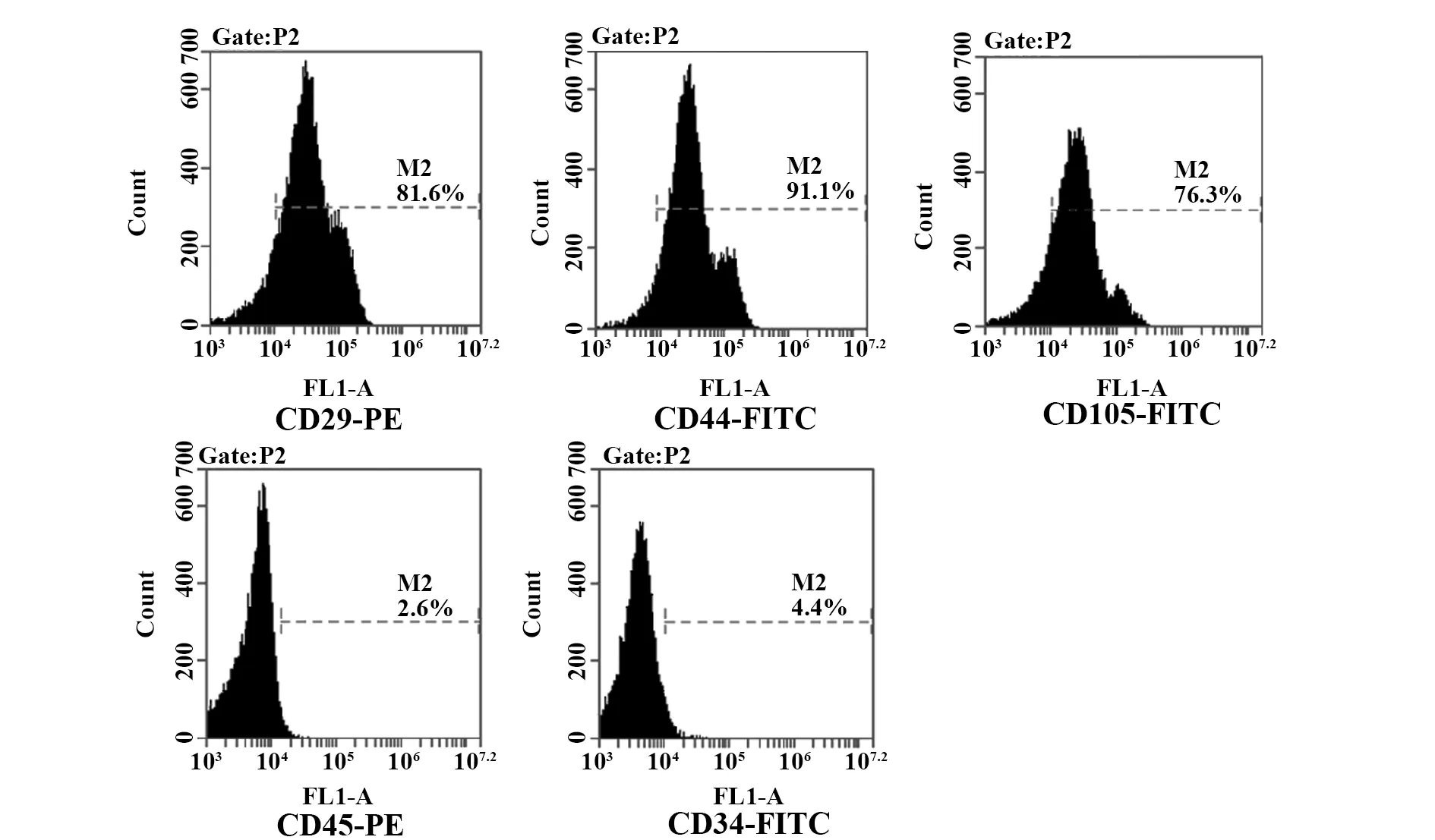
圖1 流式細胞術檢測rBMSCs細胞表面標志物的表達Fig.1 Detected expression of surface markers of rBMSCs by flow cytometry
2.3miR-378對異體血清干預下rBMSCs存活率的影響 如圖4所示,與Control組比較,ARS組細胞存活率顯著降低(P<0.05)。與ARS組比較,inhibi-tor+ARS組存活率顯著降低(P<0.05)。另外,mim-ic+ARS組細胞存活率顯著高于ARS組(P<0.05)。NC+ARS組細胞存活率與ARS組比較差異無統計學意義(P>0.05)。
2.4miR-378對異體血清干預下rBMSCs凋亡的影響 如圖5所示,與Control組凋亡率(10.1±1.4)%比較,ARS組凋亡率(30.7±3.3)%顯著增高(P<0.05)。與ARS組比較,inhibitor+ARS組凋亡率(39.1±4.7)%顯著升高(P<0.05);另外mimic+ARS組凋亡率(18.7±1.9)%與ARS組比較則顯著降低(P<0.05)。Western blot結果顯示,與Control組比較,ARS組Caspase-3蛋白切割激活顯著增高(P<0.05);與ARS組比較,mimic+ARS組Caspase-3蛋白切割激活則又顯著下調。另外,inhibitor+ARS組Caspase-3切割蛋白表達相較于ARS組則又顯著上調(P<0.05),如圖6。
2.5miR-378對活體移植中rBMSCs存活的影響

圖2 rBMSCs成骨分化誘導21 d后染色觀察(×200)Fig.2 Osteoblasts induction of rBMSCs at 21 d (×200)Note: A.Alizarin red staining;B.Alkaline phosphatase staining.

圖3 RT-PCR檢測轉染后rBMSCs中miR-378的表達Fig.3 Detected expression of miR-378 in transfected rBMSCs by RT-PCRNote:
如圖7所示,各組rBMSCs活體移植后,隨著時間的延長,各組rBMSCs在大鼠體內損傷情況呈上升趨勢。在活體內miR-378 mimic轉染的rBMSCs所受到的殺傷率在各時間點都要低于Control組,且在活體移植后的80 min時顯著低于Control組(P<0.05)。miR-378 inhibitor轉染的rBMSCs所受到的殺傷率在各時間點都要高于Control組,且在移植后60 min時,其所受殺傷率顯著高于Control組(P<0.05)。而NC組與Control組比較差異無統計學意義(P>0.05)。
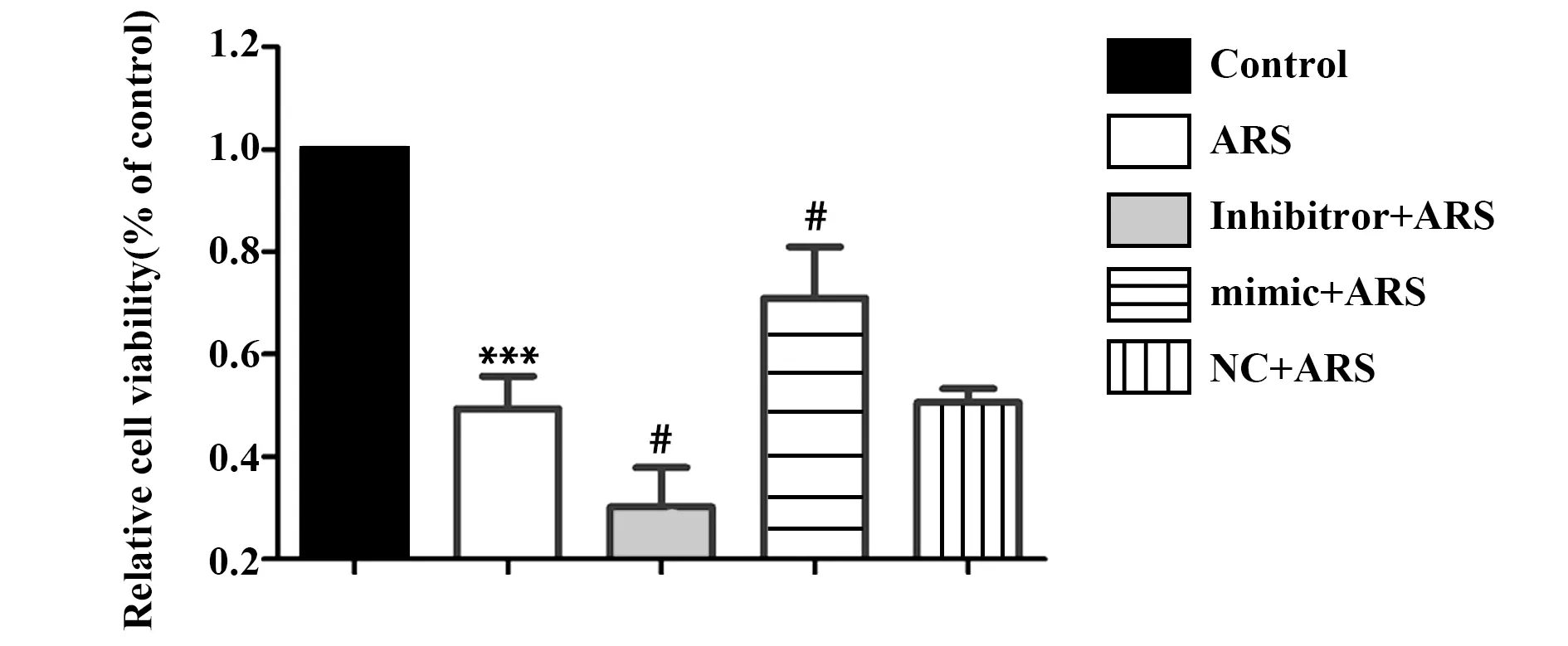
圖4 異體血清對各組rBMSCs存活率的影響Fig.4 Effect of allogeneic serum on survival rate of rBMSCsNote: vs control group;#.P<0.05 vs ARS group.

圖5 流式細胞術檢測異體血清對rBMSCs凋亡的影響Fig.5 Detected effect of allogeneic serum on apoptosis of rBMSCs by flow cytometryNote: vs control group;#.P<0.05 vs ARS group.

圖6 Western blot檢測異體血清對rBMSCs中凋亡蛋白Caspase-3表達的影響Fig.6 Evaluated effect of allogeneic serum on protein expression of Caspase-3 of rBMSCs by Western blotNote: vs control group;#.P<0.05,##.P<0.01 vs ARS group.

圖7 rBMSCs異體活體移植后受機體殺傷情況Fig.7 Survival condition of rBMSCs in vivo after xenoge-nous transplantationNote:
3 討論
BMSCs是細胞治療中運用最為廣泛的一類干細胞,具有易取材、易擴增、低免疫源性等優點,在再生醫學領域具有廣闊的應用前景,有望成為骨缺損修復、心肌梗死、自身免疫性疾病、慢性頑固性心絞痛等疾病的首選方法[10]。但是BMSCs移植治療的效果并不理想,有證據表明BMSCs移植后在機體內存活率較低是限制其治療效果的重要因素。例如,Amsalem等[11]采用氧化鐵標記的MRI技術監測移植BMSCs的存活情況,發現心機梗死區移植后24 h存活的BMSCs明顯減少,下降近50%,一個月后基本檢測不到BMSCs的存活。王月秋等[12]采用綠色熒光蛋白標記BMSCs移植注射至兔椎間盤,發現移植后6、8周髓核內的熒光細胞數量明顯少于移植后1、2、4周,也證實BMSCs移植后在機體內存活率隨時間的延長而逐漸降低。因此,如何提高BMSCs移植后存活率成為干細胞臨床轉化面臨的首要問題。
miRNAs是一類生物進化過程中高度保守的內源表達的小分子非編碼RNA,廣泛參與多種生理病理過程,其中miR-378在調控細胞增殖、凋亡、腫瘤侵襲與轉移等方面具有重要的作用。Li等[13]研究顯示,過表達miR-378可促進非小細胞肺癌的增殖。Fang等[14]研究發現,過表達miR-378可增強大鼠心肌細胞對缺血缺氧環境的難受性,而若抑制miR-378則可加重心肌細胞損傷和凋亡。因此,miR-378可能對細胞存活具有促進作用。然而,目前有關miR-378對干細胞的調控影響的研究報道甚少。本研究通過過表達或抑制miR-378表達的方式改造BMSCs,發現miR-378過表達可提高BMSCs異體移植的存活率,本研究結果可能為克服BMSCs移植存活率低的問題提供了新的解決途徑。
本研究采用密度梯度離心法分離大鼠BMSCs,通過流式細胞術檢測rBMSCs表面標志物及細胞成骨誘導實驗證實本實驗中所分離的細胞為BMSCs。隨后采用miR-378 mimic及inhibitor轉染rBMSCs,RT-PCR實驗證實miR-378 mimic轉染后可顯著提高rBMSCs中miR-378的表達,miR-378 inhibitor轉染則可顯著抑制rBMSCs中miR-378的表達,說明成功干預rBMSCs中miR-378的表達。免疫系統的排斥作用是導致異體移植療效不理想的直接原因,正常人與動物血清中含有一組經活化后具有酶活性的蛋白質可以攻擊外源移植干細胞產生防御作用,直接導致移植干細胞損傷或死亡[15],因此本研究采用大鼠血清與rBMSCs共培養體外模擬異體移植過程。MTT實驗結果顯示,rBMSCs與異體大鼠血清共培養2 h后,rBMSCs存活率顯著下降;流式細胞術檢測細胞凋亡結果顯示,與異體大鼠血清共培養的rBMSCs凋亡率顯著高于Control組,且Western blot結果也顯示與異體大鼠血清共培養的rBMSCs中Caspase-3切割激活顯著高于Control組。說明,異體大鼠血清對rBMSCs的殺傷作用較大。鄭盛等[16]也證實正常人血清對rBMSCs具有較高的殺傷作用。
隨后通過過表達或抑制rBMSCs中miR-378,觀察其對異體大鼠血清孵育條件下rBMSCs存活的影響。MTT結果顯示,與異體大鼠血清共培養的rBMSCs相比較,過表達miR-378可提高同條件下rBMSCs的存活率,抑制miR-378表達則可繼續降低rBMSCs的存活率。說明,miR-378對異體大鼠血清共孵育條件下rBMSCs的存活具有促進作用。流式細胞術檢測細胞凋亡結果顯示,過表達miR-378可抑制異體大鼠血清共孵育條件下rBMSCs的凋亡,抑制miR-378則促進rBMSCs的凋亡。Western blot結果顯示,異體大鼠血清共孵育條件下,過表達miR-378可抑制rBMSCs中Caspase-3的切割激活,抑制miR-378則促進rBMSCs中Caspase-3的切割激活。說明,miR-378可抑制異體大鼠血清共孵育條件下rBMSCs的凋亡。郭天柱等[17]研究也顯示,過表達miR-378可顯著促進缺氧條件下rBMSCs的生長增殖,并抑制細胞凋亡。另外,為了進一步驗證,我們采用Europium標記rBMSCs進行活體移植。結果顯示,轉染miR-378 mimic的rBMSCs在大鼠體內各時間段存活率均顯著高于Contorl組和轉染miR-378 inhibitor組。體內體外實驗說明,miR-378可以促進異體移植過程中BMSCs的存活。針對miR-378提高異體移植過程中BMSCs存活率的具體機制,可能與體液免疫中補體系統活化有關。有研究表明,在異體移植過程中補體系統被激活后,形成攻膜復合物,可裂解外源細胞,導致移植干細胞的存活率較低[18]。因此,miR-378是否是通過靶向抑制補體活化而發揮作用將成為我們下一步研究重點。
綜上所述,異體移植過程中因機體免疫反應可導致BMSCs存活率較低,而過表達miR-378則可提高異體移植過程中BMSCs的存活率,并抑制BMSCs凋亡,本研究結果可為解決BMSCs移植存活率低的問題提供新的思路。

