水貂犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)安全性評價
馮二凱,易立,羅國良,王振軍,郭利,陳立志,程世鵬,程悅寧*
(1.中國農業科學院特產研究所,長春 130112; 2.吉林特研生物技術有限責任公司,長春 130122)
犬瘟熱(canine distemper,CD)是犬瘟熱病毒(Canine distemper virus,CDV)感染引起的、可導致多種食肉動物患病的一種急性、接觸性傳染病[1],可感染所有的犬科、鼬科以及水生哺乳動物,且感染宿主范圍正在不斷擴大[2-3]。不同動物對CDV的易感性和致死率各不相同,從30%~80%不等,對我國的養犬業,毛皮動物養殖業和野生珍稀動物保護造成了很大危害。
犬瘟熱臨床防治沒有治療藥物,只能通過疫苗接種免疫預防。中國農業科學院特產研究所先后研究了我國第一代和第二代水貂犬瘟熱活疫苗,疫苗的成功研制為有效控制我國毛皮動物犬瘟熱疫情的發生和流行奠定了基礎。為了適應毛皮動物飼養業對高品質生物制品的需求,提升企業產品的市場競爭力,中國農業科學院特產研究所又開展了水貂犬瘟Vero細胞活疫苗(CDV3-CL株,懸浮培養)的懸浮培養工藝的開發工作。
本研究在前期建立犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)懸浮培養生產工藝的基礎上[4-6],利用建立的疫苗懸浮制備工藝生產3批疫苗半成品,實驗室根據《新獸藥研制管理辦法》、《獸用生物制品注冊分類及注冊資料要求》的有關規定,制備了三批水貂犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養),在疫苗檢驗合格的基礎上對疫苗的安全性進行了系統評價。
1 材料與方法
1.1 材料
1.1.1 種毒與細胞 非洲綠猴腎細胞(Vero),由中國農業科學院特產研究所保存;犬瘟熱CDV3-CL毒株第15代(基礎毒種),由中國農業科學院特產研究所鑒定和保存。
1.1.2 試驗用疫苗 安全性試驗用3批犬瘟熱Vero活疫苗(CDV3-CL株,懸浮培養)凍干品(批號:201701、201702、201703),由吉林特研生物技術有限責任公司生產,規格為15頭份/瓶,2017年1月份制備,疫苗在-20 ℃以下條件下保存。
1.1.3 微載體混懸液(5 g/L) 取已硅化藍蓋瓶,稱5 g微載體,按照100 mL/g微載體的比例加入無Ca2+、Mg2+的PBS,于4 ℃浸泡過夜;次日棄PBS和漂浮微載體,按200 mL/g微載體的比例加入無Ca2+、Mg2+的PBS,120 ℃高壓滅菌30 min,冷卻至室溫備用。
1.1.4 細胞維持液 含有2%小牛血清的DMEM培養基,用于接毒后病毒增殖。
1.1.5 試驗動物 品系:美國短毛黑;2~4月齡和8~10月齡水貂以及妊娠30~35 d水貂(中和抗體SN≤1∶4),由吉林中特農業科技有限公司異獸路分公司提供。安全試驗動物選擇健康,未接種任何疫苗的水貂。
1.2 方法
1.2.1 疫苗檢驗 參照農業部第2215號公告[7]要求,對3批疫苗進行質量檢驗,質量檢驗由吉林特研生物技術有限責任公司質量管理部完成。
1.2.2 試驗動物 本試驗對2~4月齡水貂幼崽、8~10月齡育成水貂和妊娠30~35 d水貂進行安全性測試。試驗動物管理按正常條件進行飼養管理;水貂均為單籠飼養,分組試驗。
1.2.3 疫苗安全性評價指標 包括全身性和局部安全檢查。全身性檢查包括體溫監測、精神狀態、食欲變化、幼獸生長性能、妊娠水貂是否流產等;局部檢查包括注射部位有無炎癥或破潰、局部吸收情況等。
1.2.4 單劑量皮下接種安全性試驗 3批疫苗分別接種2~4月齡和8~10月齡水貂,10只/組,后肢內側皮下接種,1頭份/只,接種后連續觀察14 d,觀察全身和接種局部變化;接種后10 d內每日記錄體溫變化。第15 d剖殺水貂,檢查接種部位有無病理變化。
1.2.5 單劑量重復皮下接種安全性試驗 3批疫苗分別接種2~4月齡水貂進行單劑量重復接種試驗,10只/組,后肢內側皮下接種,1頭份/只,兩次接種時間間隔14 d,二次接種后繼續觀察全身和接種局部變化;重復接種后10 d內,每日記錄體溫變化。
1.2.6 超劑量皮下接種安全性試驗 3批疫苗分別接種2~4月齡水貂進行試驗;10只/組,后肢內側皮下接種,10頭份/只,分四點注射,接種后連續觀察14 d,觀察全身和接種局部變化,接種后10 d內,每日記錄體溫變化。第15天剖殺水貂,檢查接種部位有無病理變化。
1.2.7 微載體安全性試驗 將制備的微載體混懸液(5 g/L)接種水貂幼崽和育成水貂,考察微載體對水貂的安全性,5只/組,后肢內側皮下接種,1.0mL/只,分兩點注射,接種后連續觀察14d,觀察全身和接種局部變化,并在接種后10 d內,每日記錄體溫變化。第15天剖殺水貂,檢查接種部位有無病理變化。
1.2.8 妊娠水貂安全性試驗 3批疫苗分別接種妊娠30~35 d水貂進行安全性試驗。每組試驗接種水貂10只,后肢內側皮下接種,1頭份(毫升)/只,接種后觀察至產仔后1個月,記錄妊娠水貂是否出現流產。
1.2.9 對照組 每個實驗組設置對照組,水貂注射細胞維持液,5只/組,注射劑量、方式與上述試驗同步進行。
1.2.10 組織病理切片分析 在每組試驗的末期(第15天),剖殺2只水貂,觀察接種部位有無炎癥或破潰;取接種部位肌肉,甲醛固定后,經HE染色后,觀察各實驗組動物接種部位組織病理變化。
2 結果與分析
2.1 犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)質量檢驗結果 三批犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)無菌檢驗、外源病毒檢驗均為陰性,表明3批疫苗質量均符合標準,可以用于臨床安全性評價試驗;疫苗凍干后每頭份病毒含量為103.80~104.00TCID50/0.1 mL(表1)。

表1 三批犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)檢驗結果Tab 1 The inspection result of three batch of CDV vaccine(CDV3-CL strain,suspension)
“-”表示檢測結果陰性
2.2 一次單劑量皮下接種安全性試驗結果 3批疫苗接種水貂幼崽(2~4月齡)及育成水貂(8~10月齡),通過14 d觀察,接種10 d內各組水貂平均體溫變化正常(未連續2 d超過40.5 ℃)(圖1和圖2);水貂食欲、糞便及精神狀態均正常,接種局部無腫脹和炎癥,未出現局部和全身炎癥反應(表2和表3)。
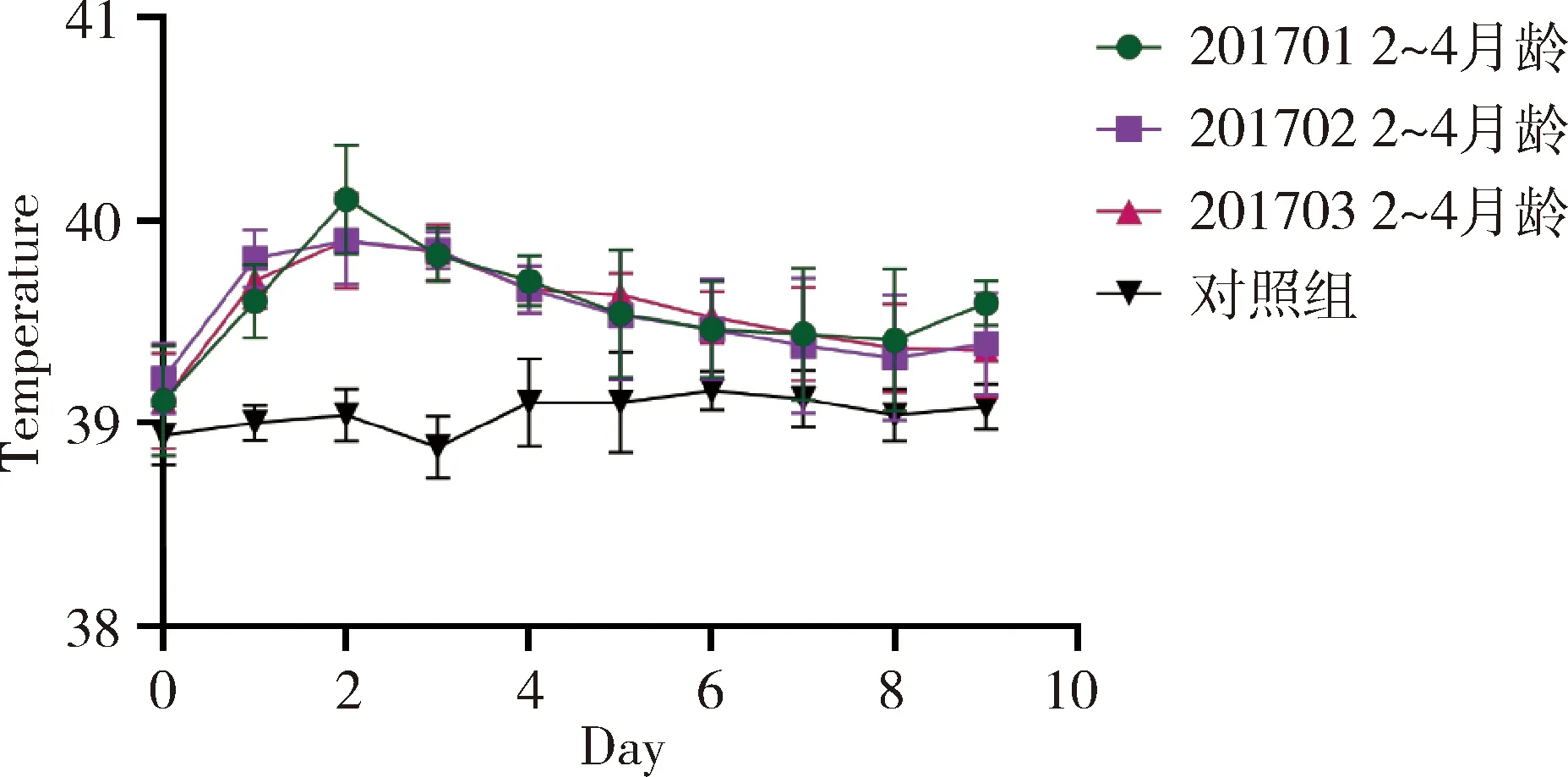
圖1 疫苗對水貂一次單劑量接種后體溫變化圖(2~4月齡)Fig 1 The fluctuate curve of body temperature ofmink received one dose vaccine(2~4 month)
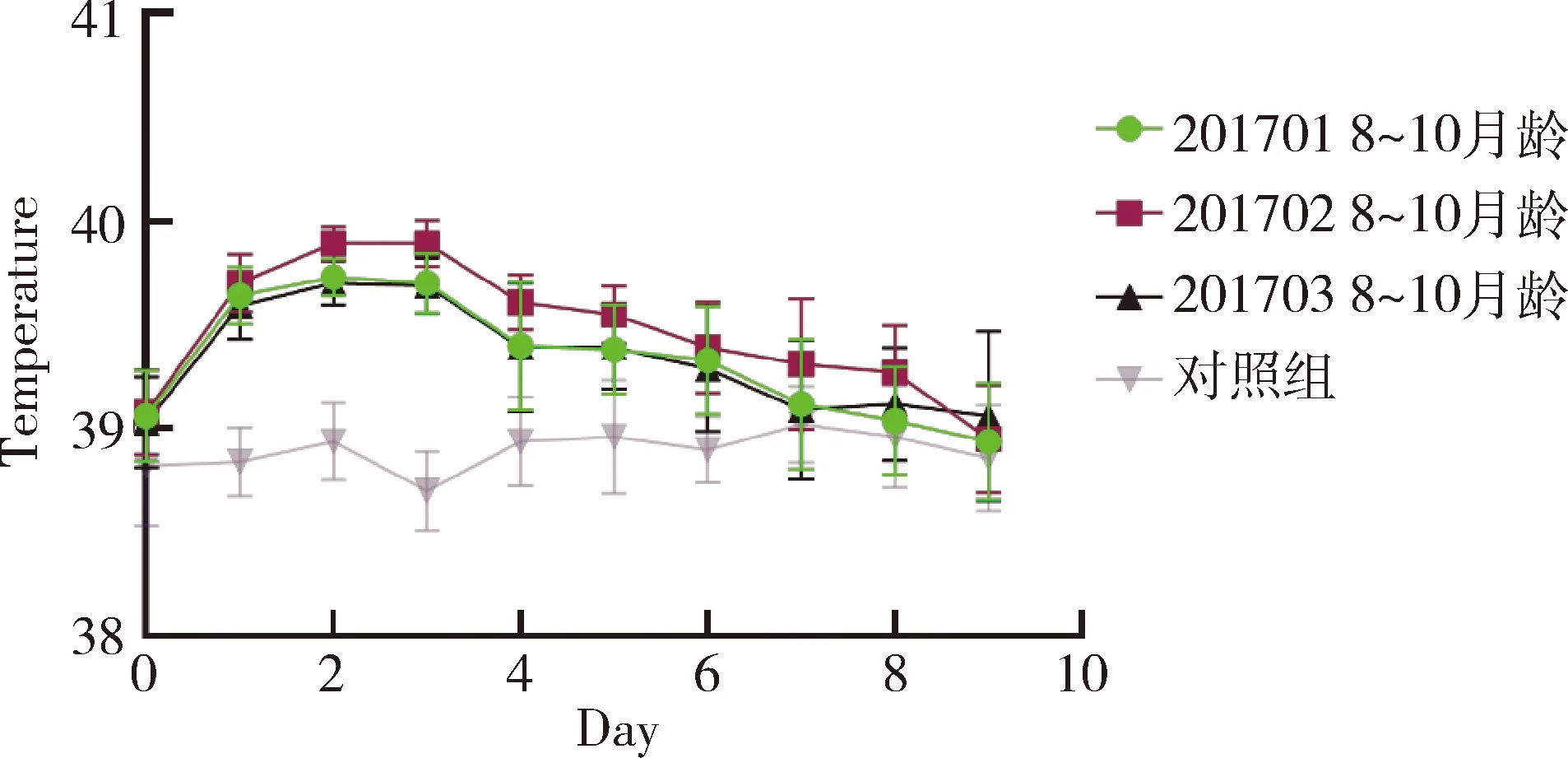
圖2 疫苗對水貂一次單劑量接種后體溫變化圖(8~10月齡)Fig 2 The fluctuate curve of body temperature ofmink received one dose vaccine(8~10 month)
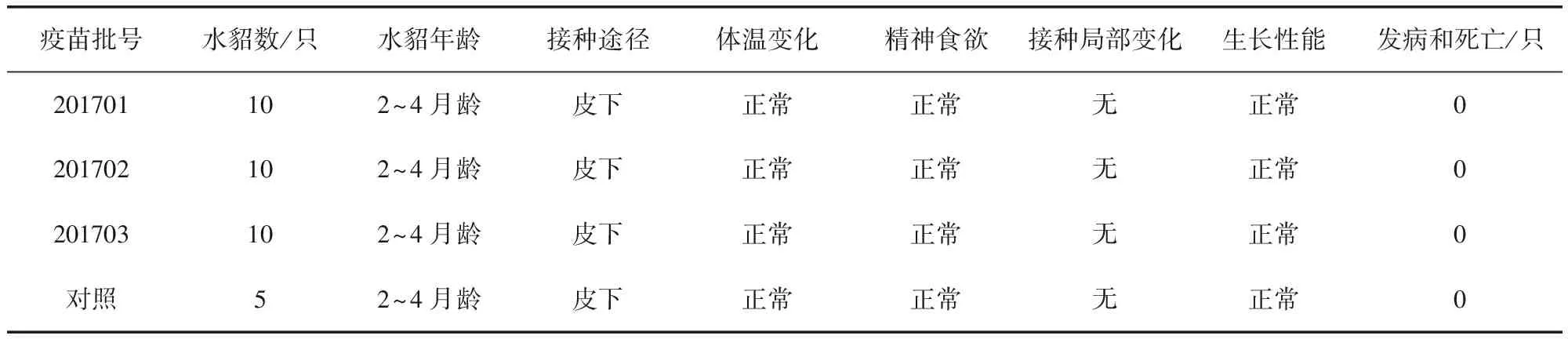
表2 疫苗對水貂一次單劑量接種安全性試驗統計結果(2~4月齡)

表3 疫苗對水貂一次單劑量接種安全性試驗統計結果(8~10月齡)Tab 3 The security test record of one dose vaccine inoculation (8~10 month)
“-”代表水貂被打皮,未統計
2.3 單劑量重復皮下接種安全性試驗結果 3批疫苗接種2~4月齡水貂幼崽,間隔14 d重復接種1次,通過14 d觀察,接種水貂10 d內平均體溫未超過40.5 ℃(圖3);水貂食欲、糞便和精神狀態均正常,接種局部無腫脹和炎癥,未出現局部和全身反應(表4)。
2.4 超劑量皮下接種安全性試驗結果 3批疫苗超劑量接種2~4月齡水貂幼崽,通過14 d觀察,實驗組水貂10 d內平均體溫未超過40.5℃;3批疫苗接種后2~3 d內,水貂會出現體溫短暫升高到40.5 ℃以上情況(圖4);水貂糞便和精神正常,疫苗接種局部無腫脹和炎癥,未出現局部和全身反應(表5)。
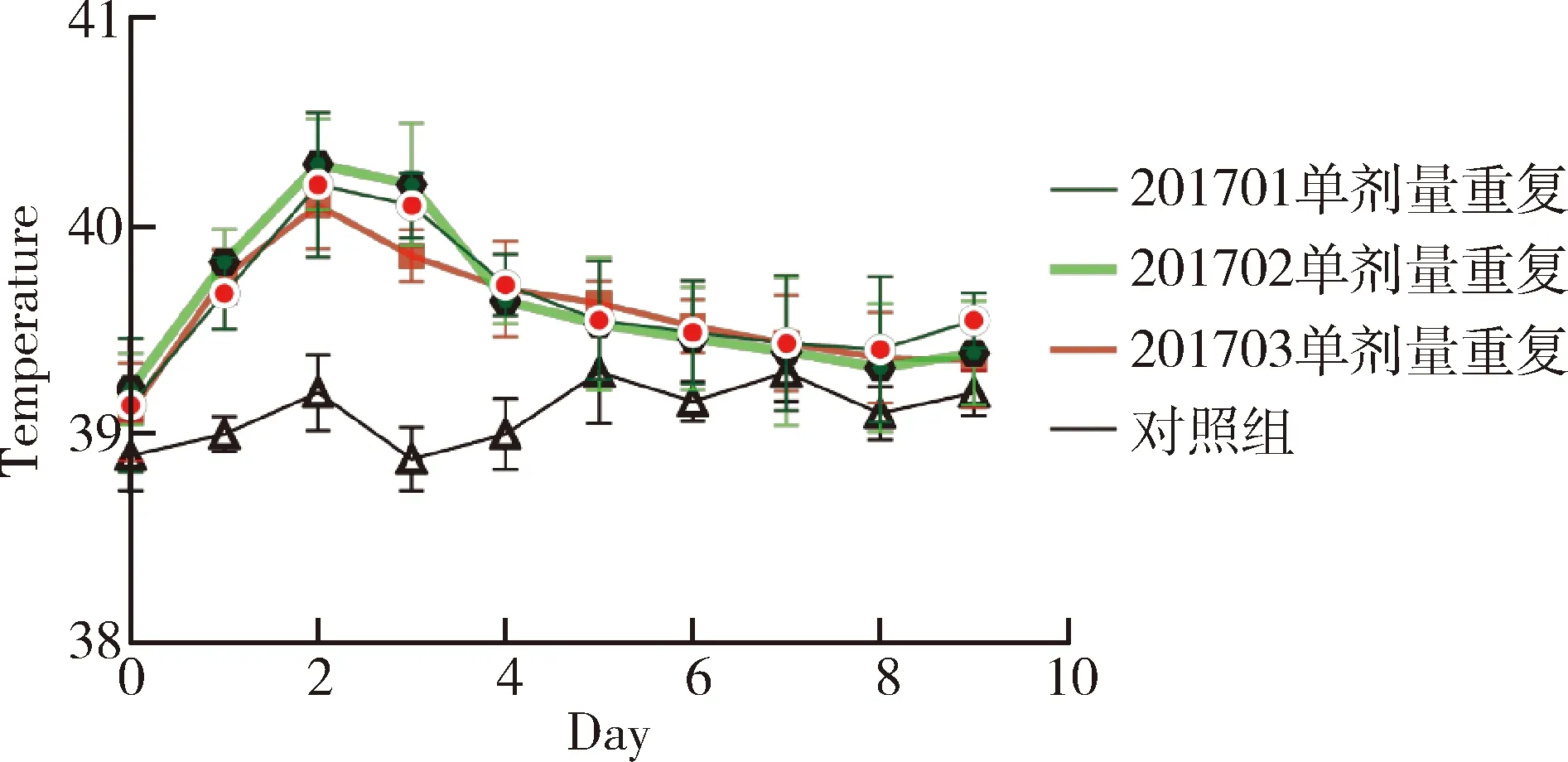
圖3 疫苗單劑量重復接種水貂體溫變化圖Fig 3 The fluctuate curve of body temperature of minkreceived single dose repeat inoculation of vaccine
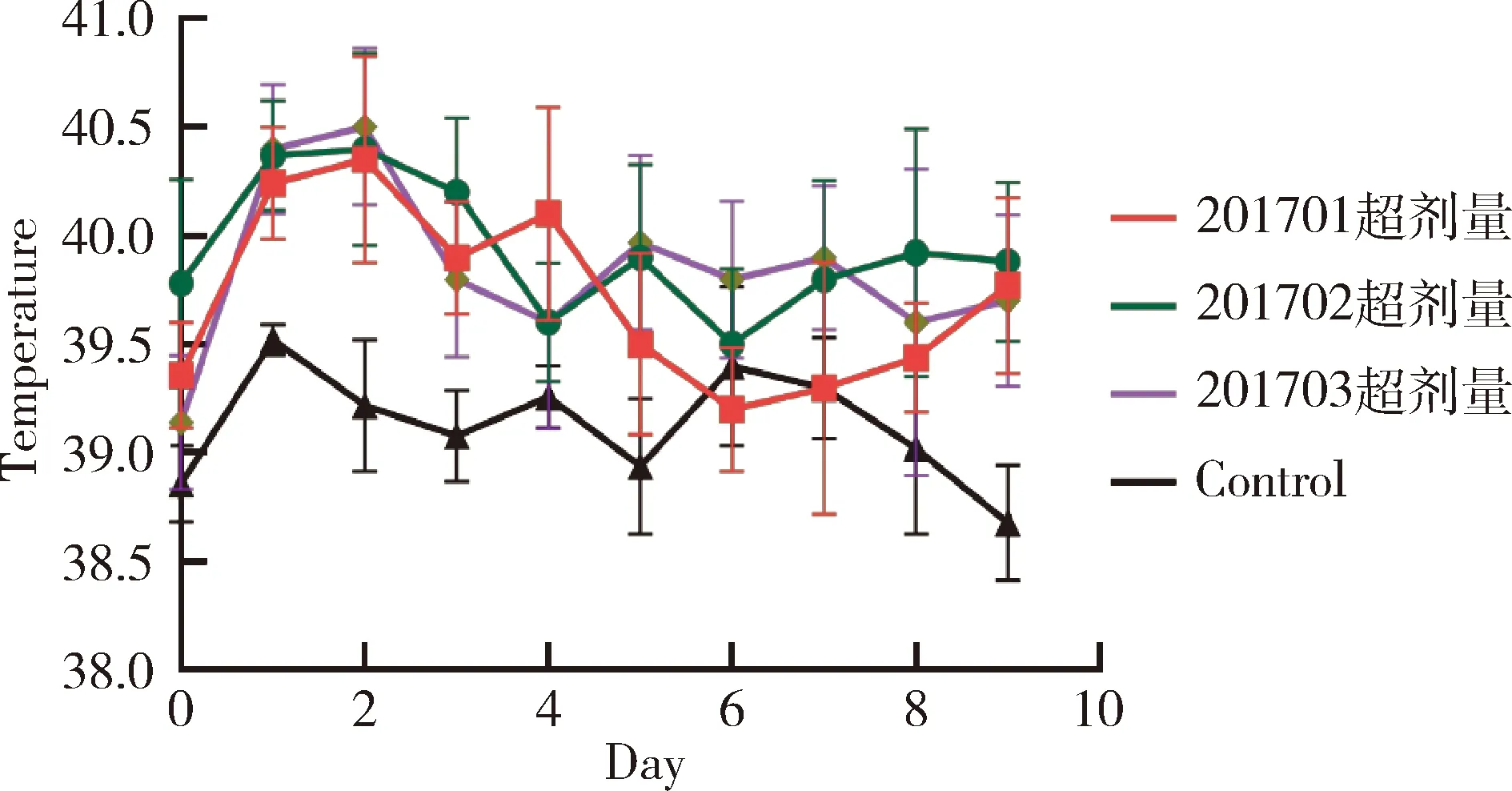
圖4 疫苗超劑量接種水貂后體溫測定結果Fig 4 The fluctuate curve of body temperature ofmink received overdose of vaccine

表4 疫苗單劑量重復接種安全性試驗結果
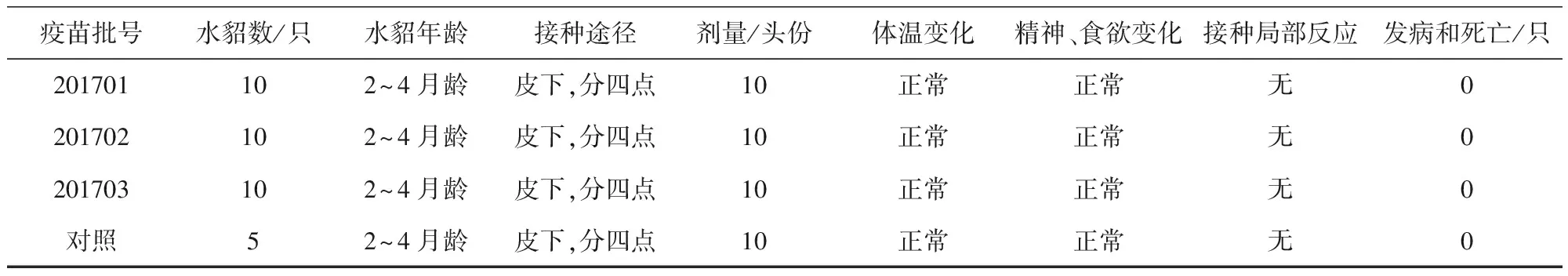
表5 疫苗超劑量接種水貂安全性試驗結果
2.5 單劑量妊娠水貂安全性試驗結果 3批試驗疫苗皮下接種30~35日齡妊娠水貂,通過臨床觀察,接種水貂食欲、糞便和精神狀態均正常,觀察至產仔,未出現流產,產后胎兒發育未發現異常(表6),說明疫苗對妊娠水貂具有較好的安全性。
2.6 微載體安全性評價試驗結果 微載體接種水貂幼崽(2~4月齡)后,接種10 d內各組水貂平均體溫變化正常,與對照組沒有顯著區別(圖5);水貂食欲、糞便及精神狀態均正常,接種局部無腫脹和炎癥,未出現局部和全身炎癥反應(表7)。

表6 疫苗對妊娠水貂安全性試驗結果Tab 6 The security test record of pregnancy mink received one dose of vaccine
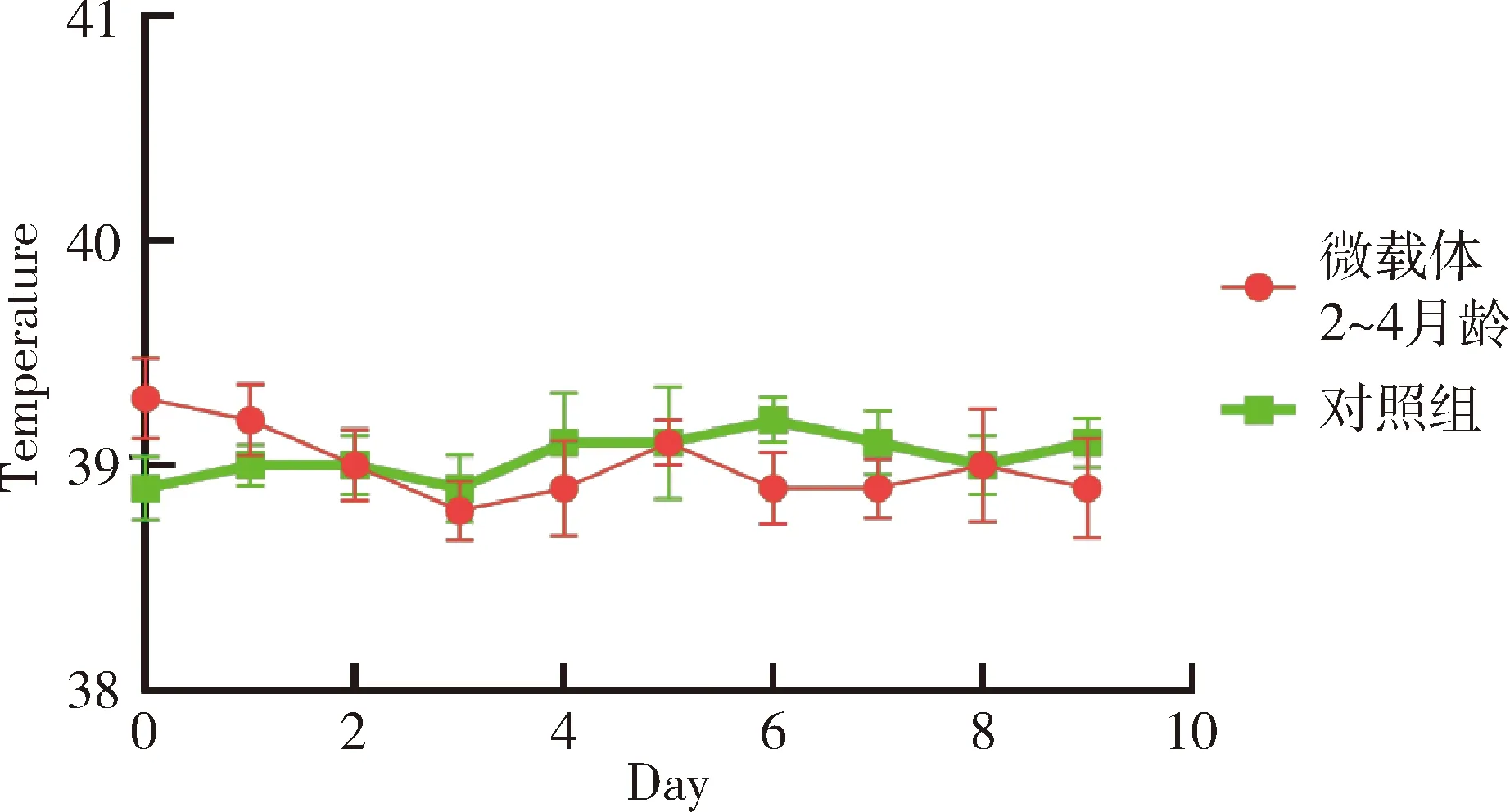
圖5 微載體接種水貂后體溫測定結果Fig 5 The fluctuate curve of body temperature of mink received of microcarrier
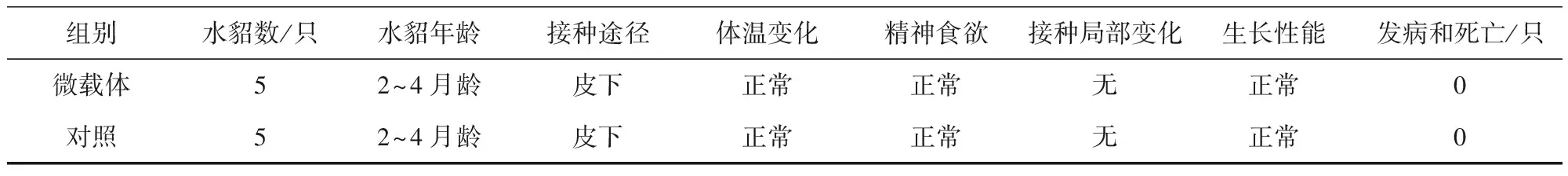
組別水貂數/只水貂年齡接種途徑體溫變化精神食欲接種局部變化生長性能發病和死亡/只微載體52~4月齡皮下正常正常無正常0對照52~4月齡皮下正常正常無正常0
2.7 疫苗接種部位組織病理切片觀察 疫苗接種后,無論是對照組還是實驗組,接種部位皮下均無異常變化,僅見顏色與周圍皮膚略有不同,未見炎癥反應。病理切片觀察發現,接種部位的肌肉組織排列規整、肌纖維整齊、橫紋肌明顯,未見變性、壞死及炎性細胞浸潤(圖6)。
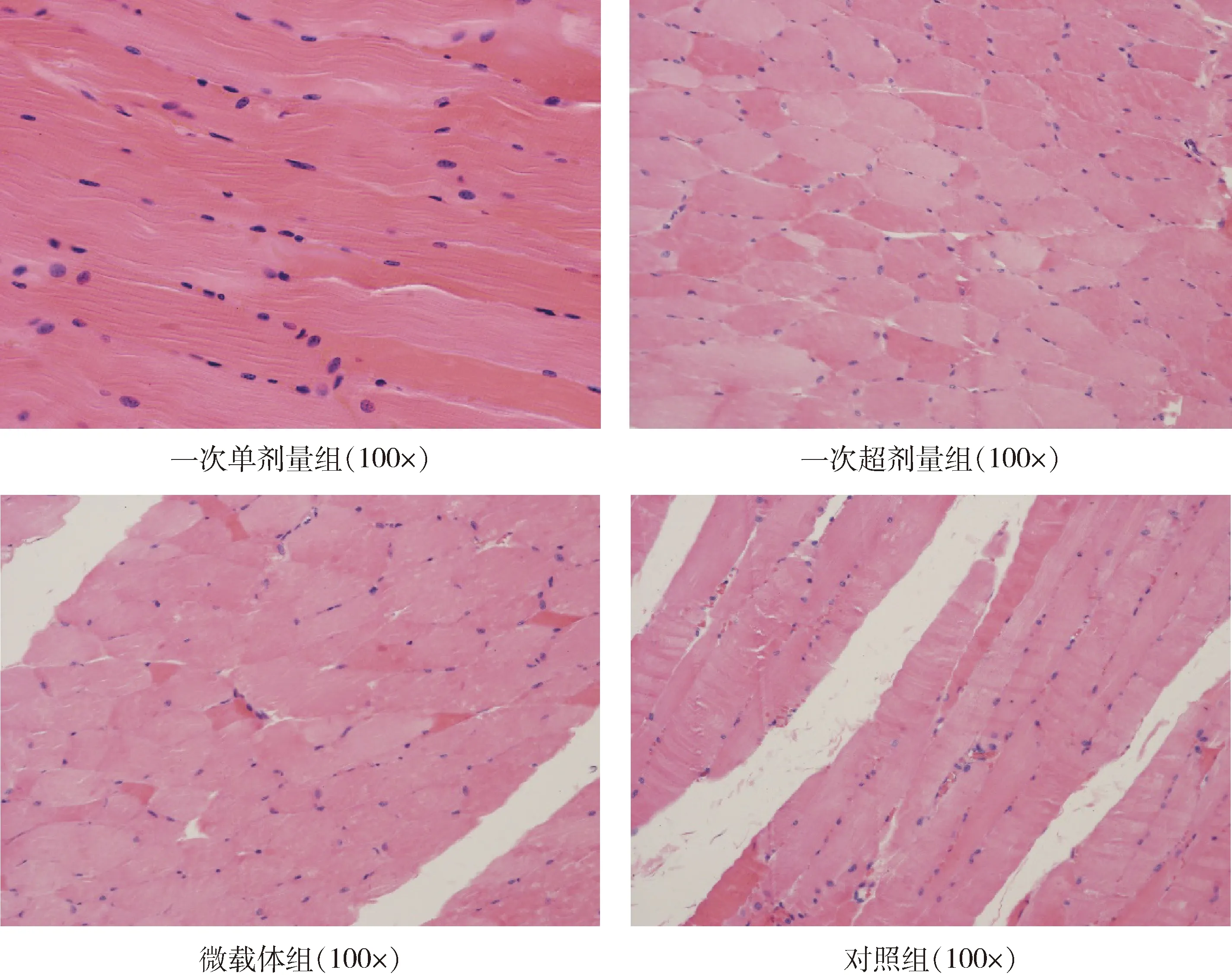
圖6 接種部位組織病理切片觀察Fig 6 The histopathology change of the inoculation site of mink
3 討論與結論
無論是人用疫苗,還是獸用疫苗,安全和有效是其兩大基本特性。因此,任何一個新疫苗在研發階段或者推向市場之前,必須要開展疫苗的安全性評價。例如在我國發生小反芻獸疫(Peste destits ruminants virus,PRRV)疫情后,為了確保疫區外動物安全,我國批準利用PRR Nigerja 75/1疫苗株制造疫苗,并接種羊和豚鼠、小鼠進行了免疫接種,評價疫苗安全性[8-9]。崔艷麗等[10]在研制了雞新城疫、傳染性支氣管炎、減蛋綜合征、禽流感(H9亞型)四聯滅活疫苗(LaSota株+HS25株+HZ株)后,也在本動物上開展了安全性評價。本研究為了盡快將利用懸浮培養工藝研制的水貂犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)推向市場,在本動物上(水貂)開展了疫苗的安全性評價。
根據農業部442號[11]公告中獸藥變更注冊事項及申報資料要求,改變獸藥生產工藝,其生產工藝的改變不應導致藥用物質基礎的改變。因此需要對新工藝研發的疫苗臨床試驗。為了全面評價犬瘟熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)的安全性,參照農業部683號[12]公告中《獸用生物制品實驗室安全試驗技術指導原則》要求,本研究選擇不同年齡的水貂(包括幼崽(2~4月齡)、育成水貂(8~10月齡)、妊娠水貂(30~35 d))進行安全性實驗。實驗分3組進行,每組10只水貂,采用單劑量(1頭份)皮下接種、單劑量重復皮下接種(1頭份)、超劑量(10頭份)皮下接種動物進行安全性試驗。結果表明,接種水貂全身和局部未見異常臨床反應,對幼貂發育無不良影響,體溫波動范圍處于正常范圍,說明疫苗具有較好的安全性。疫苗接種妊娠水貂未見有流產和死亡發生,進一步說明了疫苗的安全性。此外,為了驗證培養介質(微載體)在動物體內的安全性,在單劑量安全性實驗組中設置微載體安全性評價組,通過觀察動物臨床表現、監測體溫變化,未發現異常,說明微載體對實驗動物安全性無明顯影響,這也是微載體懸浮培養技術被廣泛應用于人和動物新工藝開發的重要原因[4,13-14]。
綜上所述,基于懸浮工藝制備的水貂犬溫熱Vero細胞活疫苗(CDV3-CL株,懸浮培養)凍干品,具有很高的安全性,可以用于臨床防治水貂犬瘟熱疾病。

