美國醫療器械監管模式對我國的啟示

摘 要:本文通過分析美國醫療器械監管模式,基于我國國情探討其對我國的啟示。
關鍵詞:美國;醫療器械;監管
如今我國醫療器械產業發展快速,不斷創新,基本滿足了社會公眾的醫療需要,我國的醫療器械監管水平較之前也有大幅度的提升,但與歐美發達國家相比還存在很大差距。美國是最早使醫療器械管理走上法制化管理道路的國家,其監管立法的目的是確保只有安全的醫療器械才能進入市場。
1 美國醫療器械監管模式
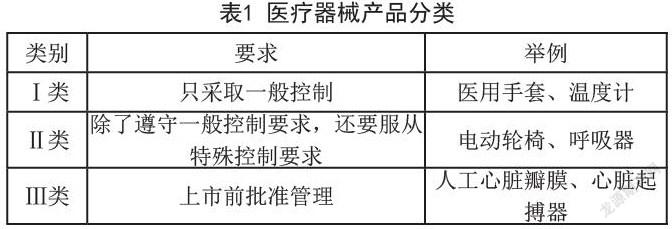
1.1 產品分類
根據美國《聯邦食品、藥品和化妝品法案》(FDCA),FDA是對醫療器械進行監管的主要機構。FDA將所有醫療器械分為三個監管類別,如表1所示。
1.2 市場準入
美國對不同監管類別的醫療器械實行不同的市場準入途徑,其中,絕大多數的Ⅰ類和少數Ⅱ類醫療器械可免于FDA的審查;FDA對絕大多數Ⅱ類醫療器械要求上市前通告(510k),旨在證明擬上市產品與已合法上市的產品實質性等同;而所有Ⅲ類產品和新產品必須通過上市前批準(PMA)才能進入美國市場,這是確保器械安全性和有效性而進行的科學審查必備程序。
1.3 臨床實驗
10%-20%進行上市前通告(510k)和絕大多數申請PMA的醫療器械,需要開展臨床試驗,向FDA申請并提供給FDA足夠的信息,然后FDA會根據這些信息判斷是否同意進行臨床研究,有些可獲得醫療器械臨床研究豁免(IDE),有些只受IDE部分法規約束,有些應完全遵守IDE。
1.4 上市后監管
《醫療器械質量體系規范》(QSR)規定:FDA主要以對企業的質量體系進行檢查的方式來進行上市后監管。通常,Ⅱ、Ⅲ類產品每兩年檢查一次質量體系,而Ⅰ類產品每四年檢查一次。美國醫療器械的上市后監管方式主要包括以下三種[1]:
1.5 信息化建設
美國重視數據庫建設、優化信息標準,目前FDA開放了20多個醫療器械相關數據庫。美國對這些數據庫進行了統合,提高社會參與度,實現基于大數據的監管。其中,與醫療器械上市前相關的信息系統包括醫療器械機構注冊和產品登記系統、醫療器械產品注冊電子提交系統等;上市后相關的信息系統包括醫療器械報告系統、MedWatch報告系統、醫療產品安全網絡等;信息化標準方面則包括臨床數據獲取標準協調、臨床研究數據表格模型、數據集分析模型等[2]。
2 對我國的啟示
2.1 完善相關法律法規
法律法規是一個國家監管體系的核心。作為最早使醫療器械管理走上法制化管理道路的國家,在醫療器械的監管上,美國不僅有上位法,而且還頒布了一系列指導性文件,指導對器械的監管。而在我國,《醫療器械監督管理條例》是一切醫療器械法律體系基礎,雖然經歷了大幅度修訂,也增加了其適用范圍,但仍不是一個成熟的醫療器械法律體系[3]。首先,在效力上,要加快法律建設,完善條例,將其上升至法律層次;在內容上,要擴大條例的適用面,同時減少部門間的交叉重復,覆蓋原有的監管盲點。其次,各級食品藥品監督管理部門要圍繞《醫療器械監管條例》建立適合其地區發展的下位法。
2.2 加強上市后監管
我國實際的監管方式是重上市前審查而輕上市后監管。我國對于上市前的審批雖不說完美,但也做到了最嚴格的處理,但對產品上市后的監管卻缺乏效率和監督力度。美國不僅有著嚴格的上市前門檻,上市后也進行全面的監督,對違法行為也有相應的懲罰措施。我國應當轉變思路,同樣重視上市后監管。首先,加強上市后監測研究,對某些因為特殊工藝或者設計而容易出現不良事件的醫療器械產品,加大監測力度;同時,強化企業上報不良事件的意識,讓其自覺履行法律責任;其次,加強醫療器械現場檢查,針對醫療器械生產、經營環節,重視醫療器械質量管理規范實施工作。
2.3 加快信息化建設
美國重視數據庫建設、優化信息標準,是其醫療器械監管較為完備的一個重要原因。FDA開放了20多個醫療器械相關數據庫,其中包括政策法規、上市前審批、上市后監測等方面。與美國相比,目前我國在醫療器械上市后的智慧監管手段方面還是比較匱乏的,信息化建設也比較落后,需要進一步加快醫療器械監管數據庫建設[4],主要包括實現企業許可備案、產品注冊備案、監督檢查、不良事件監測和稽查處罰等信息“一鍵可查”,生產經營許可電子化等。
參考文獻
[1]阮吉敏.中美醫療器械監管的比較與分析[J].國際醫藥衛生導報,2005(07):98-105.
[2]陸穎,補世明,陳鋒.美國FDA醫療器械監管信息化情況及啟示[J].中國醫藥導刊,2017,19(11):1250-1252.
[3]溫雪君,岑銓華.醫療器械管理過程中存在的問題[J].醫療裝備,2017,30(07):89-90.
[4]許慧雯,鄭佳,王慧超等.醫療器械標準管理現狀及思考[J].中國食品藥品監管,2018(11):20-25.
作者簡介:
余麗麗(1989-),女,籍貫:江蘇鎮江,民族:漢族,職稱:助教,學歷:碩士,研究方向:藥事管理,國內外藥事法規及藥品安全監管

