超長鏈脂肪酸的研究進展
萬靜雅 涂行浩 魏芳 江正兵 徐淑玲 呂昕 董緒燕 向極釬 Siew-young Quek 陳洪
摘?要:對超長鏈脂肪酸的合成代謝途徑、生物學功能、分離純化方法、分析檢測技術以及應用等進行綜述,并對其研究及應用前景進行了展望。
關鍵詞:超長鏈脂肪酸;延長;生物學功能;分離;定量分析
超長鏈脂肪酸(VLCFAs)目前還無統一的碳鏈長度定義,但大多數研究者認為其一般是指碳鏈長度在20以上的脂肪酸[1-2]。根據碳鏈上雙鍵數目的不同,VLCFAs一般可分為超長鏈飽和脂肪酸(VLCSFAs)、超長鏈單不飽和脂肪酸(VLCMUFAs)和超長鏈多不飽和脂肪酸(VLCPUFAs)。按照ω編號系統又可以分為ω-3、ω-6、ω-9脂肪酸。在動物體中,超長鏈脂肪酸作為營養物質及皮膚屏障組成對動物體的生長發育起著至關重要的作用。在植物體中,超長鏈脂肪酸不僅能作為能源物質,參與種子中甘油酯、生物膜膜脂及鞘脂的合成,并為角質層蠟質的生物合成提供前體物質[3],還以蠟質的形式存在于植物表皮細胞中,對植物體的保水抗旱能力及生長發育發揮著重要作用。在一些真菌和細菌中同樣存在著超長鏈脂肪酸,為其生命活動提供保障。在細胞中,超長鏈脂肪酸不僅是磷脂層的重要組成成分,并有研究認為,其作為信號分子也擔負著細胞間的交流與信號傳導功能[4]。超長鏈脂肪酸在食品、醫療及工業上也有著廣闊的應用價值。本文主要綜述了超長鏈脂肪酸的生物學功能、分離純化方法、分析檢測技術及應用方面的研究進展,并對其應用前景進行了展望。
1?超長鏈脂肪酸的生物學功能
超長鏈脂肪酸的延長機制是由縮合反應、還原反應、水解反應、還原反應四個核心步驟來完成的,每個步驟需要用到不同的酶,每個循環可將底物分子增加2個碳單位[5]。
1.1?超長鏈脂肪酸對細胞生命活動的意義
超長鏈脂肪酸作為磷脂分子的重要組成部分,在細胞內對細胞生化反應、營養物質的儲藏及細胞間的交流都發揮著重要作用。脂肪酸積累過多,由于輸送和利用間的不平衡可能會對一些組織細胞產生毒性,其表現為氧化應激和炎癥,甚至導致細胞凋亡[6]。Laura R.Parisi等[7]使用非靶向液質聯用(LC-MS)技術在分子水平上探究了細胞程序性死亡期間脂類物質的調節情況,發現神經酰胺和超長鏈脂肪酸會在這個過程中積累,通過添加一種脂肪酸合成酶抑制劑——淺藍菌素,發現其能抑制脂肪酸的生物合成以及消耗超長鏈脂肪酸,可更好地保持質膜的完整性并防止細胞死亡。
1.2?超長鏈脂肪酸對植物生命活動的作用
植物表皮細胞會在植物葉片表面形成一種叫蠟質的保護物質,其主要化學成分是高級脂肪酸及高級一元醇的脂類物質,這其中有著多種VLCFA衍生物,包括游離脂肪酸、醛、酮、伯醇、仲醇、烷烴和烷基酯。此外,許多植物的角質蠟還含有環狀化合物,如三萜類化合物和芳香族化合物[8]。Bigang Mao等[9]研究了水稻基因WSL2突變體的遺傳、生理及形態學特征,發現該突變體相比野生型對干旱脅迫更敏感,因WSL2基因與超長鏈脂肪酸的碳鏈延伸有關,因此進一步證實了植物表皮蠟質中超長鏈脂肪酸的保水抗旱功能。一些研究還表明,超長鏈脂肪酸及其衍生物對植物的抗寒性能、花粉的形成及可育性也起到了一定的作用[10]。
超長鏈脂肪酸是合成三酰甘油、蠟質和鞘脂類物質的一類脂肪酸,而這些脂類物質是種子貯藏營養物質所必需的。細胞分裂素是調控植物生長發育的重要植物激素,Takashi Nobusawa等[11]通過研究擬南芥超長鏈脂肪酸合成缺陷的突變體,發現植物表皮中的超長鏈脂肪酸對植物的正常發育是必要的,輕度降低超長鏈脂肪酸的含量可以促進細胞增殖,從而促進芽的生長,過多的超長鏈脂肪酸會抑制細胞分裂素的合成,這是抑制植物脈管系統過度增殖所必需的。Yong-Mei Qin等[12]發現,在胚珠的培養基中添加超長鏈飽和脂肪酸(從C20∶0到C30∶0)能顯著地促進棉花纖維細胞的伸長,除草劑中的乙草胺會抑制纖維的生長,而超長鏈飽和脂肪酸C24∶0在沒有乙烯生物合成抑制劑時可以解除乙草胺對纖維生長的抑制效果。徐宗余等[13]證實,噬吩草胺及其類似物的存在會導致由油酸延長而成的超長鏈單不飽和脂肪酸的合成效果降低,這為除草劑的研究提供了科學依據。
1.3?超長鏈脂肪酸對動物生長發育的影響
超長鏈脂肪酸作為皮膚屏障的組成成分可以起到對人體的保護作用。Miyoung Suh等[14]研究表明,在新生兒發育過程中,通過在膳食中少量添加ARA和DHA足以影響視覺細胞膜的超長鏈脂肪酸組成,也影響著視紫紅質及光感受細胞的發育。Wenmei Li等[15]研究發現,ELOVL4缺陷型小鼠會由于其超長鏈脂肪酸衍生的神經酰胺的缺乏,從而致使皮膚產生通透性屏障功能缺陷并造成小鼠在新生期死亡。Matthew S.Thimgan等[16]研究bgm和hll缺陷型果蠅證明了參與脂質代謝的基因可以調節睡眠的動態平衡,并認為睡眠不足或者體質指數(BMI)增加可能與超長鏈脂肪酸有關。Bernice H.Wong等[17]對敲除Mfsd2a基因的小鼠進行實驗,發現Mfsd2a介導的LPC轉運是人腦生長所必需的,通過Mfsd2a轉運LPC是眼睛從血液中攝取DHA及發展光感受器膜盤的重要途徑。M.Suh等[18]對喂食ARA及DHA的大鼠視網膜進行分析,證實在斷奶前后期飲食中的ARA和DHA攝入量是影響視覺細胞膜脂肪酸組成及發育的重要因素。James L.Hargrove等[19]討論了在粗谷物、蜂蠟和許多植物衍生食品中發現的蠟酯、脂肪酸和醇產生的營養及調節作用,提出從植物蠟和蜂蠟中提取的超長鏈脂肪醇能夠降低人體血漿膽固醇,每天食用幾克小麥胚芽油可提高身體耐力、抵抗身體壓力并有利于訓練后的身體恢復。
2?超長鏈脂肪酸的分離與純化方法
超長鏈脂肪酸可以通過化學合成的方式獲得,也可以通過轉基因的方式在植物或者微生物中生產,但這些方法容易引入較多雜質并對生態環境產生影響,因此,從天然生物體中獲得并分離出各種超長鏈脂肪酸引起了研究者們的關注。目前超長鏈脂肪酸的分離純化方法主要有薄層色譜法與柱層析法、金屬鹽沉淀法與重結晶法、超臨界萃取法、尿素包合法及分子蒸餾法等。除上述方法外,也有少部分研究者利用乳化分離法、氣相色譜法及高效液相色譜法等對超長鏈脂肪酸進行分離純化。
2.1?薄層色譜法與柱層析法
薄層色譜法(TLC)的原理是固-液吸附,在玻璃板、塑料或者金屬板上涂上固定相形成薄層,再利用展開劑將需分離的樣品在固定相中展開,以此來達到樣品的快速分離與純化。該方法的特點是操作簡便,適用于少量樣品的分離純化,分離出的物質純度較高,可用于樣品的精制。吸附劑及展開劑的選擇對于樣品的分離效果有著重要影響。常用的吸附劑有硅膠、硅藻土、氧化鋁、纖維素、葡聚糖凝膠、聚酰胺等。展開劑的選擇一般是揮發性的有機溶劑,如石油醚、甲醇、正己烷、乙酸乙酯等以及它們的混合體系。王性炎等[20]利用TLC將混合脂肪酸中的神經酸進行分離,經過萃取、結晶,得到了純度在90%以上的神經酸純品。葉在榮等[21]利用風干的硅藻土G反向薄層、液體石蠟飽和的乙腈溶劑作為展開劑、0.03%的熒光素乙醇溶液和溴蒸汽作為顯色劑,將亞麻酸、亞油酸、油酸、花生烯酸及芥酸這5種不飽和脂肪酸的甲酯很好地分離開。柱層析的原理與TLC相似,也是利用樣品各組分在固定相與流動相中的分配系數的不同達到各組分間的分離,但由于柱層析上樣量較大,適用于大量樣本的分離。
2.2?金屬鹽沉淀法與重結晶法
金屬鹽沉淀法是利用混合脂肪酸金屬鹽因脂肪酸碳鏈長度及飽和程度等結構上的差異而在有機溶劑中的溶解度不同進行脂肪酸金屬鹽分離的一種方法。首先將混合脂肪酸經過皂化反應生成脂肪酸金屬鹽,通過金屬鹽沉淀法分離后再將脂肪酸金屬鹽進行酸化從而得到分離后的脂肪酸。侯靜德等[22]利用金屬鹽沉淀法,以丙酮作為溶劑進行脂肪酸的分離,最終可將產物中的神經酸質量百分比提高到82%以上。重結晶法是添加一定量的有機試劑后,將混合脂肪酸置于合適的溫度下進行結晶。J.M.Vargas-Lopez等[23]在38~42℃時將混合脂肪酸溶解在乙醇中然后置于-14℃下進行結晶,經過2次結晶后芥酸的純度達到87.1%。重結晶法常用的有機溶劑有甲醇、乙醇、石油醚、乙醚等,也可將這些物質混合物作為有機溶劑。一般來說,脂肪酸的溶解度隨碳鏈長度增加而減少,隨不飽和度的增加而增加,低溫有利于多不飽和脂肪酸的富集。該方法操作較簡單,但需使用大量溶劑,成本較高,分離效果一般。
2.3?超臨界萃取法
超臨界萃取法是利用流體(一般為CO2),通過改變溫度及壓力來控制不同碳鏈長度和飽和程度的脂肪酸在流體及油相間的分配系數從而達到分離的目的。王建民等[24]利用超臨界CO2萃取法,以乙醇作為夾帶劑得到神經酸甘油酯粗品。劉偉民等[25]用超臨界CO2萃取法在填料塔壓為12.5 MPa、塔溫40~85℃、CO2流量5 L/min、進料流速0.8 mL/min時將魚油中DHA和EPA濃度提高至83%,回收率達到84%的最佳分離效果。該方法將蒸餾及萃取相結合,從而能夠得到大量純度較高的分離樣品,且CO2屬于惰性氣體,對自然界無毒,將其作為介質還能防止不飽和脂肪酸的氧化及超長鏈脂肪酸的分解,但較難分離碳數相同、雙鍵數不同的組分。
2.4?尿素包合法
尿素包合法的原理是利用混合脂肪酸在低溫結晶過程中,尿素分子只與飽和脂肪酸及單不飽和脂肪酸相結合形成絡合物并在低溫下產生結晶,而多不飽和脂肪酸尤其是碳鏈較長的多不飽和脂肪酸,因其雙鍵較多、碳鏈較長難以被尿素分子包合,故無法與尿素形成絡合物,將結晶后的樣品經過過濾處理便可實現部分脂肪酸組分的分離。敬思群等[26]將尿素與魚油比為1∶1,溶劑與魚油比為7∶1,置于-5℃下結晶,可將EPA和DHA的含量從56%提高至72%。敬思群等[27]以混合多不飽和脂肪酸為原料,尿素/混合脂肪酸(m/m)=1∶1,混合脂肪酸/乙醇(m/v)=1∶16,包合24h,可將多不飽和脂肪酸含量由68.12%增加到91.35%。該方法成本較低,操作較為簡單,能實現大量脂肪酸的分離,適用于超長鏈多不飽和脂肪酸的分離與純化,對于被尿素包合的飽和及單不飽和脂肪酸還需進行進一步解析,過程較復雜。
2.5?分子蒸餾法
分子蒸餾法是蒸餾方法的一種,其原理是高真空的條件下,利用不同分子運動自由程的差別導致蒸發速率的不同來達到液體混合物分離的目的。分子蒸餾可以在遠低于脂肪酸沸點的溫度下進行,同時分子蒸餾時因其真空度很高,因此脂肪酸也不易被氧化。方旭波等[28]以乙基酯類魚油為原料,經二級分子蒸餾和尿素包合后,EPA和DHA的含量可從30.72%提高到83.42%。周琴芬等[29]研究發現,在溫度為110℃、壓力低于110 Pa、進料速度為0.02g/s時,可將神經酸乙酯的質量分數提高到87.03%,回收率達到64.55%,采用輕組分再蒸餾法得到神經酸乙酯的質量分數為71.67%。分子蒸餾法分離純化超長鏈脂肪酸工藝雖然較復雜,但其過程無毒無污染,可進行大量生產,且得到的產品的純度較高。
3?超長鏈脂肪酸的分析檢測技術
超長鏈脂肪酸的定量分析常用到的技術有色譜法、色譜與質譜聯用法等,運用這些方法能夠在探究超長鏈脂肪酸的功能、開展其相關應用及提純時有效地對VLCFAs進行定量檢測分析。
3.1?氣相色譜法及氣相色譜質譜聯用技術
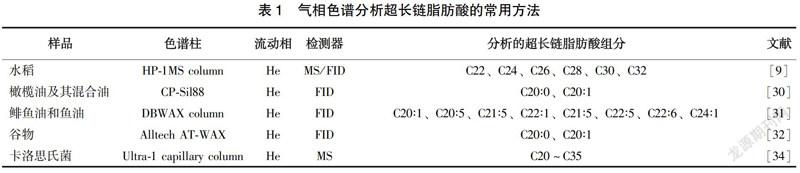
氣相色譜法(GC)是將脂肪酸樣品甲酯化、乙酯化或者三甲基硅烷化后,載氣作為流動相,利用各組分間的沸點、極性或吸附性能的差異在氣相色譜柱進行分離,再串聯上火焰電離檢測器(FID)、熱導檢測器(TCD)或者電子俘獲檢測器(ECD),便可測定出各組分的濃度。該方法比較穩定,但衍生過程較為繁瑣。Hazem Jabeur等[30]利用GC-FID法可以檢測出脂肪酸甲酯標準溶液中C20∶0、C20∶1、C20∶2、C21∶0以及初榨橄欖油中的C20∶0、C20∶1等超長鏈脂肪酸含量,并用GC-FID法結合液相色譜法驗證了橄欖油中摻入大豆油、向日葵油、玉米油等廉價植物油的閾值,為辨別特純橄欖油是否摻雜常見植物油提供了科學依據。N C Shantha等[31]將蜂酸(C23∶0)和神經酸作為內標,運用GC-FID法測定了市售魚油乙基酯膠囊中的EPA和DHA的含量,結果顯示,蜂酸和神經酸在FID檢測器中響應相似,可以在定量魚油膠囊時作內標使用。Cristian Tudor Matea等[32]通過GC-FID法測定了羅馬尼亞6個谷物樣品中脂肪酸的含量,其中包括C20∶0、C20∶1等超長鏈脂肪酸,該研究有助于評估人群營養攝入量。氣相色譜分析超長鏈脂肪酸的常用方法見表1。
氣相色譜與質譜聯用技術(GC-MS)是將質譜(massspectrum,MS)作為氣相色譜的檢測器,結合了氣相色譜的高效分離和質譜檢測器的高靈敏度優勢,可以檢測出FID等檢測器所檢測不到的一些痕量物質,但設備成本會相應增加。Dongmei Yu等[33]在探究植物表皮蠟質中超長鏈脂肪酸的相關合成酶及基因時,通過GC-MS檢測了日本裸稻葉片蠟質中的C20~C34的超長鏈脂肪酸的合成情況。Rezanka T等[34]用GC-MS法測定了南極采集的Calothrix sp.中的長達C34的超長鏈脂肪酸衍生物,并通過實驗證明其樣本中不飽和脂肪酸如C17∶1存在量很低時,只有在用豬胰腺磷脂酶A2水解后用GC-MS才能被成功鑒定出來。S J Hardy等[35]在探究超長鏈脂肪酸對人體細胞中的Ca2+和超氧化物的產生之間的關系時,運用了GC-MS法來定量超長鏈脂肪酸,發現C30∶4脂肪酸能夠使胞內的Ca2+釋放出來。
3.2?高效液相色譜法及高效液相色譜質譜聯用技術
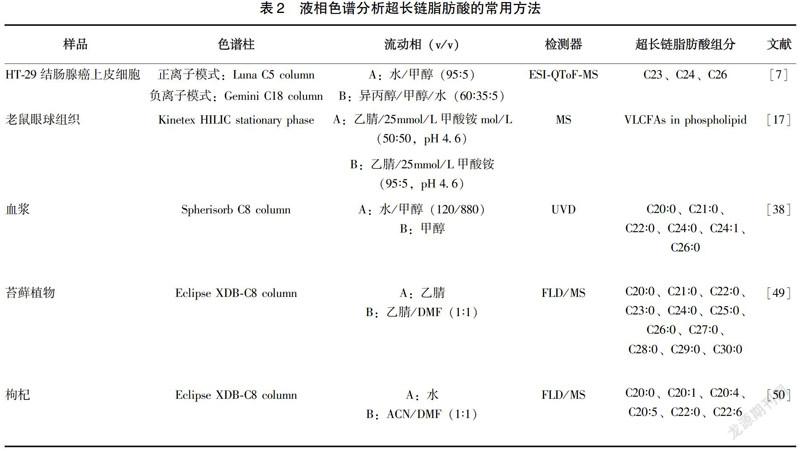
與GC相比,液相色譜沒有健全的譜庫,后續分析較為復雜,但其有以下優點[36]:(1)可以檢測一些不耐高溫的化合物,許多碳鏈較長的不飽和脂肪酸在高溫下可能發生結構變化、異構化甚至分解;(2)能夠更方便地收集分離后的樣品組分以作進一步分析;(3)氣相色譜分析經常需要用到衍生化的步驟,相比之下,液相色譜法的樣品前處理過程更加便捷等。液相色譜常用的檢測器有紫外吸收檢測器(UVD)、熒光檢測器(FLD)、二極管陣列檢測器(PDAD)、MS等。熊輝等[37]以C17∶0作為內標,改良了Doles法萃取血清中游離脂肪酸,用HPLC法對92名健康體檢者空腹外周血中游離脂肪酸進行了定量分析,其中包括對C20∶4、C20∶5等超長鏈脂肪酸的測定。Nlcholas A.Hall等[38]通過HPLC法鑒定出正常血漿、腎上腺腦蛋白營養不良者血漿以及嬰兒患該病者血漿中的C20~C26的超長鏈脂肪酸,并將C24/C22以及C26/C22的比值與GC-MS的檢測結果進行了比較,驗證了HPLC方法檢測結果的準確性。液相色譜分析超長鏈脂肪酸的常用方法見表2。
高效液相色譜與質譜聯用技術(HPLC-MS)將液相色譜的分離優勢與質譜的結構鑒定優勢相結合,能夠有效降低復雜組分樣品的基質效應,這將大大提高物質分析的效率及精確度。Liubin等[39]在探究Rubus niveus Thunb.油時通過HPLC-MS法測定了C22∶0及C20∶4的含量。Ding Yang-Jun等[40]運用HPLC-APCI-MS法測定了深海魚油中的C20∶1、C20∶5、C22∶6等超長鏈不飽和脂肪酸的含量。
4?超長鏈脂肪酸的應用
超長鏈脂肪酸在工業、醫學、食品等領域有著廣泛的應用前景。在工業領域,花生酸(C20∶0)常用于加工制造洗滌劑、肥皂等日用品,并可作為潤滑劑、潤滑油添加劑用于零件中,還可用作照相材料。山崳酸(C22∶0)主要用于生產各種山崳酸衍生物,其衍生物如醇、酯、酰胺等可廣泛用于紡織、石油、化妝品等行業。芥酸(C22∶1)多用于生產芥酸酰胺用于制造各種塑料、抗粘劑、抗靜電劑及潤滑劑等。其他超長鏈脂肪酸如木蠟酸(C24∶0)、蠟酸(C26∶0)、蟲漆蠟酸(C32∶0)等也廣泛用于特殊的有機合成等研究領域。
研究者發現,超長鏈脂肪酸與代謝類疾病有著極大的相關性[41-45]。Rie Matsumori等[42]認為,紅細胞中的C24∶0水平與代謝癥候群(MS)患者的特異性動脈粥樣硬化的脂蛋白譜及炎癥狀態有關,MS組紅細胞的C24∶0水平顯著高于非MS組。Vijitha K.Senanayake等[43]也發現,炎癥和線粒體應急與MS的病因有著某種相關性。Hugo W.Moser等[44]發現,VLCFAs除了會在腎上腺腦白質營養不良(ALD)患者的腎上腺皮質及腦白質等組織中積累,其在血漿中的代謝水平也會有明顯地增加。除此之外,Ruling Shi等[45]還發現,阿爾茨海默癥(AD)患者腦中的VLCFAs水平也有增加,這意味著過氧化物酶氧化功能障礙可能與AD的發病有關。這些研究都表明了VLCFAs在未來醫療上有極大潛力作為有效的生物標志代謝物來檢測相關疾病,利用超長鏈脂肪酸分子水平上的調節來治療或者輔助治療代謝類的疾病極具前景。
在嬰幼兒配方食品中,人們發現DHA與ARA的添加比例對于營養效果至關重要,《食品安全國家標準嬰幼兒配方食品》[46]明確指出,添加DHA時至少要添加同等量的ARA,并且EPA的量不應超過DHA。除此之外,在油類產品中,超長鏈脂肪酸或飽和脂肪酸的比例會對油品的凝固點產生影響,過多的超長鏈脂肪酸會使油品更容易產生冬化現象。高油酸花生油與普通花生油的脂肪酸成分分析表明[47],高油酸品種花生油中的油酸含量在76%~81%之間,普通品種花生油中的油酸含量在39%~47%之間,但高油酸花生油中的花生酸、鱈油酸、山崳酸、木蠟酸這些超長鏈脂肪酸的總含量仍然有7%左右,因此在低溫下依然容易產生冬化現象。所以,高油酸花生油中的超長鏈脂肪酸已經成為備受關注的研究重點。
5?結論
研究者們已經對超長鏈脂肪酸的合成代謝路徑有了初步的了解[48],進一步挖掘超長鏈脂肪酸的生物學功能能夠為植物的育種及品質改良提供參考,拓展人們對生物體的認識,并為其在食品、藥品領域的運用提供科學依據。尋找有效的超長鏈脂肪酸作為生物標志物能使未來的疾病診斷及身體狀況檢查變得更加精確、便捷。此外,發明更先進的提取手段,尋找更有效的分離、提純方法能夠提高對天然脂肪酸的利用率。優化超長鏈脂肪酸的定量檢測技術,開發更先進、靈敏、便捷的分析方法,是其今后研究與應用的可靠保障。
參考文獻
[1]Cassagne C,Lessire R,Bessoule J J,et al.Biosynthesis of very long chain fatty acids in higher plants[J].Progress in Lipid Research,1994,33(1-2):55.
[2]Tanetani Y,Fujioka T,Kaku K,et al.Studies on the inhibition of plant very-long-chain fatty acid elongase by a novel herbicide,pyroxasulfone[J].Journal of Pesticide Science,2011,36(2):221-228.
[3]倪郁,郭彥軍.植物超長鏈脂肪酸及角質層蠟質生物合成相關酶基因研究現狀[J].遺傳,2008,30(5):561-567.
[4]Paz R A,Lagüe P,Lamoureux G,et al.Effect of saturated very long-chain fatty acids on the organization of lipid membranes:a study combining(2)H NMR spectroscopy and molecular dynamics simulations[J].Journal of Physical Chemistry B,2016,120(28):6951-6960.
[5]Jakobsson A,Westerberg R,Jacobsson A.Fatty acid elongases in mammals:their regulation and roles in metabolism[J].Progress in Lipid Research,2006,45(3):237-249.
[6]Savary S,Trompier D,Andréoletti P,et al.Fatty acids-induced lipotoxicity and inflammation[J].Current Drug Metabolism,2012,13(10):1358-1370.
[7]Parisi L R,Li N,Atilla-Gokcumen G E.Very long chain fatty acids are functionally involved in necroptosis[J].Cell Chem Biol,2017,24(12):1445-1454.
[8]Jetter R,Riederer M.Localization of the transpiration barrier in the epi-and intracuticular waxes of eight plant species:water transport resistances are associated with fatty acyl rather than alicyclic components[J].Plant Physiology,2016,170(2):921.
[9]Mao B,Cheng Z,Lei C,et al.Wax crystal-sparse leaf2,a rice homologue of WAX2/GL1,is involved in synthesis of leaf cuticular wax[J].Planta,2012,235(1):39-52.
[10]胡曉君,張正斌,劉文,等.植物表皮蠟質及極長鏈脂肪酸類物質的研究進展[J].安徽農業科學,2013(12):5176-5178.
[11]Nobusawa T,Okushima Y,Nagata N,et al.Synthesis of very-long-chain fatty acids in the epidermis controls plant organ growth by restricting cell proliferation[J].Plos Biology,2013,11(4):e1001531.
[12]Qin Y M,Hu C Y,Pang Y,et al.Saturated very-long-chain fatty acids promote cotton fiber and arabidopsis cell elongation by activating ethylene biosynthesis[J].Plant Cell,2007,19(11):3692.
[13]徐宗余.2-氯-N-(3-甲氧基-2-噻吩甲基)-2,6-二甲基乙酰替苯胺及其類似物對超長鏈脂肪酸生物合成的抑制作用[J].世界農藥,2002,24(5):7-10.
[14]Suh M,et al.Dietary 20:4n-6 and 22:6n-3 modulates the profile of long-and very-long-chain fatty acids,rhodopsin content,and kinetics in developing photoreceptor cells[J].Pediatric Research,2000,48(4):524-530.
[15]Li W,Sandhoff R,Kono M,et al.Depletion of ceramides with very long chain fatty acids causes defective skin permeability barrier function,and neonatal lethality in ELOVL4 deficient mice[J].International Journal of Biological Sciences,2007,3(2):120-128.
[16]Thimgan M S,et al.Identification of genes associated with resilience/vulnerability to sleep deprivation and starvation in drosophila[J].Sleep,2014,38(5):801.
[17]Wong B H,et al.Mfsd2a is a transporter for the essential ω-3 fatty acid docosahexaenoic acid(DHA)in eye and is important for photoreceptor cell development[J].Journal of Biological Chemistry,2016,291(20):10501-10514.
[18]Suh M,et al.Relationship between dietary supply of long-chain fatty acids and membrane composition of long-and very long chain essential fatty acids in developing rat photoreceptors[J].Lipids,1996,31(1):61-64.
[19]Hargrove J L,Greenspan P,Hartle D K.Nutritional significance and metabolism of very long chain fatty alcohols and acids from dietary waxes[J].Experimental Biology & Medicine,2004,229(3):215-226.
[20]王性炎,馬新世,李全新,等.用元寶楓油提取神經酸的工藝方法[P].CN:1609090,2005.
[21]葉在榮,單友諒,朱文適.薄層色譜法分離植物種子中主要不飽和脂肪酸的研究[J].植物生理學報,1983(6):57-60.
[22]候鏡德,袁曉悟,胡偉.金屬鹽沉淀法分離神經酸[J].生物技術,1996,6(1):39-41.
[23]Vargas-Lopez J M,et al.?Processing of crambe for oil and isolation of erucic acid[J].Journal of the American Oil Chemists Society,1999,76(7):801-809.
[24]王建民.神經酸的提取、純化生產工藝[P].CN:02136802.3,20020904.
[25]劉偉民,馬海樂,李國文.超臨界CO2連續濃縮魚油EPA和DHA的研究[J].農業工程學報,2003,19(2):167-170.
[26]閔征橋,高盼,何東平,等.尿素包合法富集魚油中EPA和DHA的工藝研究[J].糧油食品科技,2013,21(6):25-29.
[27]敬思群,陳婧萱.尿素包合法富集馬齒莧全草油多不飽和脂肪酸及脂肪酸分析[J].糧食與油脂,2015(2):33-36.
[28]方旭波,龔戩芳,蔣雅美,等.分子蒸餾和尿包結合法富集乙酯化EPA/DHA[J].中國食品學報,2013,13(4):101-106.
[29]周琴芬.蒜頭果種仁神經酸制備工藝研究[D].杭州:浙江大學,2017.
[30]Jabeur H,et al.Detection of Chemlali extra-virgin olive oil adulteration mixed with soybean oil,corn oil,and sunflower oil by using GC and HPLC[J].Journal of Agricultural & Food Chemistry,2014,62(21):4893-4904.
[31]Shantha N C,Ackman R G.Nervonic acid versus,tricosanoic acid as internal standards in quantitative gas chromatographic analyses of fish oil longer-chain n-3 polyunsaturated fatty acid methyl esters[J].Journal of Chromatography B Biomedical Sciences & Applications,1990,533(2):1-10.
[32]Matea C T,Bele C.Quantification of tocopherol and fatty acid content in selected Romanian cereal using HPLC-FL and GC-FID[J].Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca.Agriculture,2008,65(2):268-272.
[33]Yu D,Ranathunge K,Huang H,et al.Wax Crystal-Sparse Leaf1 encodes a beta-ketoacyl CoA synthase involved in biosynthesis of cuticular waxes on rice leaf[J].Planta,2008,228(4):675-685.
[34]Rezanka T,Nedbalová L,Elster J,et al.Very-long-chain iso and anteiso branched fatty acids in N-acylphosphatidylethanolamines from a natural cyanobacterial mat of Calothrix sp[J].Phytochemistry,2009,70(5):655-663.
[35]Hardy S J,Robinson B S,Ferrante A,et al.Polyenoic very-long-chain fatty acids mobilize intracellular calcium from a thapsigargin-insensitive pool in human neutrophils.The relationship between Ca2+mobilization and superoxide production induced by long-and very-long-chain fatty acids[J].Biochemical Journal,1995,311(2):689.
[36]Carvalho M S,Mendonca M A,Pinho D M M,et al.?Chromatographic analyses of fatty acid methyl esters by HPLC-UV and GC-FID[J].Journal of the Brazilian Chemical Society,2012,23(4):763-769.
[37]熊輝,陳薇,劉松梅,等.高效液相色譜與酶法檢測血清游離脂肪酸的對比分析[J].武漢大學學報(醫學版),2015,36(2):278-280.
[38]Hall N A,Lynes G W,Hjelm N M.Ratios for very-long-chain fatty acids in plasma of subjects with peroxisomal disorders,as determined by HPLC and validated by gas chromatography-mass spectrometry[J].Clinical Chemistry,1988,34(6):1041-1045.
[39]Liubin,Caidan R,Cairang L,et al.Simultaneous analysis of fatty acids in rubus niveus Thunb.Fruits by HPLC-MS/MS[J].Asian Journal of Chemistry,2013,25(4):1866-1870.
[40]Ding Y J,Zhao X E,Zhu F,et al.Identification of long-chain unsaturated fatty acids in deep-sea fish oil by liquid chromatography/mass spectrometry/atmospheric pressure chemical ionization[J].Chinese Journal of Analytical Chemistry,2007,35(3):375-381.
[41]Galea E,et al.Oxidative stress underlying axonal degeneration in adrenoleukodystrophy:a paradigm for multifactorial neurodegenerative diseases?[J].Biochimica Et Biophysica Acta,2012,1822(9):1475-1488.
[42]Matsumori R,Miyazaki T,Shimada K,et al.High levels of very long-chain saturated fatty acid in erythrocytes correlates with atherogenic lipoprotein profiles in subjects with metabolic syndrome[J].Diabetes Research & Clinical Practice,2013,99(1):12.
[43]Senanayake V K,Wei J,Mochizuki A,et al.Metabolic dysfunctions in multiple sclerosis:implications as to causation,early detection,and treatment,a case control study[J].Bmc Neurology,2015,15(1):154.
[44]Moser H W,Moser A B,Frayer K K,et al.?Adrenoleukodystrophy:increased plasma content of saturated very long chain fatty acids[J].Neurology,1981,31:1241-1249.
[45]Shi R,Zhang Y,Shi Y,et al.Inhibition of peroxisomal β-oxidation by thioridazine increases the amount of VLCFAs and Aβ generation in the rat brain[J].Neuroscience Letters,2012,528(1):6-10.
[46]GB 10765—2010.食品安全國家標準嬰幼兒配方食品[S].
[47]Dong X Y,Zhong J,Wei F,et al.Triacylglycerol composition profiling and comparison of high-oleic and normal peanut oils[J].Journal of the American Oil Chemists Society,2015,92(2):233-242.
[48]Cassagne C,Lessire R,Bessoule J J,et al.Biosynthesis of very long chain fatty acids in higher plants[J].Progress in Lipid Research,1994,33(1-2):55-69.
[49]You J,Zhao X,Suo Y,et al.Determination of long-chain fatty acids in bryophyte plants extracts by HPLC with fluorescence detection and identification with MS[J].Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2007,848(2):283-291.
[50]Li G,You J,Suo Y,et al.A developed pre-column derivatization method for the determination of free fatty acids in edible oils by reversed-phase HPLC with fluorescence detection and its application to Lycium barbarum seed oil[J].Food Chemistry,2012,125(4):1365-1372.
(責任編輯?李婷婷)

