牛初乳安全性的毒理學研究
趙金鵬 韓超 石麗麗 李巖

摘?要:目的:評價牛初乳的安全性。方法:按照《保健食品檢驗與評價技術規范(2003版)》進行急性經口毒性試驗、Ames試驗、骨髓細胞微核試驗、精子畸形試驗和大鼠30d喂養試驗等毒理學安全評價試驗。結果:牛初乳大鼠經口急性毒性試驗中MTD值>15.0g/kg·BW。小鼠骨髓微核試驗、Ames試驗、小鼠精子致畸試驗對牛初乳樣品沒有致突變的作用。大鼠30d喂養試驗各項指標也均未見明顯毒性反應:對照組和各劑量組大鼠的生長發育均未見異常,血液學、血液生化、主要臟器重量、臟器系數均在正常值范圍內,組織病理學檢查未見與受試物有關的異常改變。結論:牛初乳屬于無毒級、不會引起突變,大鼠30d喂養試驗各項指標也均未見明顯毒性反應。
關鍵詞:牛初乳;安全性評價;毒理學;30d喂養
牛初乳凍干粉是以母牛分娩3d內的初乳采用冷凍干燥工藝制成的一種具有多種保健功能的乳品,富含蛋白質及多種免疫球蛋白、生長因子、碳水化合物、維生素和礦物質等,營養成分比較均衡,并且內含多種生物活性物質和功能因子。現代藥理學和動物功能學研究表明,牛初乳凍干粉具有顯著提高免疫功能、促進生長發育、抗衰老的多種保健功能[1-3]。最近利用牛初乳研究預防CCl4化學性肝損傷取得良好的效果[4],同時發現,牛初乳凍干粉具有預防酒精肝損傷的效果[5],且對睡眠狀況具有一定的改善作用[6]。為評價牛初乳的安全性,本研究對牛初乳樣品進行了急毒試驗、遺傳毒性試驗、大鼠30d喂養試驗,為其安全應用提供科學依據。
1?材料和方法
1.1?材料
1.1.1?受試物?牛初乳,某醫藥科技有限公司提供,內容物為淡黃色至黃色粉末,人體推薦量為0.8g/d。
1.1.2?動物?KM小鼠(SPF級)、SD大鼠(SPF級),生產許可證號:SCXK(軍)2012—0004,中國人民解放軍軍事醫學科學院實驗動物中心提供。動物飼養實驗室為屏障環境,溫度20~24℃,相對濕度40 %~70 %,許可證號:SYXK(京)2014—0043。
1.1.3?主要儀器設備?血細胞自動分析儀(sysmex XT-1800i)、全自動生化分析儀(日立7080)。
1.2?方法
1.2.1?大鼠急性毒性試驗?按照最大耐受量法進行。選用SD大鼠20只,雌雄各半,體重為180~220g。受試物用蒸餾水配成濃度為0.25g/mL的溶液。以20.0mL/kg·BW量進行灌胃,1日3次,每次間隔4h,受試物給予劑量為15g/kg·BW。給予牛初乳樣品后持續觀察14d,記錄大鼠有無死亡和中毒表現。
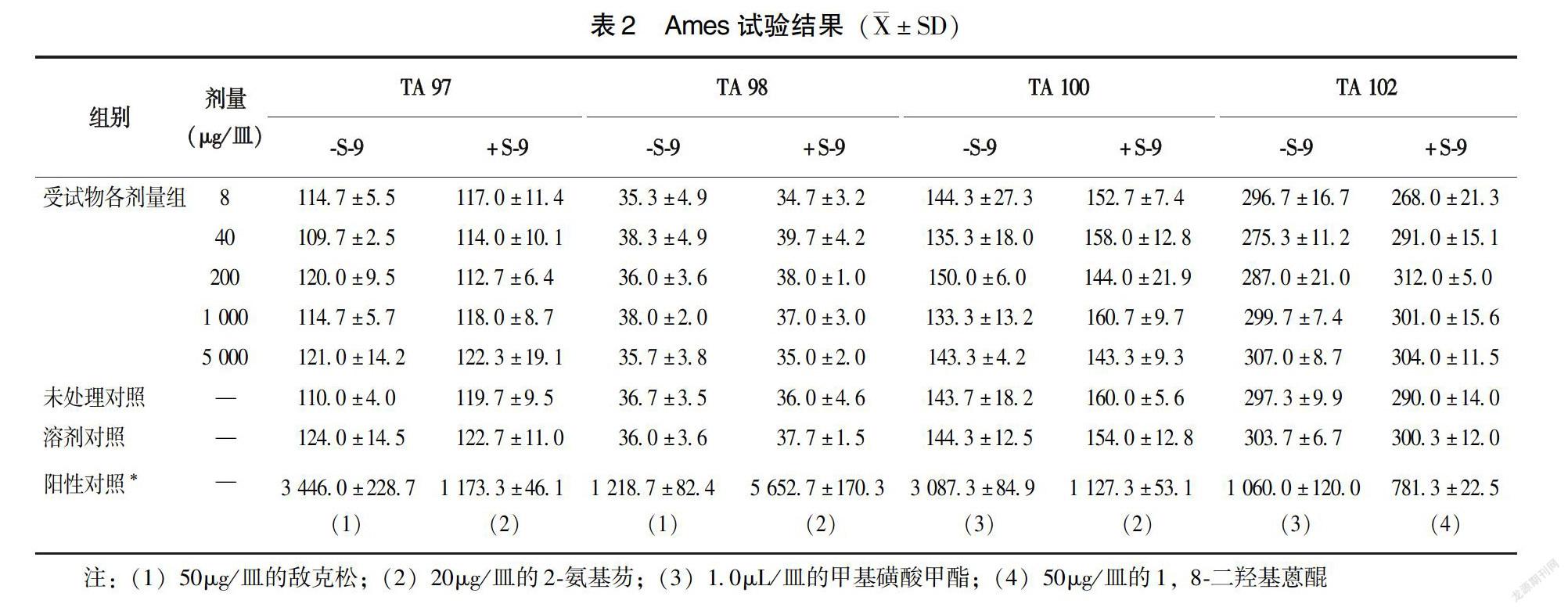
1.2.2?Ames試驗?采用標準平板摻入法。設未處理對照、溶劑對照組(蒸餾水)、陽性對照組(陽性物2-氨基芴、甲基磺酸甲酯、1,8-二羥基蒽醌,敵克松)。設5 個劑量組分別為牛初乳5 000、1 000、200、40、8μg /皿。每種菌(TA97、TA98、TA100、TA102)每個測試濃度設3 個平皿,實驗條件是加與不加S-9,并且再同樣重復1 次,計回變菌落數。如牛初乳樣品的回變菌落數大于對照組的2倍并具有劑量-反應關系,則判為牛初乳樣品遺傳毒性試驗為陽性。
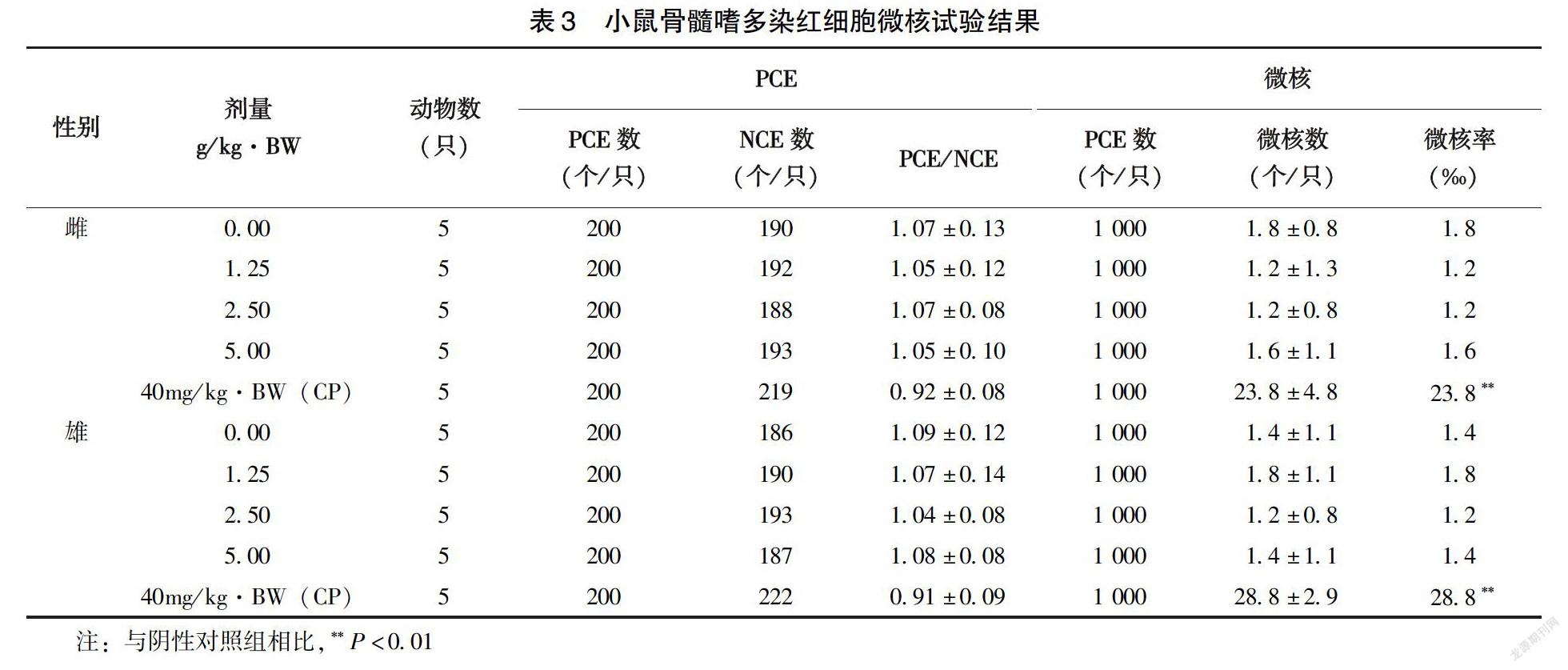
1.2.3?小鼠微核試驗?采用間隔1d 2次對小鼠進行經口灌胃法進行試驗。雌雄各25 只小鼠,體重25~30g,隨機分為5 組,實驗采用最大灌胃劑量方法一次性進行劑量設計,牛初乳樣品劑量分別為5.00、2.50、1.25g/kg·BW,另設蒸餾水為陰性對照組、環磷酰胺40mg/kg·BW為陽性對照組。按照20.0 mL /kg·BW灌胃,最后一次給樣后6h處死動物,將其胸骨骨髓取下進行制片。顯微鏡下計數每鼠1 000個骨髓嗜多染紅細胞(PCE),記錄含有微核的細胞數,統計微核發生率;每只小鼠為200 個嗜多染紅細胞,計算成熟紅細胞比值(PCE /NBC)與嗜多染紅細胞。
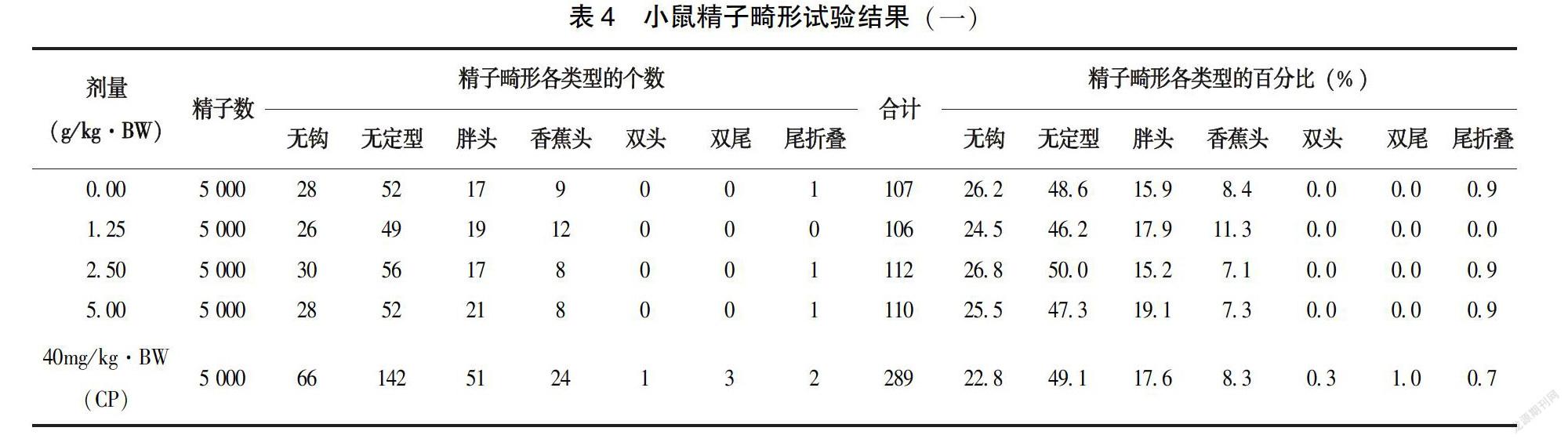
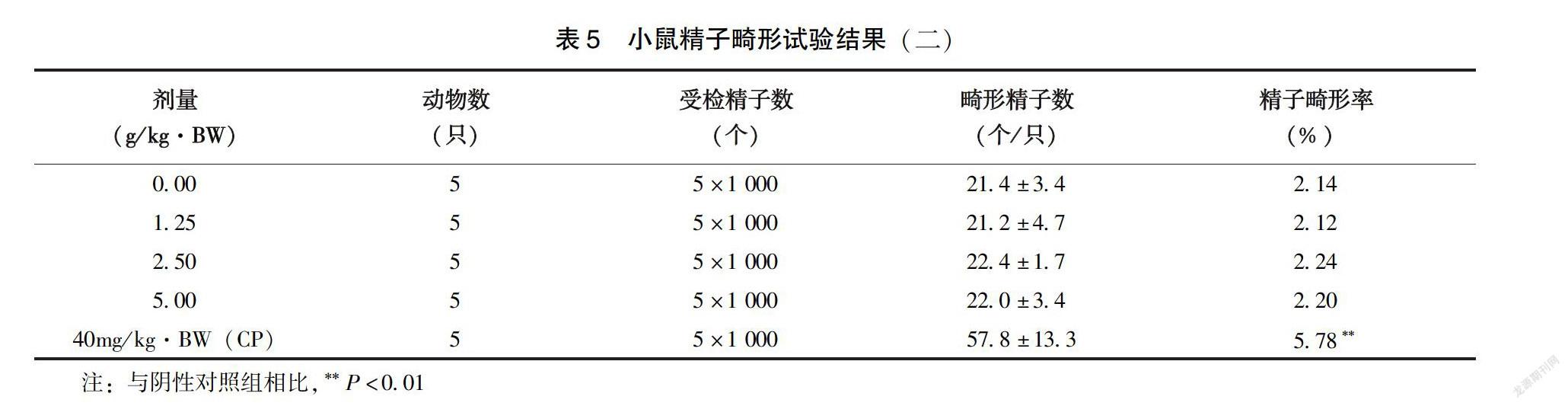
1.2.4?小鼠精子致畸試驗?雄性小鼠25只,體重為25~35g,隨機分為5 組,實驗按照一次性最大灌胃劑量方法進行劑量設計,設蒸餾水為陰性對照組、環磷酰胺40.0mg/kg·BW為陽性對照組,受試物劑量分別為5.00、2.50、1.25g/kg·BW。按照20.0mL /kg·BW進行灌胃,1次/d,連續5d。在最后一次給樣后的第30天處死小鼠,將兩側附睪取下后進行常規制片、鏡檢。對每只小鼠結構完整的1 000個精子進行計數,計算精子畸形率并記錄畸變數目。
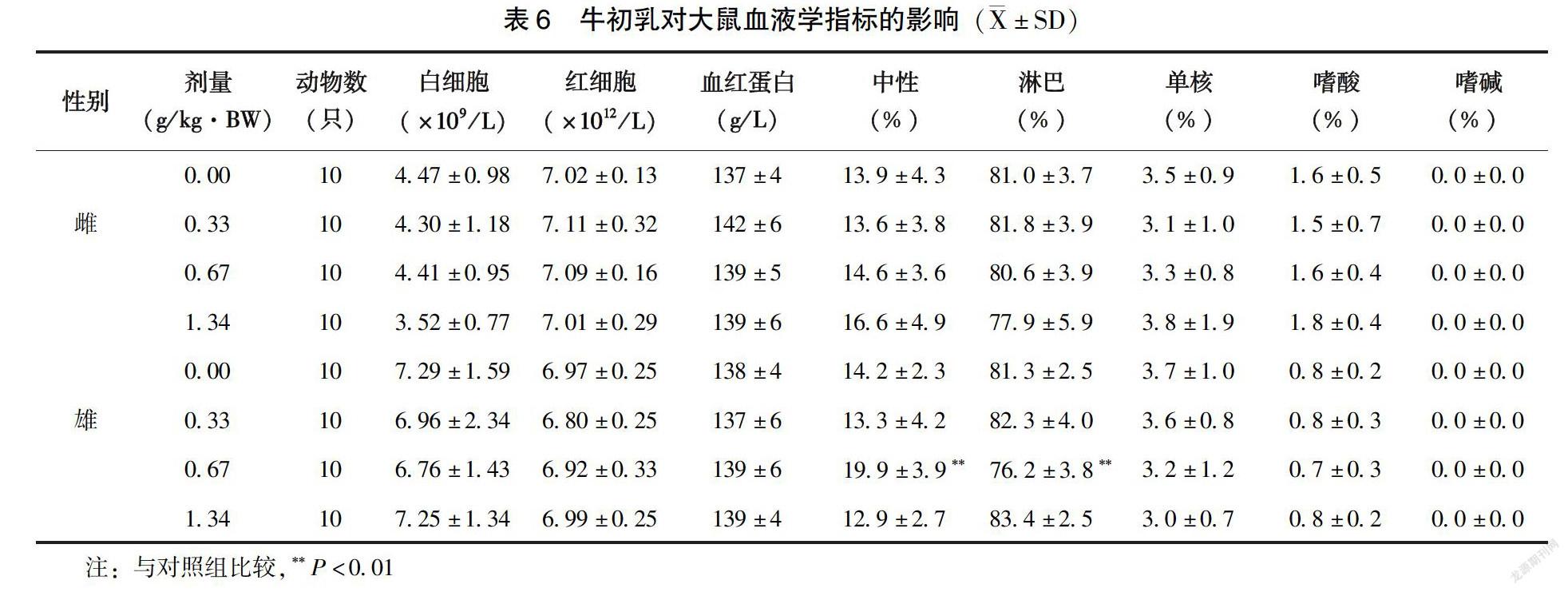
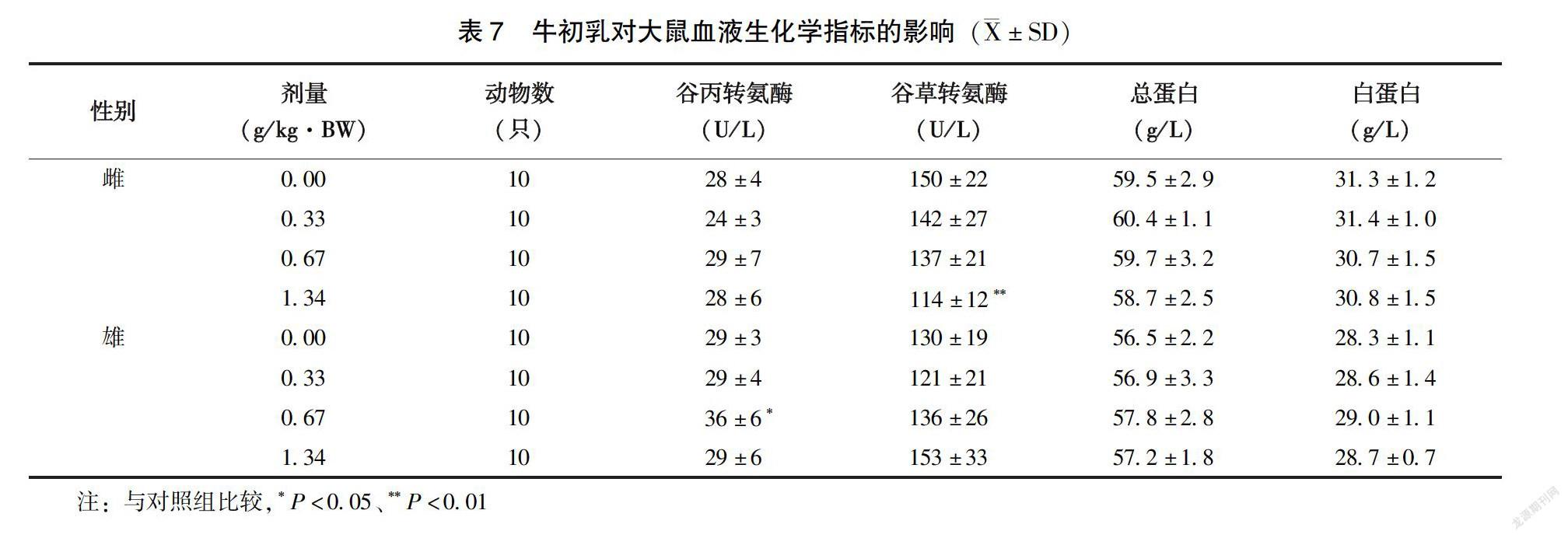
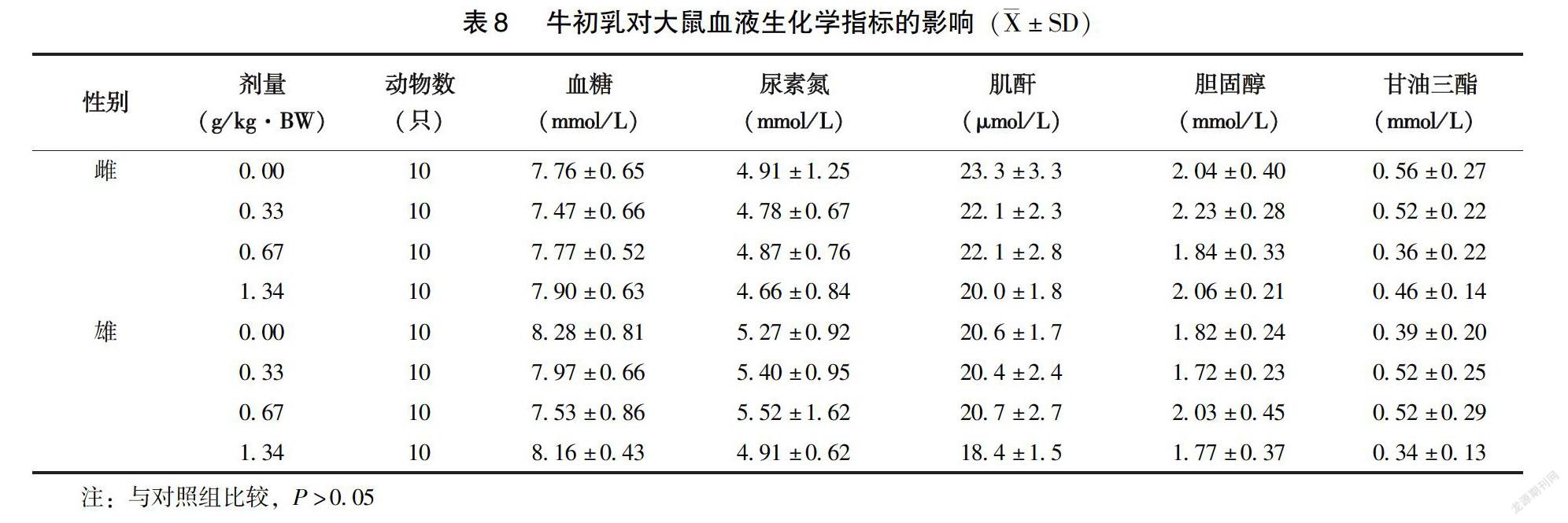
1.2.5?大鼠30d喂養試驗?斷乳SD大鼠雌雄各40只,隨機分為4組,分別為對照組(蒸餾水),牛初乳0.33、0.67、1.34g/kg·BW 組,劑量分別相當于人體推薦攝入量的25 、50 、100 倍。按照大鼠每日100g體重進食10g飼料計算,低、中、高劑量組分別將0.066、0.134、0.268kg的受試物添加至20kg鼠維持飼料中,為消除因添加受試物而導致的各組飼料蛋白質含量的差異,分別將188、142、94g純度為85%的酪蛋白添加入對照組、低劑量組和中劑量組,以使各組飼料蛋白質含量相同。大鼠自由進食、飲水。每周記錄體重、進食量并計算食物利用率。30d后麻醉腹主動脈取血檢測血液學檢查,包括血紅蛋白(HGB)含量、紅細胞(RBC)和白細胞(WBC)計數及分類、。血清分離后進行生化檢查,包括谷丙轉氨酶(ALT)、白蛋白(ALB)、尿素氮(BUN)、谷草轉氨酶(AST)、總蛋白(TP)、甘油三酯(TG)、血糖(GLU)、總膽固醇(CHO)、肌酐(CREA)含量。取每只大鼠的睪丸或卵巢、肝、腎、脾進行稱重,計算臟體比并進行臟器初步觀察,取高劑量組和對照組的卵巢睪丸、胃、肝、十二指腸、腎、脾對其進行病理學的檢查。
1.2.6?數據統計?實驗數據采用 SPSS軟件進行統計分析,采用泊松分布進行統計分析微核試驗的結果,采用χ2檢驗進行統計分析小鼠精子畸形試驗的結果,先對30d喂養試驗的數據進行方差齊性的檢驗,若各組方差性均齊,則采用單因素方差分析法進行總體比較,以α=0.05作為顯著性水平,若方差不齊則要調整變量轉換原始數據,方差齊性檢驗合格后,選用轉換后的數據進行統計;若方差齊性不能滿足,采用其他的統計方法如Brown-Forsythe檢驗或Welch檢驗等。
2?結果與分析
2.1?大鼠急性毒性試驗
大鼠在觀察期內未出現死亡情況、中毒癥狀,牛初乳急性經口大鼠試驗MTD>15.0g/kg·BW(表1),級別為無毒。
2.2?遺傳毒性試驗
2.2.1?Ames試驗?在加與不加S-9的情況下,以8、40、200、1 000、5 000μg/皿的劑量在相同試驗條件下重復做2次試驗,2次試驗中受試物對照組、高中低劑量組均無劑量-反應關系,回變菌落數未超過自發回變菌落數的2倍(表2)。因此,在S-9的加與不加時,不曾見牛初乳對鼠傷寒沙門氏菌的4株試驗菌株有致突變作用。
2.2.2?小鼠骨髓嗜多染紅細胞微核試驗?受試物高中低劑量組PCE與成熟紅細胞的比例不少于陰性對照的20%,表明牛初乳樣品在實驗劑量下無細胞毒性;♂♀陰性對照組的微核發生率明顯低于陽性對照組(P<0.01)(表3),而牛初乳樣品高中低劑量組的陰性對照組與微核率比較均無顯著性差異(P>0.05),說明該受試物不能引起小鼠的骨髓嗜多染紅細胞突變作用。
2.2.3?小鼠精子致畸試驗?受試物對照組與高中低劑量組小鼠精子畸形率陰性相比無顯著性差異(P>0.05)(表4),而陰性對照組與環磷酰胺陽性對照組相比有顯著性差異(P<0.01)(表5),說明該受試物不能對小鼠精子產生畸形的作用。
2.3?大鼠30d喂養試驗
2.3.1?動物的食物利用率、成長狀況?各組動物活動、生長正常。雌性0.33g/kg·BW劑量組大鼠第3周和第4周進食量明顯低于對照組(P<0.01),上述數據在本實驗室歷史對照范圍內,認為無生物學意義。除此之外,對照組與高中低劑量組雌雄動物體重、進食量、食物利用率相比均無顯著性差異(P>0.05)。
2.3.2?血液學指標和血液生化指標?雄性0.67g/kg·BW劑量組大鼠中性細胞百分比與對照組相比明顯升高(P<0.01)、淋巴細胞百分比與對照組相比明顯降低(P<0.01)。但在本實驗室歷史正常對照檢測范圍內,高中低劑量組間也無劑量-反應關系,認為該差異無生物學意義,其余雌、雄高中低受試物劑量組的血常規指標與對照組相比均無顯著性差異(P>0.05)(表6)。雌性1.34g/kg·BW劑量組大鼠AST明顯低于對照組(P<0.01),該指標的降低無生物學意義。雄性0.67g/kg·BW劑量組ALT明顯高于對照組(P<0.05),但在本實驗室歷史正常對照檢測范圍內,認為該差異無生物學意義。其余雌雄高中低劑量組血生化指標與對照組相比均無顯著性差異(P>0.05)(表7~8)。
2.3.3?組織病理學觀察及大體解剖?大體檢查對照組和高中低實驗計量組各臟器未見異常,對照組與高中低劑量組大鼠臟器重量和臟器系數相比無顯著性差異(P>0.05)。有個別動物在組織病理檢查中出現肝細胞灶狀樣壞死(對照組0/20例、高劑量組1/20例)、肝細胞點狀壞死(對照組1/20例、高劑量組2/20例)和腎盂擴張(對照組1/20例、高劑量組0/20例)。上述肝臟和腎臟病理學改變是動物自身常見病變,且高劑量組和與對照組無明顯差異,確定受試物與此無關。卵巢、脾、胃腸、睪丸等臟器未見明顯異常。綜上認為,牛初乳未引起有意義的病理改變。
3?討論
牛初乳內含的多種活性成分與酶類(如超氧化物歧化酶SOD)等具有抑制脂質過氧化、調節體內正常代謝功能。牛初乳在本次實驗的毒理學食物評價結果中顯示,牛初乳對♀♂大鼠急性毒性試驗中的MTD值均>15.0g/kg·BW。急性毒性分級標準中可以明確看出,牛初乳屬于無毒級。小鼠精子畸形試驗、Ames試驗、小鼠骨髓嗜多染紅細胞微核試驗均未發現牛初乳有致突變作用。以0.33、1.67、1.34g/kg·BW劑量的牛初乳摻料給予大鼠30d,各組動物生長發育良好,體重增加正常、組織病理學檢查、血生化及血液學檢查均未見與牛初乳樣品有關的異常。本實驗結果提示,保健食品牛初乳是安全的,該實驗為進一步開發應用牛初乳提供了毒理學方面的依據。
參考文獻
[1]汪岱迪,金衛紅,盂群,等.活性初乳素對受孕母鼠胎鼠生長發育的影響[J].南京師大學報(自然科學版),1997,20(1):60-64.
[2]趙巖.初乳素的免疫調節作用[J].草食家畜,2001(3):55-57.
[3]程光宇,唐梓進,吳京燕,等.活性初乳素對小鼠的抗衰老作用[J].南京師大學報(自然科學版),1996,19(3):69-72.
[4]江海濤,吳京燕,程光宇,等.初乳素預防化學性肝損傷的實驗研究[J].中國乳品工業,2005,33(5):12-14.
[5]吳京燕,潘玉英,楊云峰,等.牛初乳凍干粉對酒精性肝損傷的預防作用[J].中國比較醫學雜志,2007,17(1):33-35.
[6]江海濤,任源浩,陳勇,等.牛初乳凍干粉改善小鼠睡眠狀況的實驗研究[J].中國乳品工業,2006,34(12):29-30、45.
[7]胡居吾,陳俊杰,涂偉,等.乳鐵蛋白牛初乳顆粒的毒理安全性研究[J].安徽農業科學,2012(12):7195-7198.
[8]孫紅梅,羅蓉,李冬梅.輔酶Q10和維生素E配伍的穩定性和食用安全性研究[J]. 中國食物與營養,2016,22(6):17-20.
[9]陳雅靜.關于“食品”含義的文獻綜述 ——新《食品安全法》第150條探討[J]. 中國食物與營養,2017,23(5):17-19.
Safety Evaluation on Cow Colostrum
ZHAO Jin-peng,HAN Chao,SHI Li-li,LI Yan
(National Institute for Nutrition and Health,Chinese Center for Disease Control and Prevention,Beijing 100050,China)
Abstract:ObjectiveTo evaluate the toxicology safety of cow colostrum.MethodAcute oral toxicity test,genetic toxicity test and 30 days oral toxicity test were conducted according to technical guidlines of inspection and evaluation for health food.ResultMID of acute oral toxicity test for cow colostrum was greater than 15.0g/kg·BW.No mutation effects were induced in Ames test,bone marrow cell micronucleus test in mice,and sperm abnormality test in mice.For the 30 days oral toxicity test,the parameters including growth and development,hematology,biochemistry,main organ weight and organ weight ratio were in the range of normal value,and no abnormality related to the cow colostrum was induced in the histopathology.ConclusionNo obvious toxicity was induced in cow colostrum.
Keywords:cow colostrum;safety evaluation;toxicology;30d oral toxicity test
(責任編輯?唐建敏)

