淺談文獻研究規范化是經典名方研發的基石*
安 歡 孫舒雯 李曉寅 江凌圳
浙江省中醫藥研究院 浙江 杭州 310007
中醫藥是中華民族數千年絢麗多彩的民族文化中的一塊瑰寶,其理論體系和臨床應用至今仍在實踐中得到不斷充實和發展。目前中醫藥的發展正面臨著國際化、現代化和標準化的機遇。放眼世界,越來越多的國家把傳統醫學的發展上升到國家戰略的高度[1]。
我國作為中醫藥的發源地,在2017年6月發布的《“十三五”中醫藥科技創新專項規劃》中明確提出了加快名優中成藥的國際化注冊,促進中醫藥服務和產品進入國際醫藥和保健主流市場,打造中國標準和中國品牌,促進中醫藥走向世界的目標[2],其中最主要的任務就是推進中醫藥標準化與國際化。以此為始,2018年4月,國家中醫藥管理局會同國家藥品監督管理局公布了第一批《古代經典名方目錄》[3];2018年5月,國家藥品監督管理局發布了《古代經典名方中藥復方制劑簡化注冊審批管理規定的公告》(2018年第27號),明確了“對滿足規定要求的經典名方制劑申請上市,可僅提供藥學及非臨床安全性研究資料,免報藥效學研究及臨床試驗資料”[4]。政策規劃的重視,法律法規的保障為經典名方的開發確立了一條快車道。但中醫藥的研究有著自身固有的特點,經典名方的研發必須具備堅實的理論研究和臨床支持。
1 中醫藥經典名方發展概況
隨著國家的“一帶一路”戰略的實施,中醫藥也搭乘著中華文化傳播的東風再次廣為流傳。目前中醫藥已傳播到183個國家和地區。據世界衛生組織統計,中醫藥也已逐步進入國際醫藥體系,已在俄羅斯、古巴、越南、新加坡和阿聯酋等國以藥品形式注冊[5]。但客觀地來看,目前中藥的出口還是以粗加工的提取物出口為主,從2016年中藥類出口細分類別來看,占我國中藥出口額的85%以上,而中成藥出口額僅占6.57%,2017年有所回暖,但仍然墊底[6]。在美國市場,中成藥更加舉步維艱。到2017年為止,向美國食品藥品監督管理局遞交新藥臨床試驗(Investigational New Drug Application,IND)申請的中成藥10項(圖1),最后能否通過美國FDA標準上市還未知[7]。
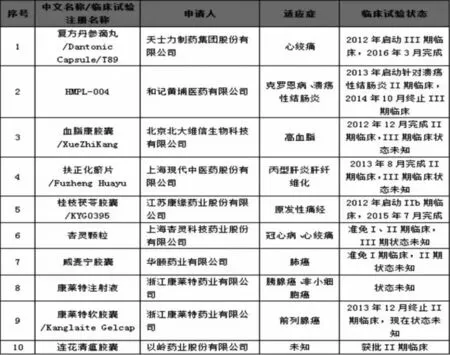
圖1 向IND申請的中成藥(至2017年)
分析中成藥國際化坎坷進程的原因,除了文化背景和理論體系的差異造成中成藥的科學內涵未被國際社會廣泛接受外,更深層次的原因還是中成藥研發、生產的規范化、標準化程度不高,無法以藥品身份獲得歐美國家市場準入并進入國際市場,只能作為保健品和食品補充劑上市。因此,建立國際化的中藥規范和標準就成為當務之急,而作為與中醫學同根同源的日本漢方醫藥學的成功之路,或許值得我們從中借鑒。
2 日本漢方藥規范化概況
日本的漢方醫學究其根本是在中國中醫學基礎上發展起來的日本傳統醫學,現今使用的漢方藥大多是東漢《傷寒論》《金匱要略》中的原方。日本高度重視中成藥產品研發的規范化和標準化,制定了嚴格的制造與品質管理標準[8-11]。精細化管理和過程化控制的理念使得漢方藥不僅獲得了良好的社會效益,也帶動了漢方藥產業的飛速發展[12]。
回顧和總結日本漢方藥發展歷程,我們不難發現日本對經典漢方開發的各個環節都進行了嚴格的規定,標準化、規范化貫穿了漢方藥研發整個流程,尤其是對于文獻和古籍的研究,更是先于漢方藥的研發。早在1974年就在東京成立了第一所漢方醫學專門研究機構——北里研究所附屬東陽醫學總會,同時通過成立古籍研究會等方式對中醫著作、傳統理論、中醫古籍和中醫古方(《傷寒論》《金匱要略》方劑)進行全面、系統、規范和科學的研究,從成分含量、用法用量、功能主治、癥名表述等方面進行規范、細致的研究,為漢方藥的開發進行指導。
可以這么說,作為漢方藥奠基石和開發基礎的《一般用漢方制劑承認基準》(1975年)正是建立在深入、堅實的文獻研究的基礎上形成的。目前日本已經建立起十多所專門的漢方醫學研究機構,44所藥科大學或醫科大學也建立了專門的生藥研究部門。
3 中醫藥經典名方文獻研究規范化思考
“他山之石,可以攻玉”,總結和分析日本漢方藥的發展歷程,我們可以看出文獻研究對于經典名方研發具有不可或缺的作用。根據世界衛生組織《2014-2023傳統醫學戰略》的統計,目前制約傳統醫學發展的最大障礙正是缺少研究數據以及缺乏對傳統醫學安全性、質量和療效研究的技術指導(如圖2、圖3)。中醫藥經典名方的研發同樣面臨著這些問題。
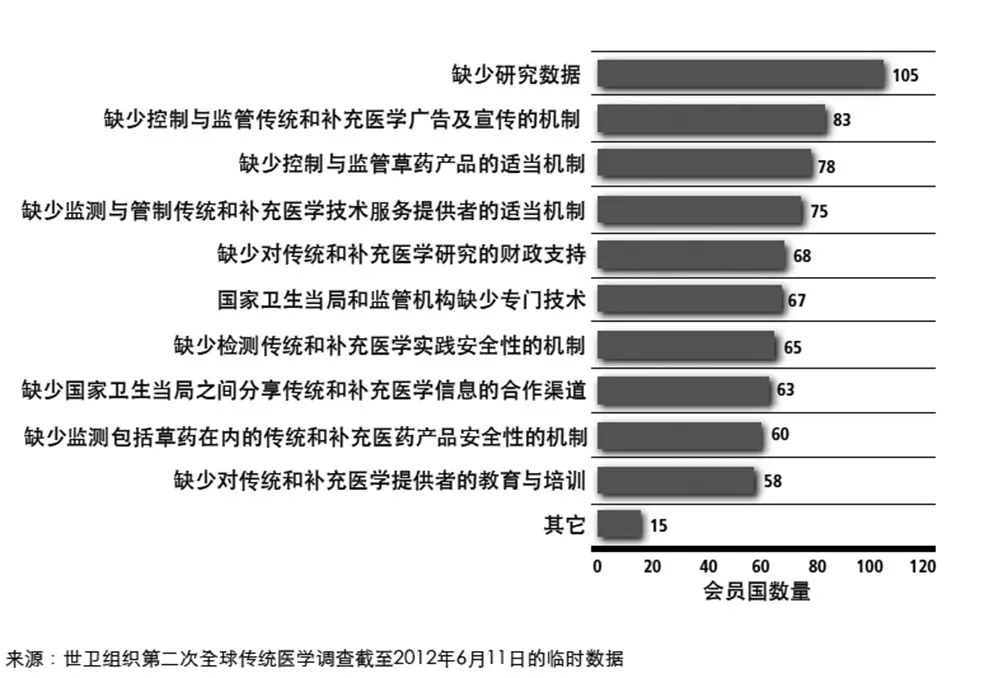
圖2 會員國在傳統和補充醫學時間相關管制問題方面面臨的問題

圖3 成員國希望世界衛生組織對傳統和補充醫學提供的支持類型
中醫藥經典名方是通過深入的文獻研究和廣泛的現代臨床應用調研后嚴格遴選的,均出自古代經典醫籍或有代表性的古醫籍,為各代醫家長期使用并沿用至今,且在現代臨床仍然廣泛應用。因此對于經典名方的開發可以按照“免臨床、免藥效”的簡化注冊流程,免于上報藥效和臨床試驗資料。這并不意味著就降低了經典名方制劑的質量和安全性整體要求,而是對于所載古籍、現代臨床應用的文獻研究提出了更高的要求。通過對古籍以及臨床應用資料等選擇、挖掘、歸納、整理、研究、考證和總結,去蕪存菁,最終形成結論性支持意見,為后續藥學研究提供強有力的支撐。文獻研究應秉持“尊古不泥古,創新不離宗”的宗旨,不應局限于從文獻到文獻的方式,而是系統地總結前人的經驗、方法和理論智慧的同時,也要敢于采納和接受現今最新的研究成果并為我所用。具體到經典名方開發的內容上,文獻研究的規范化主要體現在臨床應用、藥學研究、非臨床安全性研究三個方面。
首先臨床應用方面,要重點關注臨床價值。藥物的臨床價值需要從多角度綜合評估,而文獻研究是其基礎。系統梳理既往研究結果及臨床應用情況,從經典名方對應的優勢病種、臨床定位以及醫療和臨床需求的程度三個方面來闡述經典名方開發的臨床價值和開發意義,避免資源浪費。并且系統挖掘整理其安全性、有效性的臨床應用資料,對其臨床安全性、有效性進行歸納總結,為后續的開發研究提供保障和支持。
其次,文獻研究的規范化主要體現在以物質基準為標準的藥學研究方面。“經典名方物質基準”,是指以古代醫籍中記載的古代經典名方制備方法為依據制備而得到的中藥藥用物質的標準,除成型工藝外,其余制備方法應當與古代醫籍記載基本一致[4]。“經典名方物質基準”的執行,為經典名方的開發確立了質量屬性控制規范。通過分析和總結,在“經典名方物質基準”的研制過程中,落實到具體的文獻研究工作規范則包括:①處方來源與歷史沿革:第一批《古代經典名方目錄》已公布處方的來源,我們對其進行確認,包含著作及作者、頒布朝代或年代、原文記載的功用主治、處方藥味組成、炮制方法、劑量。并從功能主治沿革、藥味組成沿革、炮制方法沿革、劑量沿革4個方面對處方的歷史沿革進行梳理,查找歷代古籍,保證查全查準。擬定查找古籍清單,內容應涵蓋方論、本草、醫案、傷寒金匱、醫經、雜著等,厘清處方歷史演變情況。②中藥材的基原、產地確認:首先我們需要確認中藥材的品種問題,如芍藥古代有赤芍和白芍之分,需通過原書分析比較、方義內容與臨床功能主治三個方面來確定原方中的芍藥的品種。確定好品種,再對多基原的中藥材進行確認,從古代本草著作對中藥材原植物形態描述、歷代中藥材的傳統產地、現代中藥材的質量研究三個方面確認;由于歷史久遠,古代中藥材產地存在變遷情況,我們需要查找古籍梳理好中藥材產地變遷情況,并參考《中國古今地名大辭典》古今地名進行確認,明確其現今的產地,并梳理現今中藥材的主產區情況,推薦出道地性中藥材,為后期實驗研究提供理論依據。③中藥材炮制方法確認:系統梳理處方中所含中藥材的炮制方法變遷情況,通過功用主治、方義分析炮制方法異同原因,給出理論依據,確認古代中藥材的炮制方法,但是往往還不夠,經典名方的研發除了滿足“尊古”的原則以外,還需要考慮現代炮制規范情況。例如半夏,最新版藥典記載法半夏、清半夏、姜半夏,需要通過與現代炮制方法對比,結合化學成分和藥理學研究結果,最終確定最適合的炮制方法。④制備方法的一致性:包含中藥材劑量、制法、服法,它們都涉及到古代劑量單位和現代的換算問題。其中古代劑量單位分為:重量單位,如銖、兩、斤、分等;容量單位,如合、升、斗等;估量性單位,如用枚、莖、片等。經典名方的劑量換算不能僅僅局限于飲片的重量,而應該以方劑的安全為核心目的。根據現在主流學者考證到劑量換算的標準,結合歷代醫案和臨床實踐,進行對比、篩選和整理優化形成結論,并結合藥效學和安全性進一步驗證。由于古籍記載中沒有記錄煎煮時間、濃縮時間、加水量、濃縮溫度等現代制備中藥制劑需考慮的問題,所以后期實驗結合現代生產工藝制定制劑質量標準摸索。
最后,規范化的文獻研究體現在經典名方開發中的非臨床安全性研究方面。“免臨床”并不意味著對于經典名方制劑開發質量和安全的放任,相反,對安全藥理學、毒性試驗和致癌試驗等方面的文獻資料的研究、考證提出了更高和更嚴苛的要求,文獻資料與實驗資料一起,將是決定經典名方制劑開發的非臨床安全性評價的綜合性和關鍵性依據。
4 結語
中醫藥標準化是中醫藥可持續發展的前提,《中醫藥法》《中醫藥發展戰略規劃綱要(2016-2030)》等法律法規和政策中也將中醫藥標準化工作提升到了國家戰略的層面。通過完成中醫藥標準化才能真正掌握中醫藥、中成藥國際化的話語權,使中醫藥和中成藥在全球范圍內得以推廣和普及。而經典名方的研發作為中醫藥大發展趨勢下的先行者和主要抓手,則更應該以“物質基準”為手段、通過標準化進程來提升包括文獻研究、中藥新藥研發和生產等各個環節的水準。文獻研究是最基礎最重要的工作,它好比是打開經典名方開發的一把鑰匙。科學、嚴謹和規范的文獻研究能引領經典名方的開發走向正確的方向,進而從經典名方制劑的屬性和質量兩個方面進行控制,確保物質基準與中藥制劑得到整體控制。為經典方劑的開發、推廣和國際化保駕護航,從而做到將中醫藥發揚光大,造福大眾。

