富鋰錳基正極材料衰減機理及改性研究現狀
傅小蘭,李世友,2,梁有維,李春雷,2
(1.蘭州理工大學石油化工學院,蘭州 730050;2.甘肅省鋰離子電池正極材料工程實驗室,蘭州 730050)
1 引 言
鋰離子電池因其工作電壓高、儲能時間長、綠色環保等優點,已被廣泛應用于3C(計算機、通訊和消費電子產品)產品和電動汽車等領域。正極材料作為電池中鋰的提供者,直接決定著其性能的高低。隨著現代電子設備、電網和電動汽車的不斷發展,鈷酸鋰(LiCoO2)、錳酸鋰(LiMn2O4)和磷酸鐵鋰(LiFePO4)等傳統的正極材料已難以滿足電動汽車等領域對鋰離子電池高比能量(300 Wh/kg)的要求[1]。因此,探索一種具有成本低且能量密度高的新型正極材料成為當前研究的一項重要任務。
1997年,Numata等[2]首次提出了層狀LiCoO2-Li2MnO3固溶體的概念。隨后Lu等[3]成功制備得到層狀富鋰錳基正極材料xLi2MnO3·(1-x)LiMO2(0 由于富鋰錳基正極材料電化學性能的特殊性,目前對其充放電機理的研究主要集中在首次充放電過程中。其首次充電可以分為兩個階段,第一個階段為電壓小于4.5 V,曲線呈現類“S”型,鋰離子從鋰層中脫出,對應著LiMO2中Ni2+和Co3+的氧化過程;第二個階段為電壓高于4.5 V,鋰層和過渡金屬/鋰混合層共同脫出Li+,并且伴隨著O2-發生氧化反應,曲線呈類“L”型,該階段決定了首次充放電容量[9-10]。然而,此過程容量存在著較大的不可逆性,這也是材料首次庫倫效率低的重要原因。 富鋰錳基正極材料與其他正極材料電化學特性之間存在明顯的差異,這主要體現在首次充放電過程,其存在4.5 V電壓的特征平臺,且不可逆容量衰減嚴重。研究表明,富鋰錳基正極材料首次容量衰減的原因主要有:(1)Li2O的形成;(2)“Li+-H+”交換機理;(3)“氧流失”機理;(4)材料結構變化等。 4.1.1 Li2O的形成 Wang等[11]認為首次充電過程中脫出的Li+與O2-結合生成“死鋰”Li2O,電極材料中活性鋰減少,導致可逆容量下降。富鋰錳基正極材料首次充放電過程中所發生的化學反應可表示為: xLi2MnO3·(1-x)LiMO2→xLi2MnO3·(1-x)MO2+(1-x)Li++(1-x)e- xLi2MnO3·(1-x)MO2→xMnO2·(1-x)MO2+xLi2O 在充電過程中,當電壓在4.5 V以下時,Li+從LiMO2相中脫出,伴隨著過渡金屬離子發生氧化反應,當電壓達到4.5 V以上時,Li2MnO3相被激活,Li+與鋰層兩側的O2-從晶格中脫出,產生不可逆的Li2O和活性物質MnO2相,其“等效”反應方程式為[12]: Li2MnO3→MnO2+ 1/2O2+ 2Li++2e- 由于充電過程中Li2O的生成,導致過渡金屬遷移并占據Li+空位,使得脫出的Li+無法回到體相晶格中,導致首次不可逆容量發生衰減。 4.1.2 “Li+-H+”交換機理 1991年,Rossouw等[13]在首次充電過程中檢測到材料結構中存在H+,從而提出了“Li+-H+”交換機理。即在高電壓下,鋰離子電池體系中電解液發生氧化分解產生H+,H+與Li+發生交換,由于鍵能的改變造成材料結構的變化,降低了其晶體結構的穩定性和離子脫出/嵌入能力,形成不可逆容量。其相關反應方程式如下: Li[Li1/3Mn2/3]O2+H+→Li++H[Li1/3Mn2/3]O2 Armstrong等[14]研究表明,在室溫下,“Li+-H+”和Li2O的產生共存,并且Li2O脫出反應占主導地位。高溫下,“Li+-H+”交換程度增加,這主要是由于高溫下電解液氧化分解加劇,有助于“Li+-H+”交換的進行。 4.1.3 “氧流失”機理 “氧流失”機理認為首次循環中的O2-轉化為氧氣并釋放,導致TM-O的結合能減弱,陽離子混排增加,從而引起材料內部結構發生相轉變,其主要發生如下化學反應[15-16]: Li2-xMnO3(s)→Li2-xMnO3-y(s)+yO2(g) 2O2-(lattice)→O2(gas)+4e- 2O2-(lattice)→O22-(lattice)+2e- Li2MnO3→2Li++ Mn4+O34-+2e- 2Mn4+O34-→2MnO2+O2 Luo等[17]通過同位素O18標記Li1.2[Ni0.132+Co0.133+Mn0.544+]O2中的氧,研究發現材料首次充電過程中,在4.5 V平臺以上會有CO2和O2產生,并且氧氣中的氧來自于晶格中,CO2中的氧大部分來源于晶格中,小部分是由電解液分解產生。晶格中氧的脫出造成結構發生變化;材料表面生成鹽巖相,孔隙率增加,顆粒內部出現裂紋,導致材料與導電劑和粘結劑的接觸能力降低,電化學性能下降。李寧等[5]使用異位氣相色譜-質譜聯用儀測試發現首次充放電過程只生成CO2,無O2生成。由此可見,對于“氧流失”機理還未形成統一定論,仍需對其進行進一步深入研究。 4.1.4 材料結構變化 在首次充電過程中,伴隨著Li2MnO3組分中Li+的脫出,Mn從過渡金屬層遷移至鋰層,且生成活性物質MnO2,Mn4+被還原成Mn3+而引起Jahn-Teller效應,導致材料結構穩定性下降[18],同時在脫鋰狀態下,氧空位的形成加速了過渡金屬離子的遷移,導致晶體結構缺陷產生,使材料從層狀向尖晶石相轉變,對電化學性能造成極大的影響[19]。Iddir等[20]通過第一性原理表明在首次充電過程中晶格內原子發生遷移,造成陽離子重排和材料結構相變,從而導致電池性能下降。 4.2.1 材料晶體結構的變化 富鋰錳基正極材料中,由于Li+(0.072 nm)與Ni2+(0.069 nm)半徑相近,充電過程中隨著Li+脫出后形成鋰空位,相鄰氧層之間產生斥力,使得Ni2+遷移至鋰空位,引起Li+/Ni2+混排[21-23],鋰層中TM-O較強,會削弱相鄰過渡金屬層間的靜電排斥力,造成陽離子混排程度增加,不利于材料的結構穩定性。Gao等[24]采用第一性原理解釋了氧空位和鋰空位與Mn遷移,Mn遷移與Mn-O及MnO6八面體的形成與畸變的原理,研究表明隨著TM離子的溶出,TM與氧的結合能力減弱,其由八面體(TM)遷移至四面體(Li)再到八面體(Li),使得更少的氧參與氧化還原反應導致容量下降。Mn遷移可能導致如下兩個反應發生: 2Mn4++2O2-→2Mn3++O22- Mn4++2O2-→Mn2++O22- 在八面體位點的Mn3+會導致材料由層狀向尖晶石相的轉變,尖晶石相的形成會影響Li+的擴散,最終導致電池容量和電壓衰減。 4.2.2 活性物質的變化 富鋰錳基正極材料活性物質結構的變化主要發生在表面,其厚度由循環次數、環境溫度和充放電程度等因素所決定。活性物質的變化,一方面會使材料表面過渡金屬離子發生溶解,材料的晶體結構遭到破壞;另一方面會直接導致電池循環性能的降低。Yan等[25]發現在循環過程中Ni和Mn發生表面重構(SRL),Ni從材料晶體結構中遷移至表面并優先溶解在電解液中,結構中的Ni逐漸被消耗,導致材料容量衰減嚴重。并且,Ni含量的降低會使表面材料Mn-Ni相互作用力減弱,逐漸形成尖晶石相,使得Li+遷移受阻,電壓和容量嚴重衰減。在放電過程中,Mn3+會發生歧化反應:2Mn3+→Mn4++Mn2+,其中Mn2+部分溶解于電解液中最后沉積到SEI膜表面,另一部分Mn2+容易占據四面體位點,使得材料中活性物質的含量減少,造成容量衰減[26]。 4.2.3 非活性物質的產生 富鋰錳基正極材料中,低價非活性鎳離子的產生是造成其在循環過程中容量嚴重衰減的原因之一。另外,材料表面的Li2O會與電池體系中分解產生的CO2反應生成Li2CO3[27]。Li2CO3為SEI膜的組成成分,過多的Li2CO3導致膜厚度增加,阻礙Li+的擴散,不均勻的SEI膜會造成電極表面的活性物質進一步溶解,導致材料的容量衰減和結構穩定性下降。 4.2.4 界面膜的產生 在鋰離子脫出/嵌入過程中,由于電解液和電極材料中活性物質的界面反應,材料表面逐漸產生一層固體電解質相界面(SEI)膜,其成分主要包含LiF、LixPFy、LixPOyFz和ROCO2Li等[28-29]。SEI膜的生成會消耗活性Li+,同時溶解于電解液中的過渡金屬離子會與SEI膜表面的活性物質反應,導致材料活性物質減少。循環過程中,膜厚度和阻抗逐漸增加,使得Li+遷移勢壘增大,造成不可逆容量產生。 4.2.5 過渡金屬元素價態的降低 鋰離子從富鋰錳基正極材料中脫出和嵌入時,由于過渡金屬元素的價態下降而造成材料晶體結構穩定性降低,最終導致電壓不斷衰減,影響電池的能量密度。Hu等[30]通過研究發現富鋰錳基材料中氧氣的釋放導致過渡金屬離子的平均價態不斷降低,循環過程中Mn、Co元素參與電荷補償價態降低導致電壓衰減。Shimoda等[18]認為鋰缺陷導致Mn由過渡金屬層遷移至鋰層,形成的尖晶石相中存在更多的氧空位,通過掃描透射電鏡(STEM)和電子能量損失譜(EELS)測試表明,多次循環后產生Mn2O3和MnO等物質,Mn元素價態降低,導致容量和電壓衰減。 4.2.6 其他因素 Zuo等[31]通過比較不同粒徑的富鋰錳基材料的電化學性能,提出粒子半徑對電壓衰減具有一定影響,即粒徑越大時材料的機械性能越差,進而影響材料的電化學性能。此外,材料表面孔隙,微裂紋等缺陷也都會導致富鋰錳基正極材料電化學性能衰減。 過渡金屬離子遷移、溶解,元素價態降低和氧流失等因素是造成富鋰錳基正極材料電化學性能降低的重要原因。為解決上述缺陷,目前富鋰錳基材料改性方法研究的主要方向有:元素比例的調節,結構調整,表面修飾和體相離子摻雜等。 在脫鋰過程中,由于過渡金屬會發生從八面體(TM)到四面體(Li)再到八面體(Li)的遷移。因此,對于富鋰錳基層狀氧化物,增加Ni含量,一定程度的陽離子混排可以在脫鋰過程中起到支撐鋰層,減少相鄰層氧的排斥力的作用。Ni4+/Ni3+的氧化還原反應使得Mn的平均價態保持在3.5以上,從而降低活性Mn3+的Jahn-Teller效應,提高結構的穩定性。Zhang等[10]通過研究富鋰Li[Li0.2Ni0.13Co0.13Mn0.54]O2-xLiNiO2表明,在循環過程中Ni2+占據Li+空位使得相鄰位置的氧流失減少,阻礙過渡金屬向Li+空位遷移。通過減少Mn3+的產生,抑制Jahn-Teller效應和錳離子的不可逆遷移,這使得晶格體系中LixM2O4尖晶石相的形成減少。鎳偏析在表面生成尖晶石相可以抑制晶格體系中尖晶石相的形成,同時可以阻礙材料表面與電解液的直接接觸。當鎳含量增加時,富鋰錳基正極材料中LiMO2相增加,Li2MnO3相減少,使得4.5 V平臺縮短,4.45~4.8 V范圍內充電容量減少,不可逆容量減少,首次庫倫效率得以改善。Shi等[32]報道了高鎳0.5Li2MnO3·0.5LiNi0.8Co0.1Mn0.1O2材料中活性鎳起著穩定劑的作用,改善了材料的循環穩定性。TM在脫出/嵌入過程中通過中間四面體位點從過渡金屬層的八面體位置遷移到鋰層的八面體位置時,容易嵌入在四面體位置。然而,Ni2+離子半徑較大很難被嵌入在四面體(Li)位置,從而抑制材料發生相變以減輕電壓衰減。Penki等[33]通過比較LRNCM622與LRNCM424的電化學性能發現,LRNCM424具有較高的比容量,但長循環時LRNCM622具有更加優異的電化學性能。可見,增加鎳含量在一定程度上可以抑制電化學性能降低,但還有待更加深入的研究。 5.3.1 構造表面氧空位 由第一性原理可知,當材料表面含有氧空位時,在脫鋰過程中,更容易發生O2-/O的氧化還原反應,晶格中氧的脫出可以通過構造表面氧空位得以抑制。Qiu等[37]通過氣-固界面反應,利用NH4HCO3產生CO2,在材料表面構造表面氧空位,減少鋰離子脫出/嵌入過程中O2的生成,提高晶格中O2-的活性,改性后的材料首次庫倫效率達到93.2%,100次循環后容量和電壓沒有明顯衰減。Ji等[38]通過超臨界CO2與富鋰錳基正極材料反應預激活Li2MnO3相,使得材料表面Mn3+和可逆氧含量增加,在不改變材料晶體結構的情況下,其首次庫倫效率得以提升。Zheng等[39]報道了通過不同的熱處理方法在富鋰錳基氧化物中引入氧空位,材料的可逆容量和倍率性能得到了顯著提升。 5.3.2 表面摻雜 通過表面摻雜可以使材料表面氧失活,避免與氧空位產生密切相關的過渡金屬離子發生遷移,抑制了材料由層狀向尖晶石結構轉變,使電化學穩定性得以提高。Liu等[40]通過Nb5+對Li1.2Mn0.54Co0.13Ni0.13O2表面摻雜改性,采用DFT計算得到摻雜的Nb5+位于氧化物表面附近的鋰層中,Nb-O可以抑制TM-O的變化和TMO6的畸變,并且,Nb5+表面摻雜使得表面氧失活,有利于抑制材料中陽離子混排,提高材料的結構穩定性,經摻雜后材料首次放電比容量達到320 mAh/g,100次循環后容量保持率為94.5%。 5.3.3 表面包覆 表面包覆在一定程度上可以使材料與電解液直接接觸得到有效避免,進而降低副反應的發生,減少活性物質損失,使材料結構轉變得以抑制,從而提高電化學性能。目前常見的包覆材料有ZnO、TiO、MoO2等。Xiao等[41]通過原子沉積(ALD)法在Li1.2Mn0.54Co0.13Ni0.13O2表面包覆一層AlPO4,ALD包覆AlPO4使部分Li2MnO3相轉變為類尖晶石相,有效的抑制了首次循環過程中氧氣的釋放,提高了首次庫倫效率和結構穩定性,與Al2O3包覆層相比,AlPO4在提高正極材料熱穩定性方面也更加有效。Mu等[42]采用WO3包覆Li1.2Ni0.2Mn0.6O2材料,由于WO3包覆層對Li2MnO3相的首次活化具有抑制作用,可以有效改善富鋰錳基材料表面結構的穩定性。并且包覆層避免了材料表面被HF腐蝕和其他副反應發生,降低SEI膜的厚度。此外,WO3還能提供額外的鋰離子嵌入位點,有利于Li+的遷移。Zhang[43]等通過Al2O3/SiO2對Li1.2Mn0.54Ni0.13Co0.13O2進行包覆改性,經過退火處理后形成鋰缺陷無序尖晶石中間層和含有Lix[AlySizO4]等物質的多層膜包覆層,其可以避免電解液的腐蝕和反應產物的沉積,改善鋰離子的遷移速率,抑制層狀結構向尖晶石結構的轉變,材料的首次庫侖效率、容量保持率、循環穩定性、倍率性能和電壓衰減均得到了明顯的改善。 離子摻雜可以增強陽離子與非金屬離子的結合能力,有效的抑制氧氣的釋放,減少過渡金屬的遷移和相變的發生,從而提高晶體結構的穩定性。目前已有的摻雜改性包括陽離子摻雜(Zr3+、Al3+、Cr3+等)、陰離子摻雜(PO43-、BO33-、SiO44-等)和陰陽離子共摻雜等。Xie等[44]通過Gd3+摻雜對Li1.2Mn0.54Co0.13Ni0.13O2改性,Gd3+抑制了陽離子混排,降低了Mn3+在八面體位置所引起的Jahn-Teller效應,使材料的結構穩定性得以提升,同時,Gd3+摻雜可以降低電解液與材料發生反應所形成SEI膜厚度,降低阻抗,使材料電化學性能得以提升。Ma等[45]通過BO33-摻雜提高Li1.16(Ni0.25Mn0.75)(0.84)O2材料電化學性能,BO33-摻雜可以減少首次循環過程中Li2O從Li2MnO3相中脫出,減少了材料表面鋰空位和無定型相的產生,改善了材料的結構穩定性,當BO33-摻雜量為3%時,0.5 C下,300次循環容量保持率為93.7%。Lei等[46]通過以Nb5+和F-分別取代Mn4+和O2-實現共摻雜,制備得到Li1.2Mn0.54-xNbxCo0.13Ni0.13O2-6xF6x,研究表明,Nb摻雜可以增強過渡金屬與氧的結合力,有效抑制過渡金屬離子遷移、溶解和O2-從晶格中脫出,保持晶體結構穩定性;強電負性的F-取代O2-有利于抑制首次充電過程中由于氧流失而引起的結構變化,提升材料的首次庫倫效率,并且,Nb和F共摻雜能夠提高鋰離子和電子的傳輸速率。 在近期的一些研究中,Ye等[47]通過使用新型添加劑APTS,利用電解液分解生成的有害HF酸構建富含F的界面保護膜,其可以有效阻止材料與電解液直接接觸而發生副反應和表面結構的相變,使材料循環穩定性得以提升。Kaewmala等[48]通過研究不同制備方法合成不同大小顆粒來抑制材料從層狀向尖晶石的轉變。除了以上的改性方法,對材料晶面進行調控可以增強Li+擴散速率,通過制備分級結構的材料可以提高正極材料電化學性能。此外,也有研究者通過對粘合劑、集流體等進行研究以改性富鋰錳基正極材料。 綜上所述,作為最具發展前景的高能量密度電池正極材料之一,富鋰錳基正極材料得到了廣泛關注。然而,其電化學性能衰減阻礙了其實際商業應用。目前,人們對富鋰錳基正極材料的衰減機理,改性方法等方面均進行了深入的研究。已報道的富鋰錳基正極材料衰減原因主要包括:(1)首次不可逆容量衰減,其主要由Li2O的形成、“Li+-H+”交換機理、“氧流失”機理、材料結構變化等因素造成;(2)循環過程中性能衰減,其主要由材料結構的相變、活性物質的變化、非活性物質的產生和界面膜的生成等因素引起。目前有效的改進方法主要包括元素比例調整、材料結構調整、表面修飾和離子體相摻雜等。然而,富鋰錳基正極材料還存在諸多問題亟待解決。今后,對于富鋰錳基正極材料的研究可從以下幾方面著手:(1)進一步探究富鋰錳基正極材料結構組成和衰減機理,明確各種因素對材料衰減造成的影響,并尋找到合適的抑制方法;(2)合成無鈷富鋰錳基正極材料,降低成本,減少污染;(3)開發適配于富鋰錳基正極材料的新型電解液體系,提高電池的綜合電化學性能,這對實現富鋰錳基正極材料的發展和商業化應用具有重要意義。2 晶體結構
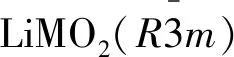
3 充放電機理
4 衰減機理研究
4.1 首次不可逆容量衰減機理
4.2 循環過程中衰減機理
5 改性方法研究
5.1 元素比例調節
5.2 結構調整

5.3 表面修飾
5.4 體相離子摻雜
5.5 其他改性方法
6 結語與展望

