尼羅羅非魚MyD88基因的表達及多克隆抗體制備
張永德,林 勇,潘傳燕,馮鵬霏,陳曉漢,羅洪林
( 廣西水產科學研究院,廣西水產遺傳育種與健康養殖重點實驗室,廣西 南寧 530021 )
與多數脊椎動物一樣,硬骨魚也具有先天性免疫和獲得性免疫系統,以消除入侵的病原體,先天性免疫被認為是對抗病原體的主要組成部分[1]。先天性免疫反應是由生殖細胞編碼的模式識別受體(PRRs)通過識別外來刺激的保守病原體相關分子模式(PAMPs)來啟動宿主免疫反應的,如細菌細胞壁的脂多糖或肽聚糖、真菌的β-1,3-葡聚糖細胞壁、病毒的雙鏈RNA以及受損細胞釋放的內源性分子等[2-3]。在已知的模式識別受體中,Toll樣受體(TLR)在識別微生物病原體相關分子模式中起關鍵作用,并觸發下游信號級聯,激活參與調節免疫相關基因表達的轉錄因子,包括促炎細胞因子[4]。Toll樣受體的細胞內Toll/IL-1受體(TIR)結構域將通過Toll/IL-1受體二聚化結合多個下游信號配體并激活核因子κB(NF-κB)[3]。在這些配體中,髓樣分化因子(MyD88)蛋白是除TLR3外介導大多數TLR活化的關鍵和保守的信號蛋白之一[5]。
MyD88蛋白是哺乳動物和魚類TLRs信號轉導途徑的關鍵因子,在脊椎動物和無脊椎動物中具有共同的結構特征,包括具有短接頭區的N-端死亡結構域(DD)和C-端TIR結構域[4]。其C-端TIR結構域能夠與TLR相互作用,而N-端DD結構域能夠與IL-1受體相關激酶4(IRAK4)相互作用,IRAK4又反過來募集IRAK1或IRAK2形成Myddosome信號復合物,激活NF-κB和絲裂原活化蛋白激酶(MAPK)信號的傳導[6-7]。目前,已在許多無脊椎動物和脊椎動物中克隆鑒定了MyD88基因,包括哺乳動物[8-9]、禽類[10-11]、兩棲動物[12]、爬行動物[13]、魚類[14-17],以及一些無脊椎動物[18-21]。MyD88蛋白作為配體蛋白在先天性免疫中的潛在作用已在模式動物中得到證明。如MyD88基因敲除小鼠易受病毒和細菌感染[22-24]。MyD88基因突變體斑馬魚(Daniorerio)更容易受到遲鈍愛德華氏菌(Edwardsiellatarda)和鼠傷寒沙門氏菌(Salmonellatyphimurium)的感染[25]。
羅非魚(Oreochromis)是我國的主導水產養殖品種,然而近些年,羅非魚養殖時常受疾病的困擾,尤其是鏈球菌病已成為威脅羅非魚產業發展的一個主要問題[26-27]。疾病在危害羅非魚養殖的同時,也加重了藥物的濫用[28-29]。因此,了解宿主與病原的相互作用,以及羅非魚的免疫反應機制等對于開發有效治療、預防措施及減少藥物的使用至關重要。然而,羅非魚免疫相關研究仍然較薄弱,其抗細菌侵襲的免疫機制尚未完全明確。目前對于羅非魚免疫相關因子及其在免疫信號通路中的作用研究尚處起步階段。本研究對尼羅羅非魚(O.niloticus)MyD88基因進行原核表達,通過免疫大耳兔制備抗羅非魚MyD88蛋白特異性抗體,為深入研究羅非魚MyD88蛋白的功能、TLR信號通路及先天性免疫系統的分子機制提供了基礎材料。
1 材料與方法
1.1 材料
重組質粒pET-B2m(由pET-28a改造而來)、表達宿主B21(武漢金開瑞生物公司);DNA聚合酶、蛋白marker、限制性內切酶BamHⅠ和SalⅠ(美國Fermentas公司);In-Fusion? HD Cloning Kit(Clontech公司);DNA回收試劑盒、質粒提取試劑盒(天根生物技術公司);異丙基-β-D-硫代半乳糖苷(IPTG)(Merck公司);弗式完全佐劑、弗氏不完全佐劑(美國Sigma公司);聚偏氟乙稀膜(PVDF)(ThermoFisher公司);羊抗兔-HRP抗體(美國Jackson公司);親和層析柱料(美國GE Healthcare公司)。
1.2 方法
采用DNAstar軟件對MyD88蛋白的抗原指數和細胞表位等進行預測分析,采用在線分析工具ExPASy中的ProtScale(https:∥web.expasy.org/protscale/)預測MyD88蛋白質疏水性,TMHMM server v.2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/)對MyD88蛋白序列進行跨膜區預測。
1.2.2 目的基因的擴增
根據尼羅羅非魚MyD88基因序列(美國國立生物技術信息中心登錄號:KJ130039),利用Primer Premier 5.0軟件設計MyD88基因PCR引物,上下游引物序列分別為P1:5′-TCCACTGGGTTCTCGGACTATGGCATGTGCAGATAGC-3′,P2:5′-TAAGGCCGCACTCGAGCACCACCGGCAGGCT CAGGGCTTTT-3′。合成尼羅羅非魚MyD88基因序列,以此為模板進行PCR反應,100 μL反應體系包括:TaqDNA聚合酶(5 U/μL) 1.0 μL,10×Taq Buffer 10.0 μL,dNTP(10 mmol/L) 2.0 μL,上下游引物(10 μmol/L)各5.0 μL,模板DNA 2.0 μL。PCR擴增程序為:94 ℃預變性4 min;94 ℃變性45 s,52 ℃復性45 s,72 ℃延伸45 s,28個循環;最后72 ℃延伸10 min。PCR產物經1.2%瓊脂糖凝膠電泳檢測并切膠回收。
1.2.3 原核表達質粒的構建
將載體pET-B2m采用SalⅠ與BamHⅠ雙酶切處理,然后采用同源重組的方法將目的片段與載體連接,構建重組質粒pET-B2m-MyD88,轉入大腸桿菌(Escherichiacoli)B21;篩選陽性克隆,提取質粒進行PCR擴增,1.2%瓊脂糖凝膠電泳檢測,并送生工生物工程(上海)股份有限公司測序。序列采用DNAstar MegAlign軟件包進行比對分析,以確定基因正確插入載體。
1.2.4 目的基因的小量表達
將測序鑒定正確的重組質粒轉入表達菌B21,取30 μL過夜培養的菌液接入3.0 mL LB培養基中,37 ℃振蕩培養至600 nm吸光度為0.6,其余培養液添加甘油置于-80 ℃,作為菌種備用。取部分菌液作為對照組,剩余菌液加入IPTG誘導劑至終濃度0.5 mmol/L,兩組菌液繼續37 ℃振蕩培養3 h;然后取菌體1 mL,10 000 r/min離心30 s,收獲沉淀,用100 μL 1% SDS重懸,混勻,100 ℃處理10 min。最后10 000 r/min離心10 min,取上清液進行SDS-PAGE檢測分析。
再各稱取5 g未經過改性處理的絲瓜絡纖維分別加入4個250 mL磨口燒瓶中,分別加入50 mL 0.5 mol/L 的 K2Cr2O7、 CoSO4、 KMnO4、 CuSO4溶液,浸泡1.5 h后,再放在轉速為200 r/min的磁力攪拌器上,攪拌0.5 h后,取出溶液,轉移到燒杯中,供比色用。
1.2.5 蛋白表達與破菌檢測
取保存的菌種20 μL轉接入20 mL液體LB培養基,過夜培養后取2 mL菌液加入含2000 mL的LB培養基中,37 ℃振蕩培養至600 nm吸光度約0.6,降低溫度至30 ℃;加入IPTG誘導劑至終濃度0.5 mmol/L,30 ℃繼續振蕩培養3 h。收集發酵液,7300 r/min離心10 min收集菌體。將菌體懸浮于40 mL預冷的NTA-0緩沖液中,冰浴超聲波破碎細菌,13 000 r/min、4 ℃離心30 min,收集上清液以及沉淀。取少量樣品進行SDS-PAGE檢測。
1.2.6 包涵體蛋白的純化
將收集的沉淀加入Ni-NTA樹脂層析柱中,流速控制為0.5 mL/min,收集穿柱液體。以10倍柱床體積的NTA-0 Buffer沖洗,然后分別用10倍柱床體積的NTA-20、NTA-60、NTA-200、NTA-500緩沖液洗脫,收集各洗脫峰,取少量洗脫液進行SDS-PAGE電泳檢測。純度達到要求的組分,置于透析袋中,4 ℃以1×PBS透析,最后4 ℃超濾濃縮透析產物。
1.2.7 多克隆抗體的制備和鑒定
將純化的重組蛋白與等容積弗氏完全佐劑乳化后,以500 μg/只的劑量免疫2只日本大耳兔,皮下多點注射。每只兔子免疫5~6次,每次免疫間隔14 d,并檢測免疫效價,待抗體表達恒定后,采血分離血清,于-20 ℃冰箱保存備用。
1.2.8 免疫效價的ELISA檢測
以重組MyD88蛋白作為抗原(2 μg/mL),按100 μL/孔加入苯丙乙烯到96孔反應板中進行抗原包被,4 ℃過夜;用PBST洗液洗3次,2%卵清蛋白于室溫封閉0.5 h,再洗滌3次后,將待檢血清按1∶2000、1∶4000、1∶8000作二倍梯度稀釋至1∶8 192 000,然后各取100 μL加入96孔板,以空白血清作為陰性對照。37 ℃溫育1 h后,PBST洗滌3次,加入HRP標記的羊抗兔IgG(1∶5000)溶液100 μL/孔,37 ℃溫育45 min,PBST洗滌5次;每孔加入TMB顯色液100 μL顯色20 min,最后加入50 μL H2SO4終止反應液,以酶標儀測定450 nm的吸光值。陽性反應的最大稀釋度為待測樣品的效價。
1.2.9 Western blot檢測
將純化的重組蛋白分別取25 ng和10 ng經SDS-PAGE電泳后,200 mA濕法轉PVDF膜60 min,將膜用PBST洗3次,每次5 min,然后浸沒于封閉液中37 ℃封閉2 h。加入兔抗血清(稀釋度體積比為1∶1000),于搖床37 ℃孵育1 h,PBST洗滌3次,每次5 min。然后加入羊抗兔-HRP二抗(1∶10 000倍體積稀釋),37 ℃孵育1 h,取等體積的ECL試劑A液、B液混合滴于膜正面,于暗室反應2 min,取出膠片立即浸入顯影液中顯色1 min,浸入定影液中定影1 min,晾干,標定Marker后,拍照分析MyD88蛋白抗血清的特異性。
1.2.10 抗體純化
采用Protein G親和層析柱進行抗體純化。將收集的抗血清與等體積2×PBS緩沖液混合后上樣,用10倍柱體積以上的PBS洗滌,至流出液無蛋白檢出,加入2倍柱體積0.1 mol/L檸檬酸(pH2.7)洗脫,收集洗脫產物,測定280 nm吸光度估算抗體濃度;采用1 mol/L Tris調節洗脫產物pH至中性,用10 ku超濾管將樣品濃縮至所需體積,純化濃縮后的抗體經稀釋后,SDS-PAGE電泳檢測,-20 ℃保存備用。
2 結果與分析
2.1 MyD88蛋白疏水性及跨膜區分析
MyD88基因編碼蛋白由288個氨基酸組成,疏水性分析結果顯示,MyD88蛋白平均疏水性為-0.149,序列中含有較多的親水性氨基酸,親水性區段主要為:27~37、52~68、71~82、88~123、125~152、171~181、185~194、202~210、215~227、237~244、249~258、264~273(圖1),序列親水性較好。疏水性氨基酸丙氨酸、半胱氨酸、異亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸和纈氨酸分別占編碼的6.60%、4.51%、4.86%、10.76%、3.13%、3.82%和7.64%。跨膜區分析結果顯示,MyD88蛋白無典型的跨膜區,MyD88蛋白的288個氨基酸均位于細胞膜表面,降低了跨膜區疏水性氨基酸對蛋白折疊的影響,易于表達和純化。
2.2 MyD88蛋白的抗原性分析
采用Protean模塊中的的Jameson-Wolf方法預測MyD88蛋白的抗原指數,發現MyD88蛋白序列具有豐富且分布均勻的抗原表位位點,其中抗原指數較高的區段為:3~12、52~65、71~82、88~123、125~152、170~181、185~194、202~210、215~227、237~244、249~258、264~273(圖2)。這些區段并且具有強的表面可及性和親水性位點,因此利用該蛋白制備抗體具有較強的可行性。
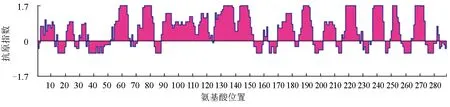
圖1 MyD88蛋白的疏水性分析
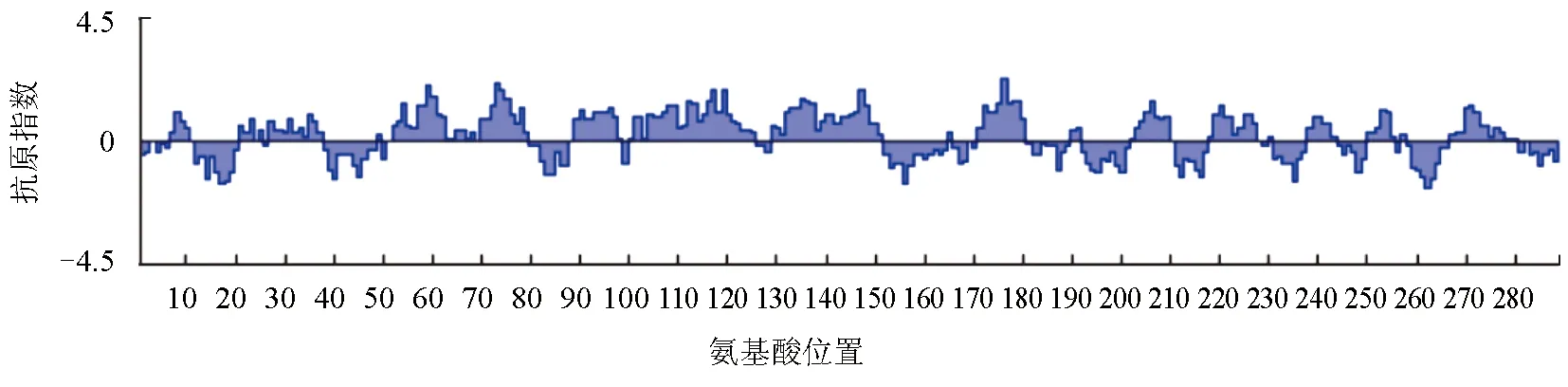
圖2 MyD88蛋白的抗原性分析
2.3 MyD88蛋白同源性分析
同源性分析結果顯示,尼羅羅非魚MyD88蛋白與兔MyD88蛋白(XP_010751574.1)序列的同源性高達81.60%。從同源性分析及抗體制備要求來看,作為多抗免疫原,MyD88蛋白應該具有較高的免疫原性。
2.4 MyD88基因表達載體的構建與鑒定
以pET-B2m-MyD88質粒為模板,PCR擴增MyD88基因,經1.2%瓊脂糖凝膠電泳檢測,獲得1條864 bp的目的片段(圖3),該片段大小與預期結果一致。經測序與序列比對分析,確定MyD88基因已正確插入載體pET-B2m中,載體構建成功。
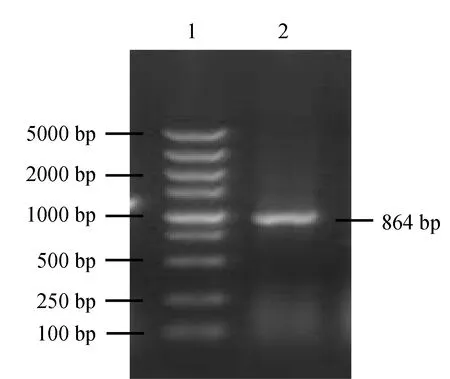
圖3 尼羅羅非魚MyD88基因原核表達載體的PCR檢測1.DL2000 plus DNA Marker; 2.MyD88基因擴增產物.
2.5 小量誘導表達
將重組質粒pET-B2m-MyD88轉化大腸桿菌B21感受態細胞后,經IPTG誘導表達與SDS-PAGE檢測,結果發現,誘導表達的菌株在48.9 ku處出現顯著表達條帶(圖4),與MyD88重組蛋白的預期大小一致。
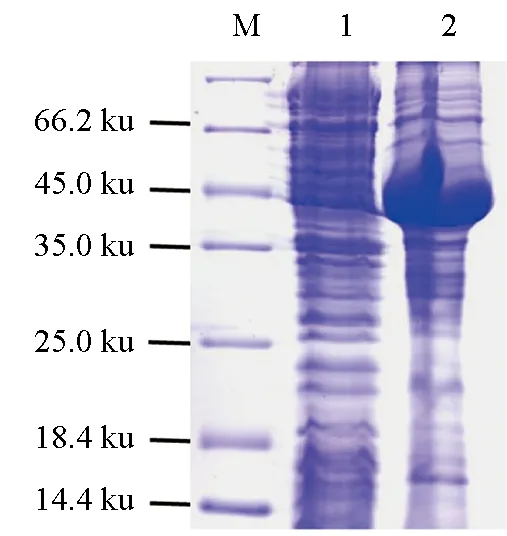
圖4 MyD88蛋白的小量誘導表達電泳檢測M.蛋白質Marker; 1.未誘導的菌株; 2.誘導表達的菌株.
2.6 重組蛋白的表達與鑒定
對重組蛋白進行大量誘導表達,經菌液裂解及SDS-PAGE電泳后,上清液與沉淀均在48.9 ku處出現1條蛋白條帶,且沉淀中蛋白的含量顯著高于上清液中蛋白的含量(圖5)。
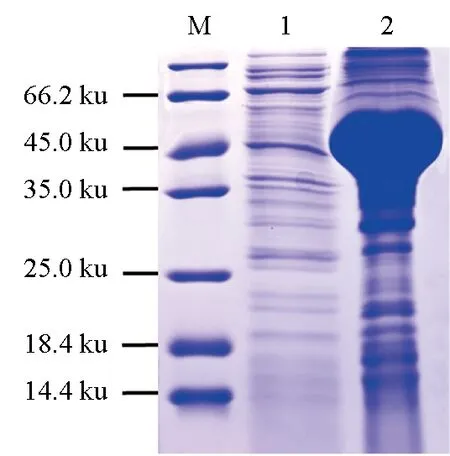
圖5 尼羅羅非魚MyD88蛋白的大量表達M.蛋白質Marker; 1.上清液中的MyD88蛋白; 2.沉淀中的MyD88蛋白.
2.7 蛋白的提取與純化
大腸桿菌表達的重組MyD88蛋白主要以包涵體存在。細菌經裂解與離心沉淀、重懸后,加入Ni-NTA樹脂層析柱中進行純化,純化產物10倍稀釋后,經SDS-PAGE電泳,結果顯示,在48.9 ku處有1條清晰的帶紋(圖6)。
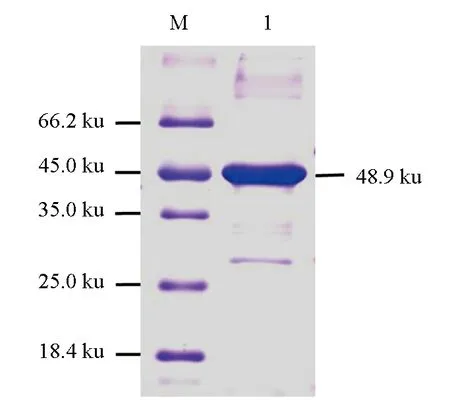
圖6 MyD88重組蛋白純化產物的SDS-PAGE分析M.蛋白質Marker; 1.純化的MyD88重組蛋白.
2.8 MyD88蛋白血清抗體的免疫效價
抗原采用pH 9.6的碳酸鹽緩沖液分別包被,ELISA法分別檢測重組MyD88蛋白免疫的日本大耳兔抗體效價。結果顯示,多克隆抗體的效價為1∶2 048 000(圖7),該重組蛋白可以誘導日本大耳兔產生良好的免疫反應,且抗體效價較高。
2.9 Western blot檢測
純化的樣品蛋白Western blot檢測結果見圖8。在泳道的48.9 ku位置,25 ng和10 ng重組蛋白均出現1條清晰的與陽性血清反應蛋白條帶,其中25 ng蛋白條帶更清晰,而免疫前陰性血清對照組在相應位置未見明顯的條帶,表明MyD88抗血清具有特異的反應特性。
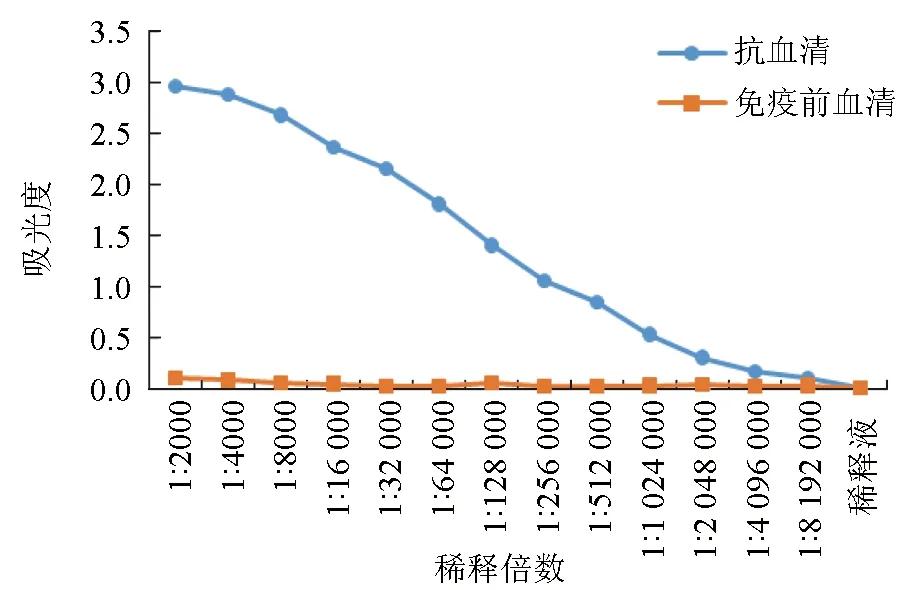
圖7 尼羅羅非魚MyD88蛋白多克隆抗體效價的ELISA曲線

圖8 MyD88蛋白多克隆抗體特異性的Western blot檢測M.蛋白質Marker; 1.25 ng純化的重組蛋白; 2.10 ng純化的重組蛋白; 3.陰性對照組.
2.10 抗體純化
將收集到的抗血清采用Protein G親和層析柱進行兩次純化,純化的抗體經4倍稀釋后,進行SDS-PAGE檢測,結果在約50 ku和25 ku處各出現1條清晰條帶(圖9),片段大小與抗體重鏈與輕鏈大小符合,純化效果較好。經純化的抗體質量濃度達10 mg/mL以上,純度約95%。

圖9 純化的MyD88抗體SDS-PAGE電泳檢測M.蛋白質Marker; 1.純化的抗體.
3 討 論
MyD88蛋白作為TLR信號通路中的一個關鍵接頭分子,在傳遞上游信息和疾病發生發展中具有重要的作用。迄今為止,MyD88基因在魚類免疫相關的研究中仍較少,魚類MyD88蛋白與抗體的研究則更少,Huang等[30]發現,MyD88與DNA疫苗acfA共同注射斑馬魚,可明顯提高MHCⅠα、MHCⅡα、CD4、CD8α、IL-1β、TNFα等免疫相關基因的特異性抗體水平和表達水平;MyD88蛋白可增強acfA對溶藻弧菌(Vibrioalginolyticus)感染的免疫保護作用。羅非魚MyD88基因序列已被克隆,其表達情況研究已有報道[31],但其功能尚不清楚,目前也無商業化可用的抗體用于MyD88蛋白研究,所以,筆者進行羅非魚MyD88基因的表達及其抗體的制備研究,對該基因的功能研究具有重要意義。
3.1 原核克隆表達載體的選擇
由于在動物先天性免疫信號通路中發揮著核心角色[32],MyD88蛋白引起了學術界的廣泛重視。然而,組織中蛋白質的低豐度導致難以從組織中獲得令人滿意的蛋白含量,限制了對其深入的研究;而作為天然提取的有效替代方法,異源表達提供了生產大量蛋白的簡單且廉價的手段[33-36]。大腸桿菌表達系統是最早開發和最成熟的外源蛋白原核表達系統。由于具有清晰的遺傳背景、低成本,表達效率高和操作簡單等優點,大腸桿菌表達系統已被廣泛用于基因的表達研究。目前pGE、pQE和pET系列質粒已廣泛用于科學研究和工業生產,而pET系列質粒由于其克隆和表達重組蛋白的高效性,以及具有多個候選融合標簽,已成為目前最常用的表達載體之一。采用大腸桿菌表達外源蛋白時,蛋白表達量的多少受多種因素的影響,如表達載體的選擇、宿主的選擇、外源基因中密碼子的使用,以及培養條件等[37]。本試驗采用金開瑞公司開發的融合表達載體pET-B2m,以大腸桿菌B21作為表達宿主,在細菌對數生長期即600 nm吸光度為0.6時,采用0.5 mmol/L IPTG作為誘導濃度,經3 h的誘導,實現了MyD88重組蛋白的高效表達,也說明pET-B2m是一種較好的表達載體,對尼羅羅非魚MyD88基因的表達具有高效性。重組蛋白的獲得不僅是制備抗體的基礎,也具有較高的實際應用價值。
3.2 表達蛋白的存在形式及包涵體的形成
本試驗采用IPTG對構建的重組表達體系進行誘導表達,經超聲波破菌后,對上清液以及沉淀進行SDS-PAGE檢測。發現上清液與沉淀均在48.9 ku處出現1條帶紋,且沉淀中的量顯著高于上清液中的量,說明所表達的重組蛋白以可溶性蛋白及不溶性的包涵體形式存在,但主要的存在形式為包涵體。包涵體是重組細菌中出現的功能性的無毒性的淀粉狀蛋白,與哺乳動物內分泌系統的分泌顆粒類似。包涵體形成是基因克隆表達中經常出現的一種情況,這是重組菌作為重組“細菌工廠”的內在的、通常不可避免的特質[38]。在強啟動子系統下,使用高溫、高誘導濃度進行蛋白誘導表達,通常會導致目的蛋白以高翻譯率表達,這會導致細菌蛋白質質量控制系統耗竭,從而引起部分折疊或錯誤折疊的蛋白分子聚集而形成包涵體[39]。蛋白表達量的多少也會影響包涵體的形成,表達量越高越容易形成包涵體,一般來說,當蛋白質的表達水平超過其細胞總蛋白的2%,就會導致包涵體的形成[40]。而細菌胞漿環境條件的降低[41],缺乏真核伴侶和翻譯后機制,也有助于包涵體的形成[42]。為了減少包涵體的形成,增加可溶性蛋白的量,研究人員已經提出了許多對策,包括遺傳方法(如降低基因表達量或基因表達效率)、物理方法(如降低培養溫度和誘導濃度)、生理學方法(如同時生成伴侶分子和折疊調節劑)以及調整有效的養分(如碳源限制)[43-44]等。而最近的研究表明,包涵體中的大部分蛋白質是有功能的,可以用于多種應用而不用溶解和重新折疊[45]。由于本研究的目的主要是制備多克隆抗體,包涵體的形成不會對抗體的制備造成影響,因此,在進行MyD88蛋白的表達時未考慮降低包涵體的形成。
3.3 多克隆抗體的特異性及效價
特異性抗體是研究基因功能重要的工具之一,雖然一些抗體可通過商業途徑獲得,但有時所需的抗體比較特殊,或所需抗體的量較大,商業途徑往往難以滿足要求,這時就需要自己制備。在抗體制備的幾種方法中,多克隆抗體制備通常是實驗室的首選,因其操作簡單,成本低,且不需要復雜的設備[46]。目前尚無可用的尼羅羅非魚MyD88蛋白抗體,本研究采用MyD88融合蛋白作為抗原來刺激日本大耳兔產生多克隆抗體,應用制備的多克隆抗體與原核誘導表達的MyD88蛋白進行Western Blot檢測,在約48.9 ku處出現了1條明顯的目的條帶,表明多克隆抗體已成功制備,且可以特異性的識別原核表達的MyD88菌體蛋白。ELISA檢測結果顯示,血清抗體的效價為1∶2 048 000,說明免疫大耳兔以后,獲得了良好的免疫反應,抗體效價較高。
本研究成功構建了尼羅羅非魚MyD88基因原核表達載體,并在大腸桿菌中誘導表達獲得了MyD88重組蛋白,將該重組蛋白免疫大耳兔后獲得了能特異性識別純化的MyD88蛋白的多克隆抗體,該重組蛋白及其抗體的制備,為后續MyD88蛋白的功能研究提供了有用的工具,也為進一步深入研究MyD88蛋白在魚類先天性免疫反應中的作用奠定了基礎。

