鎘脅迫對食蚊魚肝組織基因表達的影響
劉 陽,張 力,覃劍暉
( 1.銅仁學院 農林工程與規劃學院,貴州 銅仁 554300; 2.銅仁市碧江區滑石鄉人民政府,貴州 銅仁 554300; 3.華中農業大學 水產學院,湖北 武漢 430070 )
近年來,隨著經濟的飛速發展,水環境日益遭到破壞,污染嚴重,各種重金屬離子進入水循環,影響水生生物的的生存環境,隨著生物富集作用進一步影響人類的健康[1]。重金屬鎘(Cd)是一種銀白色有光澤的金屬,有韌性和延展性,毒性強,半衰期長達10~35年[2]。目前,鎘污染是當今世界所面臨的一個嚴重的環境問題,被鎘污染的空氣和植物對人體危害嚴重,這使其受到廣泛關注,在美國毒物管理委員會制定危害人類健康的名單上排名第六[3-4]。鎘的來源主要有兩種,一種存在于自然界中,作為副產品從硫鎘礦中提煉出來,另一種來源于人類的利用,如殺菌劑、殺蟲劑、油漆、顏料等排入湖、河、棄置場和農田,造成鎘污染。目前鎘污染已成為一個全球性的威脅[5]。
水體是魚類賴以生存的環境,魚類可以直接作為水體的指示生物,重金屬鎘主要通過兩種方式進入魚類,一種通過鰓呼吸作用,通過循環系統進入身體組織尤其是肝臟;另一種通過直接攝食方式進入體內,但食物中攜帶鎘的含量較低,對魚類損傷較小[6]。魚類雖然對鎘的吸收蓄積力很強,但會隨水環境中鎘的含量、受脅迫時間及富集部位的不同而有所差異,有國外學者研究發現,低濃度鎘處理30 d,虹鱒(Oncorhynchusmykiss)的游速、生長、日常氧消耗無明顯變化,高濃度鎘處理96 h,虹鱒的死亡率明顯提高[7]。
食蚊魚(Gambusiaaffinis)隸屬于鳉形目、花鳉科、食蚊魚屬,因嗜吃蚊子幼蟲而得名[8],它又名大肚魚、柳條魚、大眼叮當,原產美國東南部、墨西哥及古巴,目前已經成為全球性的入侵物種之一,適應性強,生活于河溝、池塘、沼澤、水稻田等各種水體中[9],食蚊魚因其體形小,繁殖能力強,周期短等特性符合魚類毒性試驗的要求,所以經常被應用在毒性試驗中,是一種較為理想的環境污染指示生物,而目前國內對食蚊魚在毒理學方面的研究較少。
當生物體接觸鎘的脅迫后,因機體保護作用,會誘導一系列抗逆相關基因的表達,對抗鎘的毒性,脅迫的生物標記分子主要是金屬硫蛋白(MT)、熱休克蛋白(HSPs)以及細胞色素氧化酶1A(CYP1A)等[10]。筆者主要探討了鎘對食蚊魚熱休克蛋白70(HSP70)、熱休克蛋白90(HSP90)、CYP1A以及MT基因表達的影響,通過多個角度綜合探討鎘對食蚊魚的毒性作用機制以及為防治鎘污染提供科學依據,拓展食蚊魚在環境毒理科學研究中的應用范圍,也為其成為模式生物提供數據支持。
1 材料與方法
1.1 試驗材料
食蚊魚購于上海中環花鳥市場,體質量(2.80±0.05) g,體長(4.30±0.20) cm。在實驗室條件,自然光照,用曝氣48 h以上的自來水暫養7 d,溫度(20±2) ℃,pH 7.8±0.2。選擇體色正常,游動無異常,無疾病的食蚊魚進行試驗。試驗開始前24 h停止投喂,馴養開始48 h后記錄死亡率,若小于5%則符合GB/T 13267—91《水質物質對淡水魚(斑馬魚)急性毒性測定方法》的要求。
1.2 試驗試劑
總RNA提取試劑(RNAiso Plus)、反轉錄試劑盒(PrimeScript? RT reagent Kit with gDNA Eraser)、DL 2000 DNA Maker、SYBR Premix Ex TaqTMⅡ購自Takara公司;DEPC濃縮液購自TIANGEN公司;氯化鎘、異丙醇、無水乙醇、氯仿、氯化鈣等其他試劑均為國產分析純。
1.3 試驗方法
根據急性毒性試驗的結果[11],試驗以(0、1/40、1/20和1/10的96 h的半數致死質量濃度)進行染毒,鎘的質量濃度分別為0、0.564、1.128、2.255 mg/L,設4個處理組,每個處理組均設3個平行,取暫養2周的健康食蚊魚進行試驗,每組放入20尾食蚊魚,在整個試驗過程中,水溫(24±2) ℃,pH 7.8±0.2,光暗比12 h∶12 h,試驗持續7 d,定期投喂并吸出殘渣,試驗期間魚無死亡。
1.4 取樣與樣品處理
試驗開始后的第1、3、5、7 d每組隨機抽取3尾試驗魚,清洗表面,于超凈工作臺上進行冰上解剖,取其肝臟,置于-80 ℃冰箱中保存,以供后續HSP70、HSP90、MT、CYP1A和β-Actin基因表達的測定。
1.5 總RNA的提取
取-80 ℃冰箱中保存的樣品,嚴格按照Takara公司RNAiso Plus試劑說明書進行操作。
1.6 逆轉錄反應
根據反轉錄試劑盒(PrimeScript? RT reagent Kit With gDNA Eraser)的步驟進行操作,以上一步提取的總RNA為模板,反轉錄得到cDNA。
1.7 特異性引物的設計與合成
根據GenBank中已報道的HSP70(序列號KF800737)、HSP90(序列號KF800736)、MT(序列號AB455145.1)、CYP1A(序列號AB371607.1)和β-Actin(序列號KP284099.1)基因序列,按照引物設計原則,應用Primer Premier 5.0和Oligo 6.0軟件設計食蚊魚HSP70、 HSP90、MT、CYP1A和β-Actin基因的特異性引物(表1),由上海生工生物公司合成。

表1 熒光定量PCR所用引物序列
1.8 熒光定量PCR
將各個樣品cDNA稀釋10倍作為新的模板,在實時熒光定量PCR儀上進行β-Actin和目的基因的擴增,每個樣品設置3個重復。
反應體系為25 μL:依次加入SYBR Premix Ex TaqTM Ⅱ(2×) 12.5 μL、PCR Forward Primer(10 μmol/L)0.5 μL、PCR Reverse Primer(10 μmol/L)0.5 μL、DNA模板2 μL、dH2O 9.5 μL。
反應程序為三步法:95 ℃預變性3 min;95 ℃ 30 s,60 ℃退火30 s,共40個循環;72 ℃ 10 min。并收集熒光信號,使β-Actin和目的基因擴增效率接近100%。
1.9 數據處理
得到的Ct數據,利用2-△△Ct法,計算目的基因的相對表達量,△△Ct=(Ct目的基因-Ct0平均)-(Ctβ-Actin-Ct0平均)進行計算,其數值用平均值±標準差表示,運用SPSS 16.0統計分析軟件作圖,并進行單因素方差分析和Duncan′s多重比較數值的差異顯著性分析[圖中*、**分別表示與對照組相比差異顯著(P<0.05)、差異極顯著(P<0.01)]。
2 結 果
2.1 Cd2+脅迫對食蚊魚肝組織HSP70基因表達的影響
Cd2+對食蚊魚肝組織HSP70基因表達的影響見圖1。在1、3、7 d時,各處理組在相同時間內隨Cd2+暴露質量濃度的升高,肝組織HSP70基因表達量逐漸上調,并且差異顯著(P<0.01)。1.128、2.255 mg/L處理組,隨著暴露時間的延長,肝組織HSP70基因表達量顯著下調(P<0.01),且趨于穩定;HSP70基因表達量峰值出現在第1 d的2.255 mg/L處理組;0.564 mg/L處理組隨著暴露時間的延長,HSP70表達量無明顯差異。
2.2 Cd2+脅迫對食蚊魚肝組織HSP90基因表達的影響
Cd2+對食蚊魚肝組織HSP90基因表達的影響見圖2。1.128、2.255 mg/L處理組隨時間的延長,HSP90基因表達量總體表現為先升后降的趨勢,且差異極顯著(P<0.01),但0.564 mg/L處理組的HSP90基因表達水平無明顯差異;在相同暴露時間下,隨Cd2+暴露質量濃度的升高,HSP90基因表達水平總體表現也為顯著上調(P<0.01)。
2.3 Cd2+脅迫對食蚊魚肝組織MT基因表達的影響
Cd2+對食蚊魚肝組織MT基因表達的影響見圖3。不同質量濃度處理組隨時間延長,MT基因表達量總體表現為先升后降的趨勢,且差異顯著(P<0.01);1 d和3 d時,隨著Cd2+暴露質量濃度的升高,MT基因表達水平顯著上調(P<0.01),5 d和7 d時,隨著Cd2+暴露質量濃度的升高,MT基因表達水平先升后降,且逐漸達到穩定(P<0.05)。
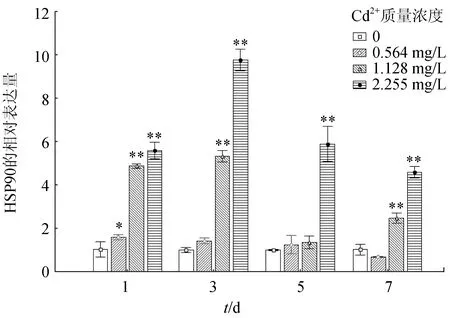
圖2 Cd2+暴露對食蚊魚肝組織HSP90基因的影響
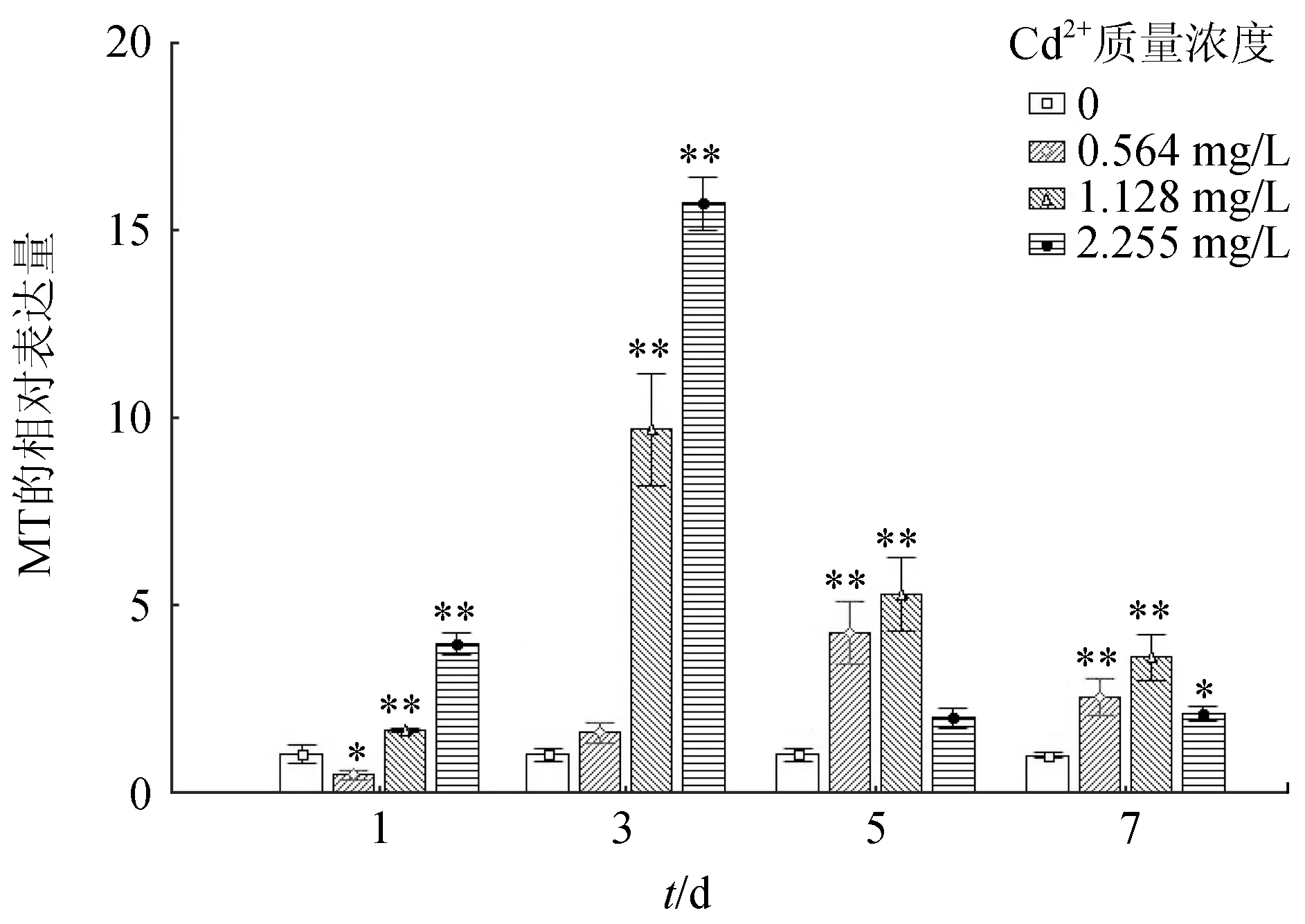
圖3 Cd2+暴露對食蚊魚肝組織MT基因的影響
2.4 Cd2+脅迫對食蚊魚肝組織CYP1A基因表達的影響
Cd2+對食蚊魚肝組織CYP1A基因表達的影響見圖4。不同質量濃度處理組隨時間的延長,CYP1A基因表達量總體表現為逐漸下調;1 d時,隨著Cd2+暴露質量濃度的升高,CYP1A基因表達水平顯著上調(P<0.01),且達到峰值,3 d和7 d時,CYP1A基因表達水平變化不大,5 d時,CYP1A基因表達水平被顯著抑制(P<0.01)。
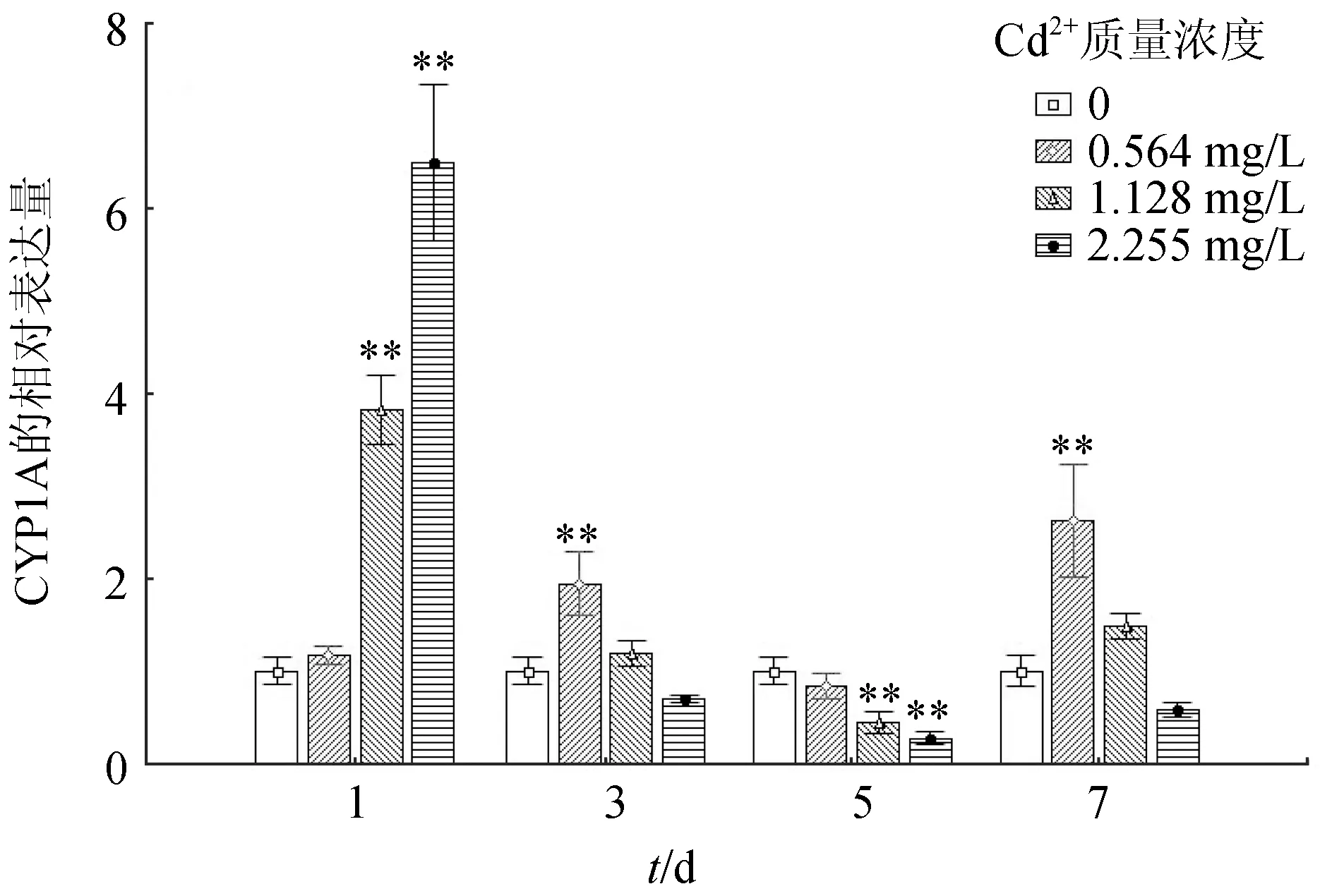
圖4 Cd2+暴露對食蚊魚肝組織CYP1A基因的影響
3 討 論
目前,重金屬污染已經成為一個嚴重的環境問題,尤其是對水生生物。以往的研究表明,水體中的重金屬對水生生物產生嚴重影響,給養殖業帶來巨大損失[12-13],特別是重金屬鎘,既是致癌物質,又是一種內分泌干擾物[14-15]。在本研究中,食蚊魚經過鎘處理后,利用熒光定量PCR技術檢測肝組織中HSP70、HSP90、MT和CYP1A基因水平的變化情況,以了解重金屬鎘脅迫對食蚊魚基因表達的影響。
3.1 Cd2+脅迫對食蚊魚肝組織HSP70基因表達的影響
當生物體遇到外界不良刺激,如紫外線、機械損傷、重金屬、酸、氧化劑等脅迫因子時,機體為抵抗外界不良刺激生物體第一反應會合成一系列抗逆相關基因和蛋白,這些變化指標就可以作為生物化學標記,檢測有機體在不利條件時的變化。在環境毒理學中,熱休克蛋白經常被作為生物標志物[16],當細胞受到很大環境壓力時,它的第一反應就是合成更多的熱休克蛋白[17]。本試驗結果顯示,隨著Cd2+暴露時間的延長,食蚊魚肝組織HSP70基因表達量先升后降,并且差異顯著。黃姑魚(Nibeaalbiflora)經過低溫刺激后,隨著刺激的時間增加,HSP70的表達量先增后減,直至達到穩定[18]。真鯛(Pagrosomusmajor)尾鰭纖維原細胞經鎘和銅的暴露處理4 h,其體內HSP70基因水平明顯增加[17]。Ryan等[16]研究表明,魚類細胞經過鎘和銅的暴露處理后,HSP70基因表達被嚴重誘導,HSP70基因水平在暴露結束后才恢復至正常的表達量,HSP70基因水平的變化受環境壓力的影響。劉迪秋等[19]研究鎘處理后對鯽魚(Carassiusauratus)肝臟組織中基因表達時發現,其肝臟組織中HSP27、HSP47、HSP60、HSP70、HSP90、MT-B、CYP1A基因的表達屬于中間型,GPx 4a、HSP30及GR基因的表達屬于完全的抑制型。重金屬鎘脅迫唐魚(Tanichthysalbonubes)96 h后,不同的基因表達差異顯著,肝臟中HSP70基因表達水平無顯著變化,而肝臟中HSP60基因表達水平受到顯著誘導作用,但不同組織中的HSP70基因水平差異顯著,鰓中HSP70基因水平表現為先升后降[17]。
3.2 Cd2+脅迫對食蚊魚肝組織HSP90基因表達的影響
食蚊魚經過Cd2+處理后,在相同時間下,1.128、2.255 mg/L處理組HSP90基因的表達水平顯著上調,并且達到峰值,而0.564 mg/L處理組HSP90基因的表達水平無明顯差異。以往的研究表明,HSP90基因的表達水平在不同物種或者不同重金屬暴露下差異很大。如用10 mg/L鎘溶液處理鯉魚(Cyprinuscarpio),其腎臟中HSP90a基因表達水平先升后降,但肝臟中HSP90a表達水平卻顯著上升[20]。唐魚在經過重金屬鎘暴露后,鰓和肝臟組織中HSP90基因的表達水平明顯低于對照組,表現為下降趨勢[17]。而在本研究中,重金屬暴露后HSP90基因的表達被顯著誘導,這與斑馬魚(Daniorerio)[21]和非洲爪蟾(Xenopuslaevis)[22]的研究結果相似。HSP90表達水平上升,可能是生物遇到毒物時,HSP90基因協助變性的蛋白質進行修復,保護機體。
3.3 Cd2+脅迫對食蚊魚肝組織MT基因表達的影響
MT是可溶性金屬結合蛋白,富含較多半胱氨酸的短肽,對多種金屬具有高度親和性[23],因此能選擇性結合銅、鎘、鋅等金屬離子。MT基因已被廣泛用作重金屬處理的生物標記物,尤其是鎘[24]。在本試驗中,所有的Cd2+處理組的食蚊魚肝組織中的MT基因表達量與對照相比均差異顯著,隨著暴露的時間延長,MT基因的表達量顯著上升后下降。在之前的研究中也觀察到類似的現象,如鎘處理后在大鼠肝組織的MT基因顯著上升達到高峰,然后下降[25],也與虹鱒[26]和羅非魚(Oreochromis)[27]經過刺激后MT基因變化相似。一定量的重金屬誘導MT基因的表達量增加,但隨時間延長,重金屬在肝臟中快速堆積,超過其耐受,可能破壞MT基因表達量和重金屬之間的穩定。
3.4 Cd2+脅迫對食蚊魚肝組織CYP1A基因表達的影響
CYP1A是一個典型的生物標志物,環境污染物和藥物會影響其活性,目前CYP1A被廣泛應用在毒理學試驗中[28-29]。本研究結果表明,Cd2+脅迫初始時,CYP1A基因的表達水平較對照組顯著上調,但隨處理時間的增加,其表達水平又被顯著抑制。Huang等[30]報道,類固醇激素處理雌性食蚊魚,肝臟CYP1A基因的表達量顯著減少。事實上,經過有毒物質處理的食蚊魚,其CYP1A基因表達水平的抑制可以調節細胞的解毒能力。因此據本研究結果推測,Cd2+可以調節CYP1A基因表達水平,為需要監測Cd2+的區域的生物作標志物。
本試驗的結果表明,鎘暴露對食蚊魚的HSP70、HSP90、MT和CYP1A基因較為敏感,這為食蚊魚作為潛在的試驗動物提供了依據,拓展了其在環境毒理學中的研究。此外,重金屬暴露質量濃度和反應時間也會影響生物標記物的基因表達水平,監測過程中不能只單純利用一個指標,綜合各個指標進行評價,才能得到可靠、符合事實的結果。

