老年缺血性腦卒中后疲勞病人神經功能及遠期預后的相關因素分析
缺血性腦卒中是一種由遺傳和環境因素相互作用而引起的腦血管疾病。近年來,其發病率呈上升趨勢,是老年人致殘、致死的主要原因[1]。缺血性腦卒中后疲勞是腦卒中后短期即可出現的并發癥,其主要臨床表現為長期存在體力和腦力活動后精疲力竭,且一般休息后不能緩解[2-3]。近年來有研究表明,血清鈣調蛋白(calmodulin,CAM)、超敏C反應蛋白(hypersensitive C-reactive protein,hs-CRP)、同型半胱氨酸(homocysteine,Hcy)及白細胞介素1β(interleukin 1β,IL-1β)水平與缺血性腦卒中后疲勞病人神經功能及遠期預后密切相關[4]。本研究采用回顧性分析,對血清CAM、hs-CRP、Hcy及IL-1β水平與老年缺血性腦卒中后疲勞病人神經功能及遠期預后的相關性進行探討,以期為老年缺血性腦卒中病人臨床治療提供理論依據。現報道如下。
1 資料與方法
1.1 一般資料 選取2016年7月至2017年8月96例老年缺血性腦卒中病人的臨床資料,根據疲勞嚴重度量表評分將其分為疲勞組41例與非疲勞組55例。其中疲勞組男23例、女18例,年齡60~78歲,平均(66.47±7.92)歲;非疲勞組男31例、女24例,年齡61~80歲,平均(66.85±8.01)歲。納入標準[5]:(1) 參照中華醫學會神經病學分會腦血管病學組制定的《2014年中國急性缺血性腦卒中診治指南》中的相關診斷標準,并進一步通過顱腦CT或MRI檢查確診;(2) 發病至入院就診時間<24 h;(3) 年齡≥60歲;(4) 病人本人和(或)家屬均知情同意并簽署知情同意書。排除標準[6]:(1) 病歷資料不完整者;(2) 伴有精神類疾病不能配合研究者;(3) 伴有心、肝、腎等主要臟器功能障礙者;(4) 合并重度感染、自身免疫性疾病、心房顫動、動脈炎或惡性腫瘤者;(5) 病人自入院時起1年內死亡。
1.2 治療方法 對2組病人均給予積極的內科治療,并根據每位病人的病因、發病時間、臨床類型以及發病機制等制定治療方案,給予相應的個體化治療。
1.3 觀察指標及評分標準 記錄2組病人性別,年齡,體質量指數,收縮壓,舒張壓,血糖,吸煙史,心血管病家族史,高血壓、糖尿病、冠心病、心房顫動、充血性心力衰竭、卒中、高脂血癥病史,檢測總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)水平以及不同時間點(入院時及治療后3、6、12個月)血清CAM、hs-CRP、Hcy、IL-1β水平及美國國立衛生研究院卒中量表(NIHSS)評分與改良Rankin量表(mRS)評分。
分別于入院時及治療后3、6、12個月清晨空腹采靜脈血約3~5 mL于干燥試管,3500 r/min離心10 min(離心半徑12 cm),分離血清后上機檢測。TC采用膽固醇氧化酶法進行測定,TG采用游離甘油法進行測定,HDL-C采用選擇性化學沉淀法進行測定,LDL-C采用超速離心法進行測定。血清CAM、Hcy及IL-1β水平采用酶聯免疫吸附試驗(ELISA)進行測定,血清hs-CRP水平采用膠乳增強免疫比濁法進行測定。本研究所用CS-6400全自動生化分析儀由迪瑞醫療科技股份有限公司提供,所用試劑盒均由北京義翹神州科技有限公司提供。
疲勞嚴重度測評采用疲勞嚴重度量表評分進行評定,共包括9個條目,每個條目共分為1~7分7個分值,從非常不同意逐漸過渡為非常同意,總分值范圍為9~63分,疲勞嚴重度量表評分≥36分可診斷為疲勞。
采用 NIHSS 評分量表對病人神經功能缺損嚴重程度進行評估,NIHSS共包括11條15個子項目,分值范圍為0~42分,分值越高說明病人神經缺失程度越嚴重。
采用mRS評分量表對病人神經功能的恢復情況進行評估,共分為0~6分7個分值,0~2分表示病人經治療后預后良好,3~6分表示病人經治療后預后不良(其中6分代表死亡)。
自入院時起對2組病人均進行為期12個月的跟蹤隨訪,隨訪起止日期:2016年7月至2018年8月。
2 結果
2.1 2組病人基線資料比較 2組病人基線資料比較,差異無統計學意義(P>0.05),具有可比性。見表1。
2.2 2組病人入院時及治療后不同時間點CAM、hs-CRP、Hcy及IL-1β水平比較 2組病人治療后3、6、12個月CAM、hs-CRP、Hcy及IL-1β水平與入院時比較,差異均有統計學意義(P<0.05);且疲勞組病人入院時及治療后3、6、12個月CAM、hs-CRP、Hcy及IL-1β水平均明顯高于非疲勞組(P<0.05)。見表2。
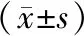
表1 2組病人基線資料比較
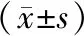
表2 2組病人入院時及治療后不同時間點CAM、hs-CRP、Hcy及IL-1β水平比較
注:與非疲勞組比較,*P<0.05;與入院時比較,#P<0.05;與治療后3個月比較,△P<0.05;與治療后6個月比較,&P<0.05
2.3 2組病人入院時及治療后不同時間點NIHSS評分比較 治療后3、6、12個月,2組病人NIHSS評分依次降低,且非疲勞組病人NIHSS評分降低更明顯。疲勞組病人入院時及治療后3、6、12個月NIHSS評分均分別明顯高于非疲勞組(P<0.05)。見表3。

表3 2組病人入院時及治療后不同時間點NIHSS評分比較分)
注:與入院時比較,*P<0.05;與治療后3個月比較,#P<0.05;與治療后6個月比較,△P<0.05;與疲勞組比較,&P<0.05
2.4 2組病人入院時及治療后不同時間點mRS評分比較 治療后3、6、12個月,2組病人mRS評分均依次降低,且非疲勞組病人降低更明顯。疲勞組病人入院時及治療后3、6、12個月mRS評分均分別明顯高于非疲勞組(P<0.05)。見表4。

表4 2組病人入院時及治療后不同時間點mRS評分比較分)
注:與入院時比較,*P<0.05;與治療后3個月比較,#P<0.05;與治療后6個月比較,△P<0.05;與疲勞組比較,&P<0.05
2.5 Spersman相關性分析 老年缺血性腦卒中后疲勞病人NIHSS評分、mRS評分與血清CAM、hs-CRP、Hcy及IL-1β水平均呈正相關(P<0.05)。見表5。

表5 Spersman相關性分析(r)
3 討論
缺血性腦卒中后疲勞是腦卒中的常見并發癥,統計數據顯示,其發生率高達30%~68%,已對腦卒中病人日常生活活動能力及各種功能障礙恢復產生了嚴重影響,不利于病人預后[7]。缺血性腦卒中后疲勞通常表現為慢性的、過度的、持續性的、異常的身體疲倦,且一般休息不能起到緩解作用[8]。大量臨床研究表明,缺血性腦卒中后疲勞誘發因素較多,但其具體發生機制尚不明確,通常認為與一些生化指標和生理指標失衡、內分泌紊亂性疾病以及慢性感染、貧血等病理性情況有關,同時安眠藥物、抗痙攣藥物及β受體阻滯劑的使用也可能導致疲勞,對其進行治療的有效措施包括抗抑郁治療、認知療法以及運動訓練等[9]。目前缺血性腦卒中后疲勞已引起臨床工作者的普遍關注,因此對于缺血性腦卒中后疲勞的早發現、早診斷及早治療顯得尤為重要[10]。搜集文獻資料發現,國內有關缺血性腦卒中后疲勞的研究主要集中在臨床特征及相關因素方面,而有關血清CAM、hs-CRP、Hcy及IL-1β水平與神經功能及遠期預后相關性的報道較為少見,且并不全面,故本研究對此進行了深入探討。
CAM作為細胞內功能最重要的Ca2+受體蛋白,參與了體內多種疾病的病理生理過程。研究表明,在缺血性腦卒中發生后,CAM可起到調控神經細胞內Ca2+超載的關鍵作用,從而間接或直接影響大量自由基生成以及興奮性氨基酸的釋放,在腦缺血缺氧后對血糖及天門冬氨酸等興奮性氨基酸的釋放具有明顯的促進作用[11-12]。CRP是一種主要由IL-1、IL-6等刺激肝細胞所產生的急性時相反應蛋白,在機體損傷后其濃度會急劇升高,而臨床實際應用中發現,對hs-CRP進行檢測更為靈敏,可發現機體內更低水平的炎癥反應[13]。Hcy是一種主要由甲硫氨基酸經甲基代謝所產生的含硫氨基酸,在機體中可介導氧自由基和炎癥因子的生成,通過引起血管內皮損傷而導致機體慢性炎癥浸潤,是動脈粥樣硬化發生的重要影響因素[14]。IL-1β是主要產生于中樞神經系統以及在神經退行性病變炎癥中被激活的小神經膠質細胞的炎癥因子,在缺血性腦卒中的發生發展中發揮著重要的作用[15]。關于血清CAM、hs-CRP、Hcy及IL-1β水平預測老年缺血性腦卒中病人是否發生疲勞學者們做了大量的研究,一致認為血清CAM、hs-CRP、Hcy及IL-1β水平越高,則老年缺血性腦卒中病人發生疲勞的可能性越大[16-17]。本研究中,疲勞組病人入院時及治療后3、6、12個月CAM、hs-CRP、Hcy及IL-1β水平均分別明顯高于非疲勞組,表明老年缺血性腦卒中后疲勞病人體內血清CAM、hs-CRP、Hcy及IL-1β水平呈高表達,與上述研究結果一致。本研究中疲勞組病人入院時及治療后3、6、12個月NIHSS評分、mRS評分均分別明顯高于非疲勞組,表明老年缺血性腦卒中后疲勞病人神經功能缺損程度較為嚴重,治療后恢復較差。進一步研究發現,老年缺血性腦卒中后疲勞病人NIHSS評分及mRS評分與血清CAM、hs-CRP、Hcy及IL-1β水平均呈正相關,表明老年缺血性腦卒中后疲勞病人體內血清CAM、hs-CRP、Hcy及IL-1β水平越高,神經功能缺損程度越嚴重,同時遠期預后越差。本研究存在以下局限性:研究對象均為老年缺血性腦卒中后疲勞病人,且所選取的樣本數偏小,可能有選擇偏倚的存在,有待進一步擴大樣本量進行探討。
總之,老年缺血性腦卒中后疲勞病人神經功能缺損程度較為嚴重,且治療后遠期預后較差,NIHSS評分及mRS評分與血清CAM、hs-CRP、Hcy及IL-1β水平均呈明顯正相關。

