ST段抬高型心肌梗死合并多支血管病變患者經皮冠狀動脈介入治療策略的研究進展
王懷根,王東琦,2
ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是臨床常見心血管危急重癥之一,其發病率、病死率均較高。經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)治療STEMI的效果已經充分證實,其可及時開通罪犯血管,縮小心肌梗死面積,降低心力衰竭、心源性休克(cardiogenic shock,CS)、惡性心律失常等并發癥發生風險及病死率。
多支血管病變(multivessel disease,MVD)指2支及以上冠狀動脈主要血管(直徑≥2 mm)狹窄率≥70%。研究表明,約50%的STEMI患者合并MVD[1],而MVD可增加STEMI患者復發及PCI后短期死亡風險,是導致STEMI患者預后不良的重要原因[1-2]。STEMI合并MVD患者的PCI策略主要包括即刻完全血運重建(immediately complete revascularization,ICR)、分期完全血運重建(staged complete revascularization,SCR)及僅罪犯血管血運重建(culprit-only revascularization,COR)3種,但目前關于這3種PCI策略的選擇、對患者預后的影響及非罪犯血管(non-culprit vessel)的最佳處理時機等研究結論不盡一致。本文主要綜述了STEMI合并MVD患者的PCI策略,以期為臨床制定科學的PCI策略提供參考。
1 STEMI合并MVD患者的PCI策略
早期多項觀察性研究表明,與COR相比,完全血運重建(complete revascularization,CR)并不能有效改善STEMI患者長期預后,且會增加圍術期并發癥發生風險,可能對患者有害[3-4]。VLAAR等[5]于2011年進行的一項包含18項研究(其中前瞻性研究4項、回顧性研究14項)、40 280例STEMI合并MVD患者的Meta分析結果顯示,與COR及ICR相比,SCR可更有效地降低STEMI合并MVD患者近期及遠期病死率,證實首次行PCI的STEMI合并MVD患者即使存在適合PCI的非罪犯血管,也不應對非罪犯血管進行急診PCI,而應行擇期PCI。2013年美國心臟病學會基金會(ACCF)/美國心臟協會(AHA)聯合發布的STEMI指南[6]、2014年歐洲心臟病學會(ESC)/歐洲心胸外科協會(EACTS)聯合發布的STEMI患者處理指南[7]及2015年中華醫學會心血管病學分會、中華心血管病雜志編輯委員會發布的《急性ST段抬高型心肌梗死診斷和治療指南》[8]均不推薦血流動力學穩定的STEMI患者行急診PCI以干預非罪犯血管。
近年來,多項隨機對照臨床試驗證實,CR可在不增加安全性風險的前提下有效改善STEMI合并MVD患者長期預后[9-11]。其中 CvLPRIT研究[9]共納入了 296例 STEMI合并MVD患者并進行了1年隨訪,結果顯示,與COR相比,CR可有效降低STEMI合并MVD患者復合終點事件(包括死亡、再次心肌梗死、心力衰竭及再次血運重建)發生風險〔HR=0.49,95%CI(0.24,0.84),P=0.009〕;DANAMI-3—PRIMULTI研究[10]共納入了627例STEMI合并MVD患者,結果顯示,與COR相比,血流儲備分數(fractional flow reserve,FFR)指導下的CR可有效降低STEMI合并MVD患者罪犯血管血運重建后復合終點事件(包括全因死亡、非致死性心肌梗死及再次血運重建)發生率(13%比22%,P=0.004)。PRAMI研究[12]結果顯示,與COR相比,CR可有效降低STEMI合并MVD患者復合終點事件(包括心因性死亡、非致死性心肌梗死及再發心絞痛)發生風險〔RR=0.35,95%CI(0.21,0.58),P<0.001〕。2015年10月,美國心臟病學會(ACC)、AHA聯合美國心血管影像與介入學會(SCAI)發布的STEMI患者PCI指南指出,對于部分血流動力學穩定的STEMI合并MVD患者,可在處理罪犯血管的同時對非梗死相關血管進行干預(Ⅱb類推薦)[13]。2017年ESC頒布的STEMI患者管理指南建議,對于存在MVD的STEMI患者,出院前可對其非罪犯血管進行常規血運重建(Ⅱb類推薦,A級證據)[14]。目前,仍有多項大規模隨機對照臨床試驗正在進行,并有望進一步證實CR相較于COR對STEMI合并MVD患者的優勢。
2 STEMI合并MVD患者非罪犯血管的最佳干預時機
目前,對于STEMI合并MVD患者非罪犯血管行CR已基本達成共識,但關于非罪犯血管的最佳干預時機尚無定論,詳見表1。TARASOV等[15]在一項回顧性研究中將STEMI合并MVD患者分為A、B兩組,其中A組患者(n=39)于首次PCI后60 d內行SCR,而B組患者(n=148)則于首次PCI后60 d后行SCR,結果顯示,A組患者靶血管血運重建(target vascular reconstruction,TVR)、再次心肌梗死發生率分別為5.1%、0,均低于B組(27.7%、9.46%),但兩組患者病死率間無統計學差異。MOORE等[16]研究認為,對于僅存在一支非罪犯血管的STEMI患者,應于49 d內對非罪犯血管進行干預,而對于存在兩支及以上非罪犯血管的STEMI患者,則應于10 d內行CR。OPMPM研究將STEMI合并MVD患者分為A、B兩組,其中A組患者(n=56)于首次PCI后2周內行SCR,而B組患者(n=70)則于首次PCI后2周后行SCR,結果顯示,A組患者主要不良心血管事件(major adverse cardiovascular events,MACE)發生率明顯高于B組(27.3%與21.2%,P<0.05);進一步行多因素分析發現,首次PCI后2周內行SCR是STEMI合并MVD患者再次心肌梗死的獨立預測因素[17]。KIM等[18]在一項回顧性研究中將STEMI合并MVD患者分為A組(n=316)、B組(n=360)、C組(n=77),其中A組患者于住院期間行CR,B組患者于PCI后1周內行SCR,C組患者于PCI后1周后行SCR,平均隨訪3.4年發現,C組患者復合終點事件(包括全因死亡、非致死性心肌梗死、再次血運重建)發生風險高于A組〔OR=1.83,95%CI(1.06,3.18),P=0.031〕,而A組與B組患者復合終點事件發生風險間并無統計學差異〔OR=1.01,95%CI(0.70,1.46),P=0.950〕,因此建議STEMI合并MVD患者行ICR或于PCI后1周內行SCR。BANGALORE等[19]進行的一項包含11個隨機對照臨床試驗、3 150例STEMI合并MVD患者的Meta分析結果顯示,與COR相比,ICR可有效降低STEMI合并MVD患者死亡或心肌梗死聯合風險〔RR=0.52,95%CI(0.37,0.73),P<0.001〕,但與COR相比,SCR并未有效降低死亡或心肌梗死聯合風險,而由于ICR、SCR這兩種CR方式均在未明顯增加安全性風險的前體下有效降低了STEMI合并MVD患者再次血運重建風險,因此,研究者認為ICR可能是STEMI合并MVD患者的最佳策略。
3 STEMI合并MVD患者需干預的非罪犯血管的選擇
目前,臨床主要通過冠狀動脈造影評估STEMI合并MVD患者非罪犯血管是否需進行干預,而FFR能幫助識別MVD患者真正引起心肌缺血的罪犯血管并評估其他非罪犯血管,有利于避免過度干預無功能性缺血的冠狀動脈病變,因此FFR指導下行PCI以干預非罪犯血管有利于改善STEMI合并MVD患者預后,減少患者費用及不必要的支架植入等[10,23-25]。FAME研究將存在MVD的冠心病患者隨機分為冠狀動脈造影指導組(n=496)、FFR及冠狀動脈造影指導組(n=509),結果顯示,FFR及冠狀動脈造影指導組患者復合終點事件(包括死亡、非致死性心肌梗死及再次血運重建)發生率明顯低于冠狀動脈造影指導組(18.3%比13.2%,P=0.02)[23];隨訪2年FFR及冠狀動脈造影指導組患者死亡及心肌梗死發生率明顯低于冠狀動脈造影指導組(8.4%比12.9%,P=0.02)[26];隨訪5年FFR及冠狀動脈造影指導組患者平均支架植入數量明顯少于冠狀動脈造影指導組(2.7枚比1.9枚,P<0.001),但兩組患者MACE發生風險間無統計學差異〔RR=0.91,95%CI(0.75,1.10),P=0.31〕[27]。L?NBORG等[28]將 DANAMI-3—PRIMULTI研究中的 627例 STEMI合并MVD患者根據病變血管數及非罪犯血管狹窄程度進行亞組分析,結果顯示,對于存在三支血管病變的患者,與COR組(n=100)相比,FFR指導下的CR組(n=97)包括全因死亡、再次心肌梗死及再次血運重建的主要終點事件發生風險更低〔HR=0.33,95%CI(0.17,0.64),P=0.001〕,但在雙支血管病變患者中,兩組間無統計學差異〔HR=0.77,95%CI(0.47,1.26),P=0.29〕;對于至少1支非罪犯血管狹窄率>90%的患者,FFR指導下的CR組(n=112)與COR組(n=90)相比,主要終點事件發生風險更低〔HR=0.32,95%CI(0.18,0.62),P=0.001〕,但對于非罪犯血管狹窄率<90%的患者,兩組間無統計學差異〔HR=0.72,95%CI(0.44,1.19),P=0.21〕;提示FFR指導下的CR可能在伴有三支血管病變或至少有1支非罪犯血管狹窄率>90%的STEMI合并MVD患者中更具優勢。
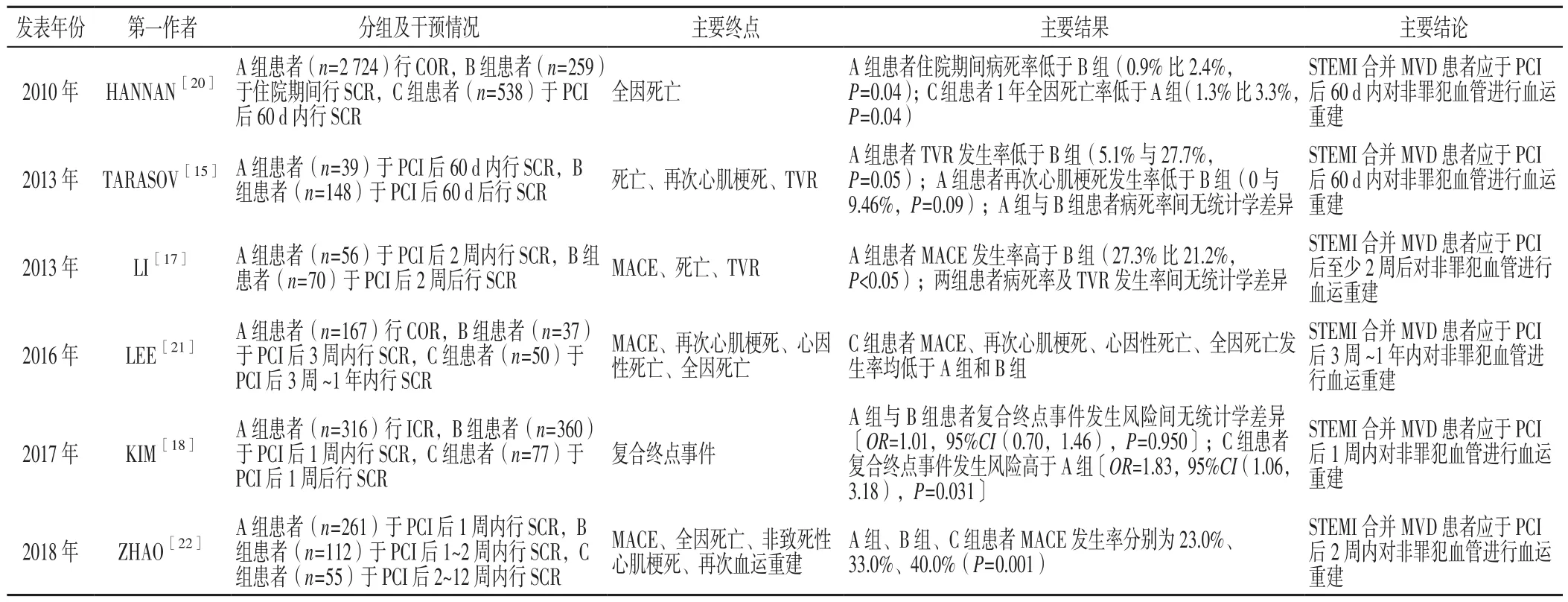
表1 目前關于STEMI合并MVD患者非罪犯血管最佳干預時機的主要研究報告Table 1 Research reports about optimal intervention timing of non-culprit vessel in STEMI merged with MVD at present
4 伴有CS的STEMI合并MVD患者的PCI策略
急性心肌梗死并CS患者病死率為40%~60%[29],而急性心肌梗死并CS患者合并MVD的比例接近80%[30]。2015年中華醫學會心血管病學分會、中華心血管病雜志編輯委員會發布的《急性ST段抬高型心肌梗死診斷和治療指南》建議對于伴有CS的STEMI合并MVD患者,可考慮行非梗死血管ICR(Ⅱa類推薦,B級證據)[8];2017年ESC指南建議,伴有CS的STEMI合并MVD患者若血流動力學不穩定則可考慮行多支血管PCI(Ⅱa類推薦,C級證據),但非罪犯血管的PCI應滿足以下條件:特別嚴重的狹窄(血管狹窄率≥90%)、高度不穩定的病變或罪犯血管經處理后仍存在持續心肌缺血證據[14]。
TARANTINI等[31]于2017年進行的一項包含10項研究(其中前瞻性研究9項、回顧性研究1項)、6 068例伴有CS的急性心肌梗死合并MVD患者的Meta分析結果顯示,與COR相比,CR可導致伴有CS的STEMI合并MVD患者近期(住院期間或PCI后30 d內)死亡風險升高〔OR=1.41,95%CI(1.15,1.71),P=0.008〕,但中遠期(PCI后6個月后)死亡風險并無統計學差異〔OR=1.02,95%CI(0.65,1.58),P=0.94〕。CULPRIT-SHOCK研究將來自歐洲83家中心的706例伴有CS的STEMI合并MVD患者隨機分為COR-PCI組(n=351)和ICR-PCI組(n=355),隨訪30 d結果顯示,COR-PCI組患者主要終點事件(包括全因死亡或需腎臟替代治療的腎衰竭)發生率明顯低于ICR-PCI組(45.9%比55.4%,P=0.01),全因死亡率亦明顯低于ICR-PCI組(43.3%比51.6%,P=0.03)[30];隨訪1年結果顯示,COR-PCI組患者因心力衰竭再次住院率高于ICR-PCI組〔5.2%比1.2%,RR=4.46,95%CI(1.53,13.04)〕,但兩組患者全因死亡率間無統計學差異〔50.0%比56.9%,RR=0.88,95%CI(0.76,1.01)〕[32],因此研究者認為,伴有CS的STEMI合并MVD患者急性期采用COR更為合理。需要指出的是,盡管近年來介入技術及藥物治療取得了很大進步,但與20年前SHOCK研究結果相比,伴有CS的STEMI合并MVD患者PCI后30 d內病死率并未明顯降低(46.7%比43.3%),因此仍需繼續探索更加有效的治療方法以改善此類患者預后,如簡化處理CS并及早行COR、及時啟動有效的機械循環支持等[33]。
5 小結與展望
對于不伴CS的STEMI合并MVD患者,多項隨機對照臨床試驗證實CR(包括ICR和SCR)優勢明顯并主要體現在較低的再次血運重建率及再住院率,但無論是前期的回顧性研究還是之后的多項多中心隨機對照臨床試驗均證實CR在減少死亡及再次心肌梗死等硬終點方面并無明顯優勢,而由于各研究樣本量、入選標準、研究方法、干預時機、干預標準等不盡相同,因此不伴CS的STEMI合并MVD患者的最佳PCI策略目前仍未達成共識。目前,正在進行的COMPLETE研究旨在比較COR與SCR對心因性死亡及心肌梗死等硬終點的影響并已完成了4 042例患者的招募,該研究結果可能有望給出COR與SCR孰優孰劣的答案;正在進行的另一項研究——COCUA研究[34]旨在比較ICR與SCR對STEMI合并MVD患者預后的影響,相信其研究結果的發布將會更好地指導臨床實踐。伴有CS的STEMI合并MVD患者死亡風險高、預后差,盡管目前多個指南推薦此類患者行ICR,但多項Meta分析及近期的CULPRIT-SHOCK研究卻得出了伴有CS的STEMI合并MVD患者急性期行COR可能更為合理的結論[30,32],因此仍需根據患者具體情況慎重地選擇PCI策略。需要注意的是,關于行SCR的STEMI合并MVD患者非罪犯血管CR的最佳時機目前僅有數項回顧性研究且樣本量均較小、結論各異,尚需更多的多中心隨機對照臨床試驗進一步證實;多項研究證實,在FFR指導下行PCI可能有助于改善STEMI合并MVD 患者預后[10,35-36],而正在進行的 COMPARE-ACUTE研究旨在比較C0R與FFR指導下的CR對STEMI合并MVD患者預后的影響,研究結果值得期待。

