纖溶酶原激活物抑制劑1在疾病中的研究進展
張虎 孫婧 李璐璐 董競成
復旦大學附屬華山醫院中西醫結合科,上海200040
纖溶酶原激活物抑制劑1(plasminogen activator inhibitor-1,PAI-1)是一種47 000的球狀單鏈糖蛋白,來源于絲氨酸蛋白酶抑制劑超家族,由379個氨基酸殘基組成,有3個β-折疊(A、B、C)和9個α-螺旋[1-2]。PAI-1基因存在多態性,其多態性(5G/4G)源于啟動子區一個鳥嘌呤的插入/缺失,而在4G/4G純合子基因的患者體內,PAI-1蛋白表達水平較高[3]。該蛋白可在多個組織和細胞類型中合成,如肝臟、脾臟、脂肪細胞、血小板、巨噬細胞、平滑肌細胞、成纖維細胞、腫瘤細胞和內皮細胞[4]。本文對PAI-1在與其相關聯疾病中的作用研究進行總結。
1 PAI-1簡介
PAI-1作為絲氨酸蛋白酶抑制劑基因家族的進化枝成員,是細胞周圍蛋白水解微環境的負調節因子之一。正常情況下,機體血凝塊中纖維蛋白溶解與細胞外周蛋白水解的作用受組織型纖溶酶原激活劑(tissue plasminogen activator,t-PA)和尿激酶型纖溶酶原激活劑(urokinasetype plasminogen activator,u-PA)調控。t-PA和u-PA通過激活纖維蛋白溶解蛋白酶(簡稱纖溶酶)對纖維蛋白、細胞外基質進行降解,防止血栓的產生。PAI-1是促凝血劑,與二者形成共價鍵,抑制纖溶酶的活性和細胞外基質的降解,并活化纖維蛋白,保證正常的凝血功能[5]。PAI-1還可通過與其他配體如細胞黏附蛋白、玻連蛋白結合來調節纖溶酶原的活性。作為體內纖溶系統的主要調控因子,PAI-1的病理生理作用涉及細胞遷移、血栓形成、血管新生,參與腫瘤、病態肥胖、糖尿病、動脈粥樣硬化等疾病的發展(圖1)[6]。

圖1 PAI-1的病理生理作用示意圖
2 PAI-1對相關疾病的影響
2.1PAI-1對血栓的影響 纖溶系統的平衡對于心血管疾病患者動脈內血栓的形成有著決定性作用。受細胞因子如IL-6、腫瘤壞死因子(tumor necrosis factor,TNF)和轉化生長因子β(transforming growth factor-β,TGF-β)等的影響,PAI-1表達上調,與t-PA、u-PA的動態平衡被打破,血管局部纖維蛋白降解受限制,沉積加重,同時增強內皮細胞血管黏附分子表達,加速血栓的形成[7]。早期在冠狀動脈組織的動脈粥樣病變中發現了PAI-1的高表達,ST段抬高的心肌梗死患者其5年內的病死率與PAI-1的表達升高有關[8-9]。在動物實驗中,PAI-1的升高與深靜脈血栓形成、冠狀動脈疾病、心肌梗死相關[10]。當小鼠敲除PAI-1后,其深靜脈血栓的消退速度明顯上升[11]。有學者通過對Toll樣受體4敲除小鼠制造主動脈縮窄病理模型用以檢測小鼠血栓形成。造模4周后,對照小鼠體內的PAI-1水平明顯升高,細胞黏附分子表達增加,核轉錄因子κB(nuclear factor-κB,NF-κB)活性增強,內皮型一氧化氮合酶磷酸化程度下降,小鼠血栓形成的加重可能與升高的PAI-1調控Toll樣受體4/NF-κB有關[12]。由肝臟和脂肪組織分泌釋放的PAI-1阻止纖維蛋白溶解,較近的研究報道皮下脂肪組織與內臟脂肪組織相比,表現出與高凝狀態具有更強的聯系,提示脂肪于解剖位置的沉積可影響血栓形成的類型,即內臟脂肪組織多與動脈血栓有關,而皮下脂肪組織傾向于形成靜脈血栓[13]。早期對嚙齒動物內臟脂肪組織的研究中,肥胖伴隨明顯PAI-1的表達上調[14]。與低水平PAI-1小鼠相比,高表達PAI-1可使其在更短的時間內實現完全動脈閉塞,說明PAI-1可能通過抑制纖維蛋白清除而增加血栓形成的風險[15]。并且接受Roux-en-Y胃旁路手術的過肥胖患者體內PAI-1水平明顯降低,現有研究常借促進肥胖機體內致炎細胞因子分泌對PAI-1與血栓的關系予以解釋[16]。
2.2PAI-1對糖尿病的影響 PAI-1抑制纖維蛋白溶解,除了參與血栓形成外,因其在脂肪細胞較高表達,研究發現PAI-1隨脂肪的上調而累積,與胰島素抵抗呈正相關[17-18]。2型糖尿病的發展與加速的血栓性并發癥有關,嚴重的腦血管疾病是導致患者死亡的主要原因。血栓性并發癥的患者體內出現高水平的PAI-1,而同樣的高表達在糖尿病模型小鼠體內得到驗證[19]。Zheng等[20]通過對182例2型糖尿病患者的血清相關細胞因子表達進行分析發現,糖尿病伴微血管病變患者體內PAI-1升高的同時伴隨著炎癥因子如C反應蛋白、IL-6等的升高,表明過量的PAI-1可能通過誘導炎癥促進內皮細胞功能障礙,提升促凝血因子表達,抑制纖維蛋白溶解,使組織纖維化。隨后Sultan等[21]通過10年長期臨床觀察,也同樣發現這一特點。有學者對1 391例1型糖尿病伴視網膜血管病變患者血清進行檢測,除C反應蛋白、IL-6升高外,細胞黏附分子和血管黏附分子的表達也顯著升高,進一步證明PAI-1可能通過誘發炎癥促進凝血功能參與糖尿病的發生、發展(圖2)[22]。Guo等[23]經對糖尿病小鼠予以脂聯素干預,發現其PAI-1、TGF-β1、纖連蛋白等細胞因子表達均減少,清除了血管緊張素Ⅱ的刺激作用,抑制小鼠腎纖維化標志物的表達并減緩小鼠腎小球硬化進展。微小RNA作為血小板反應性的重要分子標志物,具有協調病理生理狀態的作用。近期研究認為,miR-30c靶向于人類細胞中的PAI-1[24]。Luo等[25]由此細探miR-30c發現其主要表達于機體血小板,可直接靶向PAI-1的3'-UTR并對其表達產生負調節作用。高血糖環境可誘導miR-30c的抑制而增加2型糖尿病PAI-1的表達和血栓的形成。該學者使用lenti-miR-30c干預高脂喂飼的糖尿病模型小鼠發現PAI-1表達受到顯著抑制,小鼠動脈血栓形成所需閉塞時間有所延長。
2.3PAI-1與癌癥 作為纖維蛋白溶解系統的重要成員,PAI-1對急性血栓形成起著關鍵作用。雖然以往的研究主要集中于PAI-1在血栓形成中的作用,實際上越來越多的證據表明PAI-1在癌癥中的作用仍不可忽視[26]。研究表明,PAI-1通過參與腫瘤細胞入侵和轉移、血管新生,推動腫瘤的進展[27]。如在HCV肝硬化細胞中PAI-1基因表達上調,參與調控EGFR-ERK通路,使其下游MAPK激活炎癥因子和血管新生蛋白,促進肝癌的發展[28-29]。Pavon等[30]通過免疫組織化學分析發現PAI-1表達過高可增加頭頸癌轉移的風險,可能的機制為PAI-1誘導纖維蛋白沉積,在癌細胞周圍形成臨時細胞外基質,為細胞遷移提供支架,同時介導PI3K/Akt通路干預頭頸癌細胞的遷移。Takayama等[31]從血管新生角度出發,用PAI-1抑制劑SK-126反向研究惡性胸膜間皮瘤細胞,發現ERK1/2通路的活性受到抑制的同時,參與血管新生的相關細胞因子如血管內皮生長因子、堿性成纖維細胞生長因子、血小板衍生生長因子的表達下降。Kang等[32]發現PAI-1除了激活非小細胞肺癌細胞ERK1/2通路活性外,Caspase-3的活性受到抑制,缺氧誘導因子1β和Smad3的分泌與表達也相應增加(圖3)。
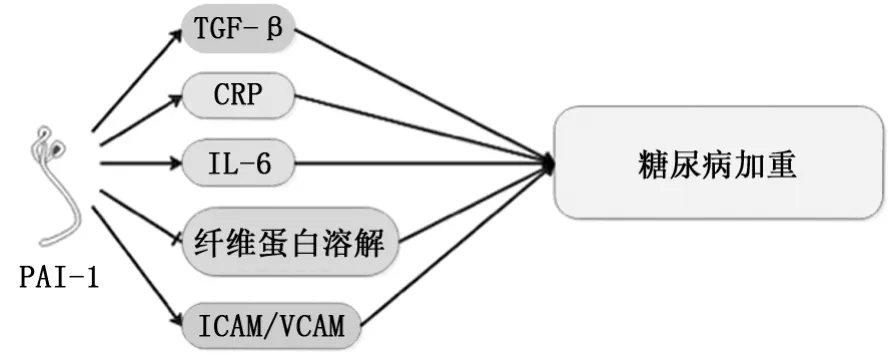
圖2 PAI-1對糖尿病的影響
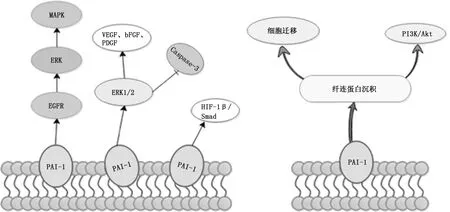
圖3 PAI-1對癌癥的影響
2.4PAI-1與呼吸系統疾病
2.4.1PAI-1與哮喘 哮喘是氣道的慢性炎性疾病,反復發作可引起氣道重塑。其特征在于可逆的氣流阻塞和支氣管的高反應性[33]。長期的慢性炎癥導致氣道損傷,凝血酶局部轉化纖維蛋白原為纖維蛋白,為正常氣道上皮修復所必需[34]。然而,在嚴重的哮喘中出現纖維蛋白含量的大幅增加可危及生命[35]。
報道指出,在過敏性哮喘患者痰液中PAI-1的含量明顯升高,且PAI-1水平的升高與肺功能不良有關[36];攜帶多態等位PAI-1基因的哮喘患者(4G/4G)則表現出比5G/5G機體更為嚴重的哮喘癥狀,表明PAI-1可能通過相關途徑參與哮喘的氣道重塑[37-38]。當小鼠PAI-1表達缺陷時,膠原和纖維蛋白在肺組織的沉積顯著減少,可降解細胞外基質的基質金屬蛋白酶(matrix metalloproteinase,MMP)在肺組織和支氣管肺泡灌洗液中的含量有所提高[39]。Cho等[40]以肥大細胞作為切入點進行研究發現,肥大細胞借由衍生的活性TGF-β1誘導IgE受體相交聯,增強支氣管上皮細胞產生更多的PAI-1加重氣道重塑。通過給哮喘模型小鼠喂飼PAI-1抑制劑TM5275發現小鼠支氣管肺泡灌洗液內嗜酸粒細胞數量和OVA-Ig E含量顯著減少。隨著OVA-Ig E水平的減少,受其調控分泌的IL-4、IL-5也相應減少。由于PAI-1可通過與細胞外基質蛋白玻連蛋白結合,使得其無法與u-PA受體作用,促進細胞遷移,加重氣道重塑[41]。隨后有學者進一步檢測認為PAI-1抑制劑改善哮喘氣道病變的潛在機制為阻斷PAI-1介導的炎性細胞遷移,具有較好的抗炎作用[42]。Tezuka等[43]運用屋塵螨對小鼠進行哮喘造模的同時予以新型PAI-1抑制劑IMD-4690干預。實驗結果表明IMD-4690可通過抑制tPA和PAI-1的結合來加速PAI-1的活性形式向非活性形式的轉化,減少肺中Th2細胞因子(包括IL-4、IL-5和IL-13等)和TGF-β的產生,通過提升MMP-9/TIMP-1的比率來抑制小鼠的氣道重塑而無明顯的不良反應。
2.4.2PAI-1與肺纖維化 肺纖維化是一種病因不明確,臨床以進行性呼吸困難和低氧血癥為主要特征的慢性、進行性間質性疾病。其病變表現早期為彌漫性肺泡炎,最終肺組織多為大量凋亡的上皮細胞、成纖維細胞、細胞外基質[44-45]。以往研究認為肺纖維化大多與TGF-β、TNF-α、MMP等有關,而纖溶酶和MMP可通過降解細胞外基質緩解病變進展[46]。
早在1996年已有研究發現肺纖維化與升高的PAI-1相關[47]。緊接著PAI-1被報道參與受輻射誘導的組織損傷和纖維化的過程如腎小球病變(血栓、腎小球硬化)[48]。隨著研究的不斷深入,PAI-1與肺纖維化的關系也漸漸清晰。如Ghosh和Vaughan[49]、Omori等[50]先后分別發現PAI-1通過促進細胞外基質沉積和上皮-間質轉化參與肺纖維化的發展,同時與TGF-β存在某種聯系。機體由于吸收放射治療的輻射常誘發肺炎并極易進一步發展為肺纖維化。Shioya等[51]對小鼠行胸部放療肺纖維化造模后發現支氣管肺泡灌洗液中PAI-1和TGF-β的含量顯著升高。而接受了抗TGF-β抗體干預的小鼠體內的輻射誘導的PAI-1水平減少,表明PAI-1可能作為TGF-β的下游效應器參與輻射誘導的組織纖維化的過程。
Shetty等[52]使用博來霉素干預小鼠進行肺纖維化造模發現,PAI-1和p53在肺泡上皮細胞中的表達均有提高,同時Sirt1表達減少伴隨p53的去乙酰化的增強以及miR-34a表達的升高,而這些變化在給予窖蛋白1結構域肽治療后可明顯改善。當小鼠敲除PAI-1基因后,miR-34a幾乎不表達。當miR-34a前體過表達時,即使未予以博來霉素,仍發現p53、PAI-1以及肺泡上皮細胞凋亡的提升。
2.4.3PAI-1與COPD COPD是一類以不完全可逆氣流受限和氣道重塑為特點的常見慢性炎癥性疾病。COPD氣道炎癥的發病機制尚未闡明,主要為吸煙或感染激活氣道炎癥細胞釋放炎癥介質,促進炎癥細胞在氣道的聚集、活化,病變可涉及全部氣道、肺實質及血管。
PAI-1調節細胞遷移,誘導細胞外基質降解引發炎癥參與肺纖維化的進展上文已詳述。早期有學者發現COPD患者痰中PAI-1的水平顯著升高,與肺功能呈負相關,與IL-8水平呈正相關[53]。隨后Renckens等[54]發現在健康小鼠肺中過表達PAI-1可導致肺中TNF-α、IL-6、干擾素γ及KC表達的增加。IL-8和LTB4是COPD較為重要的炎癥標志物,它們在痰中的濃度可在一定程度上反映疾病進展[55-56]。PAI-1被報道可直接體外調節IL-8、LTB4的表達,在暴露于香煙提取物或脂多糖后,siRNA靶向轉染PAI-1后,與未轉染的受暴露肺泡上皮細胞相比,其IL-8水平仍增加。雖相關機制尚不清楚,實驗結果表明抑制PAI-1的合成可在一定程度上減弱炎癥因子的表達[57]。Waschki等[58]對COPD患者檢測甘油三酯、高密度脂蛋白膽固醇、血壓、超敏C反應蛋白等代謝和心血管指標后,發現患者表達高水平PAI-1的同時,在不同程度上均具有高甘油三酯血癥和全身炎癥,由于甘油三酯和超敏C反應蛋白的升高對心血管疾病的發展起著重要作用,故認為PAI-1的升高不僅參與氣道重塑,還有可能增加潛在誘發心血管疾病的風險。
組蛋白去乙酰酶2(histone deacetylase 2,HDAC2)作為調節致炎基因表達以預防過量炎癥應激的蛋白,其過表達可抑制脂多糖誘導的大鼠肺支氣管發育不良[59]。其也能通過c-Jun/PAI-1途徑減弱脂多糖誘導的PAI-1、TNF、人巨噬細胞炎性蛋白2的表達調節炎癥[60]。To等[61]在COPD患者痰液檢測到升高的PAI-1和NF-κB DNA結合活性,但是二者無明顯的關聯性。接著作者將siRNA HDAC2轉染至A549細胞中并予以TNF-α誘導發現,PAI-1的表達水平與未轉染的細胞相比顯著升高。當A549細胞給予HDAC2抑制劑SC514時得出與轉染同樣的實驗結果。NF-κB的活性被報道隨COPD發展而升高,NF-κB p65作為HDAC2的潛在去乙酰化靶點,作者用TNF-α處理敲除HDAC2的A549細胞后,檢測乙酰化NF-κB與總NF-κB的比值。敲除了HDAC2的A549細胞乙酰化NF-κB顯著升高,即比值大于對照組。以上結果表明HDAC2可調控受PAI-1激活NF-κB而誘發的COPD,PAI-1可作為調控NF-κB相關炎癥的生物標記物參與COPD的病程發展(圖4)。

圖4 PAI-1對呼吸疾病的影響
3 展望
PAI-1通過調控細胞遷移、血管新生、抑制纖溶酶參與多類炎癥性疾病,但相關研究多聚焦于心血管、腫瘤、糖尿病類疾病,而對于呼吸系統疾病的研究仍有待進一步深入突破。以氣道炎癥和重塑為主要特征的COPD,其炎癥反應的特點為NF-κB的活化和HDAC2活性受損,有學者發現中藥相關提取物可通過調控NF-κB和HDAC2的活性以干預COPD的進展。PAI-1也被報道在參與COPD的進展中,與HDAC2存在負相關的活性關系。因此,從中藥復方或相關提取物角度切入,選擇性地敲減PAI-1或HDAC2進行病理造模,觀察二者的聯系;或運用激動劑或抑制劑進行干預檢測,對調節COPD進展和研究COPD發展的作用機制具有深遠意義。
利益沖突所有作者均聲明不存在利益沖突

