晚期非小細胞肺癌患者腫瘤突變負荷與靶向治療療效相關性
童 琳,丁 寧,李佳旻,徐曉波,張 勇,葉茂松,李 春,張 新,洪群英,周 建,白春學,胡 潔
復旦大學附屬中山醫院呼吸科,上海市呼吸病研究所,上海 200032
腫瘤突變負荷(tumor mutational burden, TMB)是免疫檢查點(如PD-1/PD-L1)抑制劑治療晚期肺癌療效的預測生物標志物之一[1-4]。多項臨床研究[5-8]采用二代測序技術(next-generation sequencing, NGS)檢測腫瘤組織的TMB,發現實體瘤患者免疫治療的生存獲益與高TMB相關。有研究[9]發現,在表皮生長因子受體(epidermal growth factor receptor, EGFR)突變患者中,EGFR-酪氨酸激酶抑制劑(TKIs)治療的療效和預后與TMB密切相關,但與免疫治療的情況相反,即高TMB患者經EGFR-TKI治療后的總生存期和至治療停止時間(TTD)均較中低TMB患者縮短。
約20%的非小細胞肺癌(NSCLC)患者具有EGFR敏感突變,包括常見的19外顯子缺失、L858R,以及罕見的L861Q、G719S等。EGFR-TKIs靶向治療能改善晚期肺癌患者的預后,提高中位無進展生存期(PFS)至12個月,客觀緩解率達70%[10]。在具有間變性淋巴瘤激酶(ALK)融合基因(約5%NSCLC患者)、活性氧簇-1(ROS-1)融合基因(約1%NSCLC患者)、Met 14外顯子跳躍式突變(約4%NSCLC患者)等驅動突變的晚期肺癌患者中,克唑替尼治療的客觀緩解率可達60%,中位無進展生存期(PFS)為7~19個月[11-15]。然而,不同患者間TKIs治療的緩解持續時間存在較大差異,目前尚缺乏提示其療效的預測標志物。因此,本研究采用靶向富集目標基因NGS技術,對晚期肺癌患者的腫瘤組織標本進行包含416個腫瘤相關基因的檢測,分析腫瘤組織TMB水平與TKIs靶向治療療效的相關性。
1 資料與方法
1.1 一般資料 納入2016年1月~2018年1月在復旦大學附屬中山醫院接受一線TKIs靶向治療,存在敏感驅動突變的51例亞裔晚期NSCLC患者。主要入選標準:(1)年齡>18歲;(2)經支氣管鏡或經皮肺穿刺原發灶活檢,確診為原發性非小細胞肺癌;(3)經全身影像學檢查,根據國際肺癌研究協會(IASLC)第8版肺癌TNM分期評估為ⅢB~Ⅳ期肺癌;(4)予一線 TKIs靶向治療,包括一代或二代EGFR-TKIs和克唑替尼;(5)能夠提供足夠的腫瘤組織標本進行NGS。主要排除標準:(1)患有除原發性肺癌外的其他惡性腫瘤;(2)懷孕。本研究經復旦大學附屬中山醫院倫理委員會審核批準(B2016-154R),所有患者均簽署知情同意書。
最終本研究共納入51例晚期肺癌患者,中位年齡為61歲(28~71歲),其中27例(53%)為女性,41例(80%)無吸煙史。病理診斷:腺癌44例(86%),腺鱗癌3例(6%),鱗癌3例(6%),病理類型不確定的非小細胞肺癌(NSCLC-NOS)1例(2%)。中位隨訪時間為18個月。患者一般情況見表1。

表1 患者一般情況
NSCLC-NOS:病理類型不確定的非小細胞肺癌;EGFR-TKIs:表皮生長因子受體-酪氨酸激酶抑制劑;ECOG-PS:美國東岸癌癥臨床研究合作組織-體力狀況評分
1.2 基因檢測 收集51例患者的支氣管鏡或經皮肺穿刺活檢腫瘤組織標本,送南京世和基因生物技術有限公司進行NGS檢測。同時采集靜脈血用于陰性對照,以判斷種系突變。
1.2.1 樣本處理 腫瘤標本:取經甲醛固定和石蠟包埋(FFPE)的腫瘤組織6~10 μm(n≥5),用蘇木精-伊紅(H-E)染色后,由病理專家判斷其中腫瘤細胞含量;采用腫瘤細胞含量大于10%的組織。血漿樣本:用EDTA抗凝管收集8~10 mL外周血,于2 h內分離血漿(1 800 ×g,離心10 min),白細胞沉淀用于陰性對照。
1.2.2 DNA提取和文庫準備 采用Qiagen公司試劑盒提取組織和白細胞DNA。測序文庫使用KAPA Hyper Prep試劑盒(KAPA Biosystems)進行制備。PCR擴增和文庫純化后進行目標基因富集。
1.2.3 目標基因富集和測序 DNA文庫加標簽后,將多個樣本混合,得到總量為2 μg的DNA混合文庫。用定制的生物素型DNA探針(GeneseeqOneTM),對文庫中416個癌癥相關基因的編碼區域和16個基因的內含子進行雜交、捕獲。用Illumina p5、p7引物和KAPA HiFi HotStart ReadyMix (KAPA Biosystems)對文庫DNA進行擴增,富集得到的文庫在HiSeq4000(Illumina)平臺上用2×150 bp測序試劑盒(Illumina)進行測序。
1.3 測序數據處理 用Trimmomatic 25軟件對測序數據進行過濾,去除低質量堿基或N堿基,并通過BWA(Burrows-Wheeler Aligner)將過濾后的數據與參考序列hg19基因組(Human Genome version 19)對比。采用GATK(Genome Analysis Toolkit)分析單核苷酸變異(SNV)和插入缺失突變(indel);經單核苷酸多態性數據庫(dbSNP)和國際千人基因組計劃分析后去除常見變異。
1.4 TMB計算及分組 TMB定義為編碼區1 Mb堿基中所含有的腫瘤特有突變的個數。將腫瘤樣本與白細胞數據進行比對,分析體細胞突變,去除種系突變。TMB包括編碼區域SNV(含錯義突變和同義突變)和插入缺失突變,而去除原發性肺癌中驅動基因突變和常見抑癌基因的截短突變和移碼突變。根據Offin等[9]研究,采用三分法將51例患者分為高TMB組(TMB≥8)和中低TMB組(TMB<8)。

2 結 果
2.1 兩組患者的基本資料及基因突變情況比較 51例患者的中位TMB水平為6.2個突變/Mb。高TMB組患者的中位TMB為10.6個突變/Mb,中低TMB組患者的中位TMB為3.7個突變/Mb。兩組患者的一般情況差異無統計學意義(表1)。兩組患者的基因突變情況見表2。

表2 患者的基因突變信息
EGFR:表皮生長因子受體;ALK:間變性淋巴瘤激酶;HER2:人表皮生長因子受體-2;TMB:腫瘤突變負荷
2.2 TP53基因突變對TMB的影響 高TMB組患者合并TP53突變的頻率(50%)較中低TMB組(40%)高(表2)。TP53突變患者的TMB與野生型差異無統計學意義(圖1)。

圖1 TP53突變對腫瘤組織TMB的影響
2.3 吸煙對TMB的影響 高TMB組患者中有吸煙史的患者占比高于(37%)中低TMB組(11%,表1)。有吸煙史患者的TMB高于無吸煙史患者(P=0.046,圖2)。

圖2 吸煙對組織TMB的影響
2.4 TMB與TKIs靶向治療療效的關系 Log-rank分析(圖3A)顯示:中低TMB組患者的中位PFS顯著長于高TMB組患者(410 dvs217 d,HR=0.331,95% CI 0.165~0.665,P=0.001 2)。亞組分析(圖3B)顯示:在男女性、有無吸煙史、合并TP53基因突變與否患者中,中低TMB組患者的中位PFS均長于高TMB組患者(P<0.05);在腺癌、EGFR突變、EGFR 19外顯子缺失、EGFR L858R患者中,中低TMB組患者的中位PFS均長于高TMB組患者(P<0.05);在非腺癌患者中,中低TMB組患者的中位PFS有長于高TMB組患者的趨勢(HR=0.286,95%CI 0.05~1.77,P=0.15)。Log-rank分析(圖3C)顯示:在EGFR突變患者中,經EGFR-TKIs治療后,中低TMB組患者的中位PFS長于高TMB組患者(410 dvs189 d,HR=0.256,95% CI 0.108~0.608,P=0.002)。
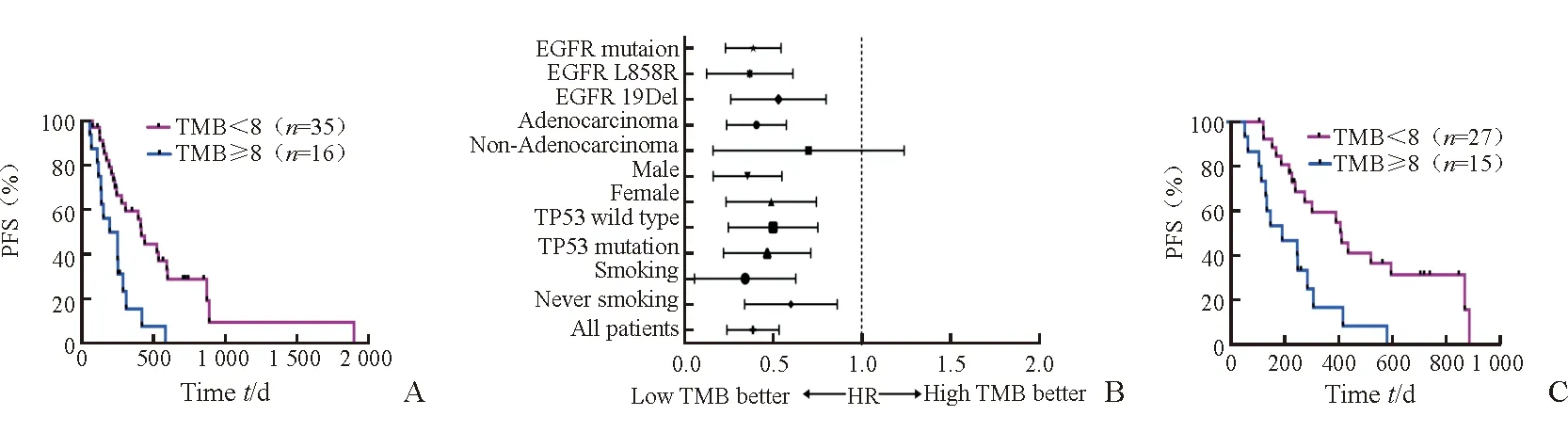
圖3 TMB與患者PFS的相關性
3 討 論
目前認為在免疫治療中,高TMB與治療反應的關系是基于增加的腫瘤特異性新生抗原負荷。而在靶向治療中,高TMB水平可能與耐藥通路增加或腫瘤亞克隆導致臨床耐藥相關。Offin等研究[9]發現,EGFR突變患者中,EGFR-TKIs的療效、患者預后與TMB密切相關,與免疫治療情況相反。然而,這項研究中僅納入了EGFR 19外顯子缺失和L858R突變的Ⅳ期肺癌患者,且其中92%的患者接受了厄洛替尼治療,因此該結論可外推的范圍有限。此外,該研究的療效衡量指標采用TTD,而由于多數采用靶向治療的患者在疾病緩慢進展時仍繼續使用TKIs,因此TTD與PFS在靶向治療的療效評估中存在一定差異。本研究采用PFS作為靶向治療療效的評估指標,且包括ⅢB~Ⅳ期患者,同時納入了EGFR突變(包括非常見EGFR突變)及 ALK融合、ROS-1融合等相對少見突變類型的患者,治療藥物包括一代及二代EGFR-TKIs(吉非替尼、厄洛替尼、埃克替尼、阿法替尼)和克唑替尼。因此本研究更貼近真實世界情況,結論的可外推范圍更廣。
Offin等[9]發現,TP53突變與疾病至進展時間短有關,高TMB組患者中TP53突變者的比例高于中低TMB組,但多因素分析中校正TP53突變狀態后仍顯示高TMB水平與患者預后差相關。本研究結果與該研究相一致,提示合并TP53突變對TMB預測TKIs在晚期肺癌患者中的療效無明顯影響。
本研究結果提示,在具有敏感驅動突變的晚期肺癌患者中,中低TMB組患者靶向治療PFS較高TMB組患者明顯延長,且在亞組分析中得出了相似結論,提示TKIs靶向治療對中低TMB組患者的療效優于高TMB組患者。然而,本研究尚存在一定缺陷,包括:缺乏總生存期數據,無法分析TMB與預后的關系;非前瞻性研究;樣本量較少等。今后需進一步設計前瞻性臨床研究,并擴大研究隊列的樣本量,以進一步驗證本研究結論。

