稀土元素Pr摻雜對ZnO材料結構及光催化性能的影響
范榮桂,白麗影,湯家喜,楊果
(1.遼寧工程技術大學 環境科學與工程學院,遼寧 阜新 123000;2.遼寧工程技術大學 材料科學與工程學院,遼寧 阜新 123000)
工業廢水中的有毒有害、難降解的有機污染物對人類健康和生態環境造成危害引起人們的高度關注,尤以酚類化合物的毒害作用最大[1],因此,含酚廢水排入自然水體環境之前必須進行有效處理[2-5]。采用半導體為光催化劑的光催化處理技術成為國內外含酚廢水治理領域的熱點之一[6-7]。其中,光催化劑ZnO作為一種新興半導體,具備原料來源豐富、綠色環保及成本低廉等優點[8-11],且ZnO較TiO2表現出更高的光催化效率和更強的量子效率,更有利于治理環境污染[12-13]。但由于ZnO存在吸收波段短、光生電子-空穴易復合等缺點,較大程度上降低了光催化效率[14]。有研究表明,離子摻雜等方法可對ZnO光催化材料進行改性和修飾[15-20],其中稀土元素摻雜ZnO可使其吸收更多電子,減少光生電子-空穴的復合,從而提高氧化還原能力[21-27]。
本文采用溶膠-凝膠法制備了稀土元素Pr摻雜ZnO系列光催化材料,用XRD、SEM、EDS等檢測手段對其結構、表面形貌進行了表征,并用亞甲基藍和含酚廢水為實驗降解物,研究稀土元素Pr摻雜ZnO光催化材料在紫外光照射下的光催化性能。
1 實驗部分
1.1 試劑與儀器
檸檬酸、硝酸鋅、硝酸鐠、苯酚、間苯二酚、亞甲基藍均為分析純;氣相二氧化鈦P25,工業品。
6100型X射線衍射儀;SSX-550型場發射掃描電鏡;6100型X射線衍射能譜儀;ME204E型電子天平;SX2-4-10GJ型箱式電阻爐;HH-2型數顯恒溫水浴鍋;WGL-65B型電熱鼓風干燥箱;HJ-2A型磁力加熱攪拌器;UV-1800型紫外-可見分光光度計;YZ-GHX-A型光化學反應儀;TG16-WS型臺式高速離心機。
1.2 光催化劑的制備
1.2.1 ZnO光催化劑的制備 采用溶膠-凝膠法制備ZnO光催化劑。配制0.02 mol/L的Zn(NO3)2·6H2O溶液(反應液A)和相同濃度的檸檬酸溶液(反應液B),將反應液A與B混合后磁力攪拌3 h,形成溶膠。將其置于干燥箱內,80 ℃下保溫12 h,形成無水粘稠狀凝膠。之后升溫至130 ℃,保溫24 h,凝膠脫水膨化,得到前驅體。將此前驅體研磨成粉末,置入馬弗爐中,于600 ℃燒結2 h,冷卻至室溫后再次研磨,獲得ZnO粉末。
1.2.2 Pr摻雜ZnO光催化劑的制備 按摩爾比n(Pr)∶n(ZnO)=0.01∶0.99,0.02∶0.98,0.03∶0.97,0.04∶0.96,0.05∶0.95分別稱取適量的Pr(NO3)3·6H2O和Zn(NO3)2·6H2O加入到對應濃度的檸檬酸反應溶液B中,按ZnO光催化劑制備的方法制得Pr摻雜的ZnO光催化劑,分別記為Zn0.99Pr0.01O、Zn0.98Pr0.02O、Zn0.97Pr0.03O、Zn0.96Pr0.04O、Zn0.95Pr0.05O。
1.3 光催化降解實驗
將0.05 g催化劑加入到50 mL濃度0.010 g/L的亞甲基藍溶液中,于暗處攪拌30 min。將混合溶液在攪拌的狀態用15 W紫外燈照射150 min,每間隔30 min取1次樣,將取出懸浮液離心10 min(轉速3 500 r/min)分離后,測定上清液吸光度,得到亞甲基藍溶液的濃度。計算亞甲基藍的降解率(η)。
式中C0——亞甲基藍溶液的初始濃度,mg/L;
Ct——t時刻亞甲基藍溶液的濃度,mg/L;
A0——初始時刻亞甲基藍溶液在最大吸收波長處的吸光度;
At——t時刻亞甲基藍溶液在最大吸收波長處的吸光度。
樣品對苯酚和間苯二酚的降解反應和上述操作相同,只需將50 mL濃度為0.010 g/L的亞甲基藍溶液換成50 mL濃度為1.0 g/L的苯酚溶液和間苯二酚溶液。
1.4 亞甲基藍標準曲線的繪制
準確配制濃度為0.005,0.010,0.015,0.020,0.025 g/L的亞甲基藍溶液。
對亞甲基藍溶液進行紫外可見分光光譜掃描,確定亞甲基藍的最大吸收波長為λ=664 nm,見圖1a。
將五組不同濃度的溶液置于10 mm石英比色皿中,以離子水進行空白校正,采用紫外-可見分光光度計測定其吸光度(波長為664 nm)。以濃度和吸光度作圖,得到亞甲基藍標準曲線,見圖1b。
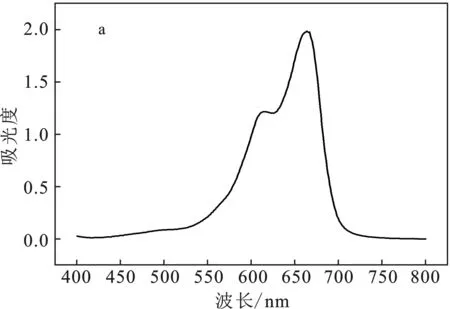
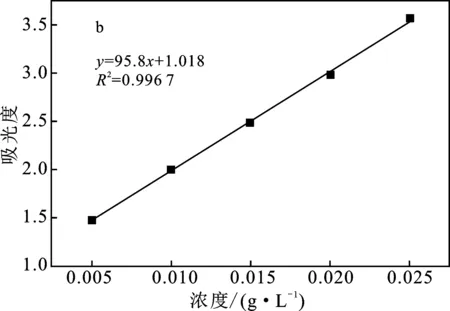
圖1 亞甲基藍溶液紫外可見下的最大吸收波長(a)與標準曲線圖(b)Fig.1 Maximum absorption peak of methylene blue solution under ultraviolet light (a) and standard curve (b) of methylene blue solution
2 結果與討論
2.1 光催化劑表征
2.1.1 XRD分析 樣品的XRD見圖2。
由圖2a可知,純ZnO的XRD各衍射峰與標準卡片(JCPDS No.70—2551)的衍射峰匹配度較佳,分別對應ZnO的 (100)、(002)、(101)、(102)、(110)、(103)、(200)、(112)、(201)、(004)和(202)晶面。由圖2b可知,隨著稀土元素Pr含量的增加,在2θ=29°左右出現了一個小的Pr2O3特征峰。此外,譜線基線背底平整,衍射峰形尖銳,表明樣品結晶良好,晶體結構較完整。
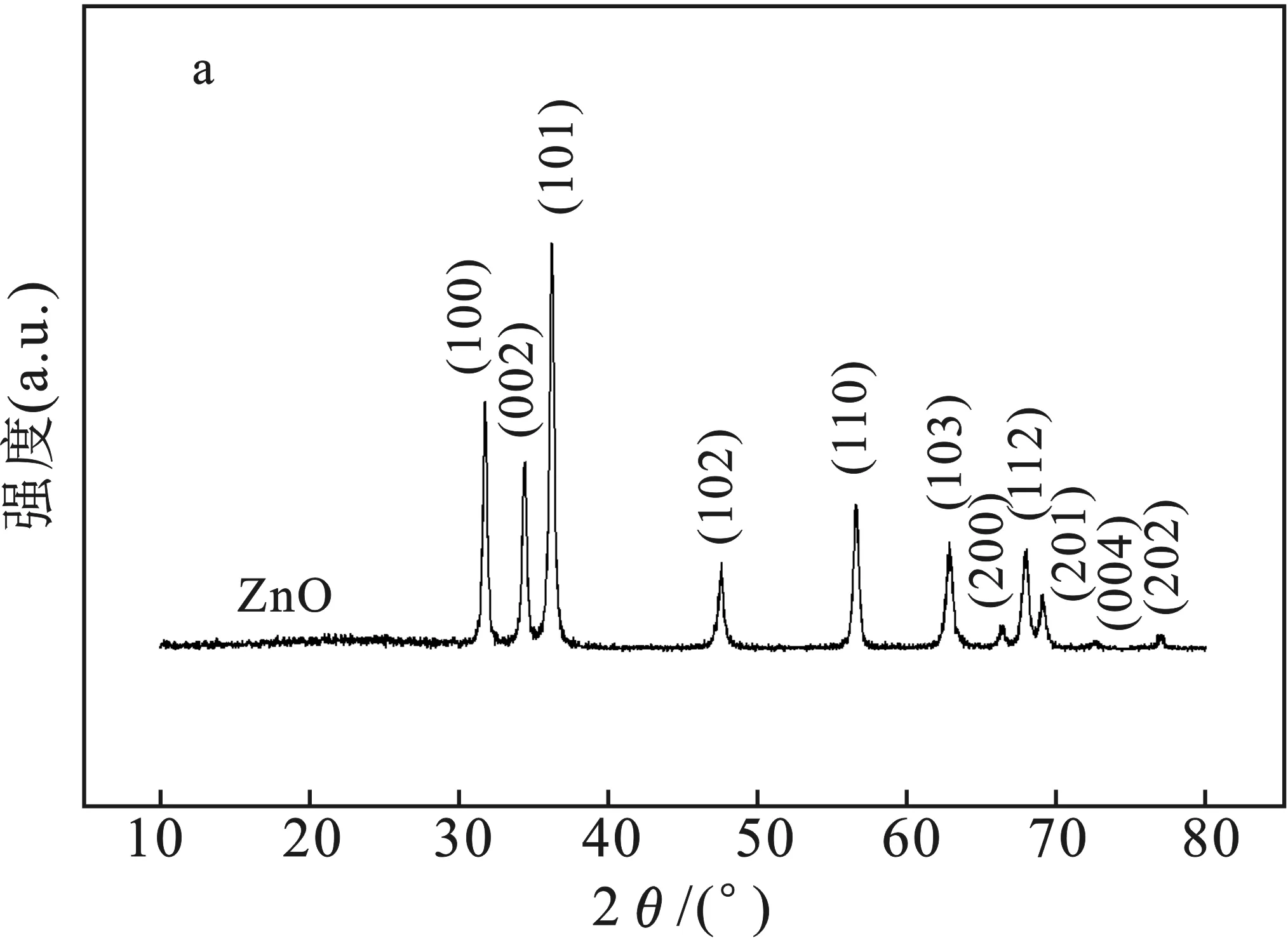
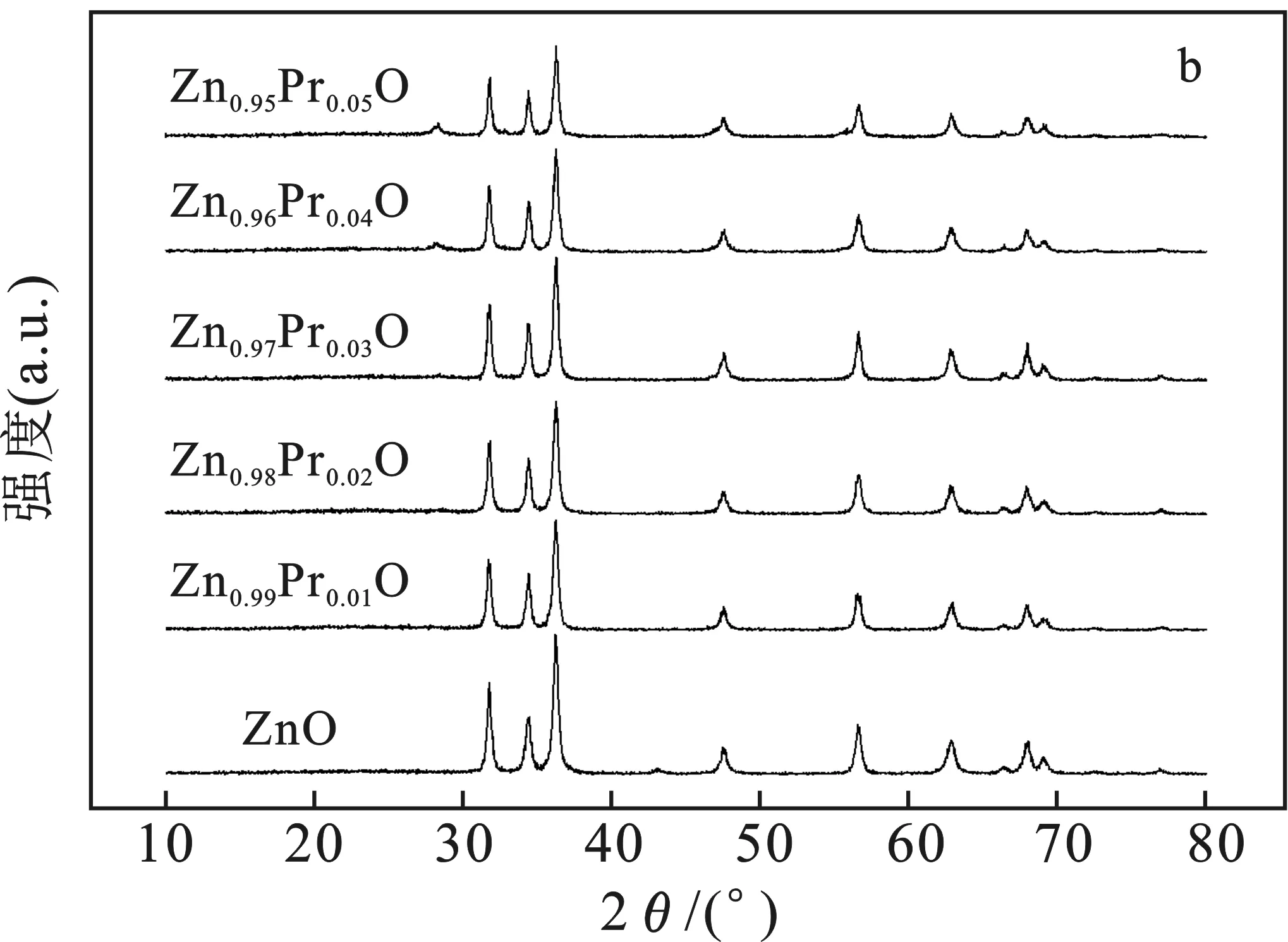
圖2 樣品的XRD圖譜Fig.2 XRD patterns of samples
2.1.2 表面形貌和元素定量分析 由圖3可知,樣品ZnO中的元素Zn和元素O呈均勻分布,證明溶膠-凝膠法成功地制備了ZnO光催化材料。由圖4可知,純ZnO表面的顆粒團聚在一起,形成片狀結構。隨著稀土元素Pr摻入,樣品表面的顆粒團聚現象減弱,其中樣品Zn0.97Pr0.03O表面的顆粒分散最為明顯,當稀土元素Pr的摻雜量繼續增加時,樣品表面又會出現顆粒團聚的趨勢。由圖5可知,樣品Zn0.99Pr0.01O、Zn0.98Pr0.02O、Zn0.97Pr0.03O、Zn0.96Pr0.04O、Zn0.95Pr0.05O中均有痕量的稀土元素Pr摻入,且高度分散在ZnO的表面,證明摻雜有效。

圖3 樣品ZnO中Zn 元素(a)與O 元素(b)的EDS分層圖像Fig.3 EDS stratified image of Zn element (a) and O element (b) in sample ZnO

圖4 樣品ZnO(a)、Zn0.99Pr0.01O(b)、Zn0.98Pr0.02O(c)、Zn0.97Pr0.03O(d)、Zn0.96Pr0.04O(e)、Zn0.95Pr0.05O(f)的SEM圖Fig.4 SEM images of ZnO(a),Zn0.99Pr0.01O(b),Zn0.98Pr0.02O(c),Zn0.97Pr0.03O(d),Zn0.96Pr0.04O(e),Zn0.95Pr0.05O(f)

圖5 樣品Zn0.99Pr0.01O(a)、Zn0.98Pr0.02O(b)、Zn0.97Pr0.03O(c)、Zn0.96Pr0.04O(d)、Zn0.95Pr0.05O(e) 中Pr元素的EDS分層圖像Fig.5 EDS stratified image of Pr element in sample Zn0.99Pr0.01O(a),Zn0.98Pr0.02O(b), Zn0.97Pr0.03O(c),Zn0.96Pr0.04O(d) and Zn0.95Pr0.05O(e)
由表1可知,隨著稀土元素Pr的加入,摻雜元素Pr的ZnO光催化材料的晶粒尺寸先減小后增大,樣品Zn0.97Pr0.03O的晶粒尺寸最小。覆蓋在ZnO表面的過多的稀土元素會使ZnO的晶粒尺寸增大。因此,稀土元素Pr的加入有助于抑制ZnO晶粒尺寸的增大。

表1 樣品的平均晶粒尺寸Table 1 Average crystalline size of samples
EDS元素定量分析結果列于表2中。EDS元素分析結果采用SPSS 13.0軟件進行配對t檢驗,P<0.05,差異有統計學意義。

表2 樣品中的EDS元素定量分析結果Table 2 Quantitative analysis results ofEDS elements in samples
由表2可知,樣品中除必要元素O、Zn、Pr外沒有其他雜質元素,且隨著稀土元素Pr的增加,樣品中的原子百分比表現為O元素含量持續上升,Zn元素含量持續下降。盡管稀土元素Pr的百分比僅由0.49%~2.47%,但在催化劑表面仍以Pr2O3形式存在;結合XRD分析結果可知,氧化物Pr2O3均勻分散在ZnO表面。
2.2 光催化性能分析
2.2.1 亞甲基藍降解實驗 以紫外光照射下的亞甲基藍降解實驗來測試樣品的光催化性能,結果見圖6。
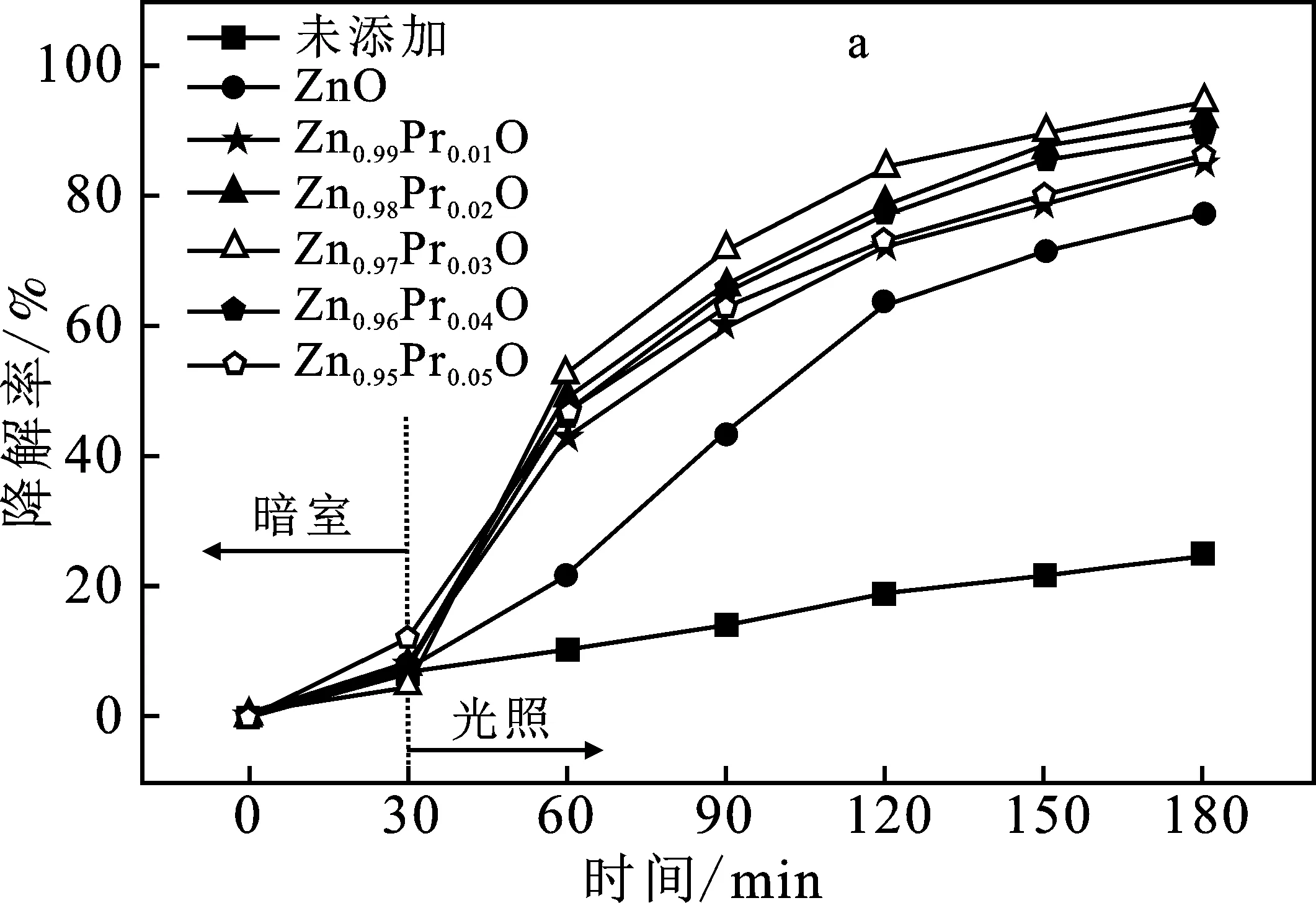
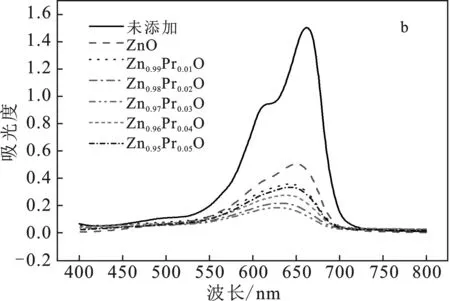
圖6 樣品對亞甲基藍溶液的降解效率圖(a)和紫外燈照射150 min的紫外可見分光光譜圖(b)Fig.6 The degradation efficiency of the sample on the methylene blue solution(a) and the UV-visible spectroscopic spectrum 150 min of UV lamp irradiation(b)
由圖6a可知,亞甲基藍的降解效率隨稀土元素Pr含量的增加而先增大后減小,當摩爾比為n(Pr)∶n(ZnO)=0.03∶0.97時,制得Zn0.97Pr0.03O的降解效率最高,在150 min時降解率可高達94.5%;當稀土元素Pr含量過大時,可造成光生電子和空穴點距離縮短,更易發生復合[28]。另外,會發生大量的Zn-O-Pr元素鍵合,使得表面氧空位減小,降解效果變差,而且因覆蓋在ZnO表面過多的稀土元素而使ZnO的晶粒尺寸增大[29]。同等實驗條件下,純ZnO在150 min對亞甲基藍溶液的降解效率為71.3%,商業光催化劑P25(氣相二氧化鈦) 的降解效率為92.1%,而不加任何催化劑的亞甲基藍溶液,在150 min的降解效率僅有24.7%。由此可見,樣品Zn0.97Pr0.03O的催化性能比純ZnO優異,甚至比商業光催化劑P25的催化性能還好。
由圖6b可知,當反應進行150 min時,樣品Zn0.97Pr0.03O的吸收光譜峰值最低,與純ZnO和不加催化劑的亞甲基藍溶液吸收光譜中的峰差距明顯。
2.2.2 含酚廢水降解實驗 稀土元素Pr摻雜的ZnO催化劑對苯酚和間苯二酚的光催化降解效率見圖7。
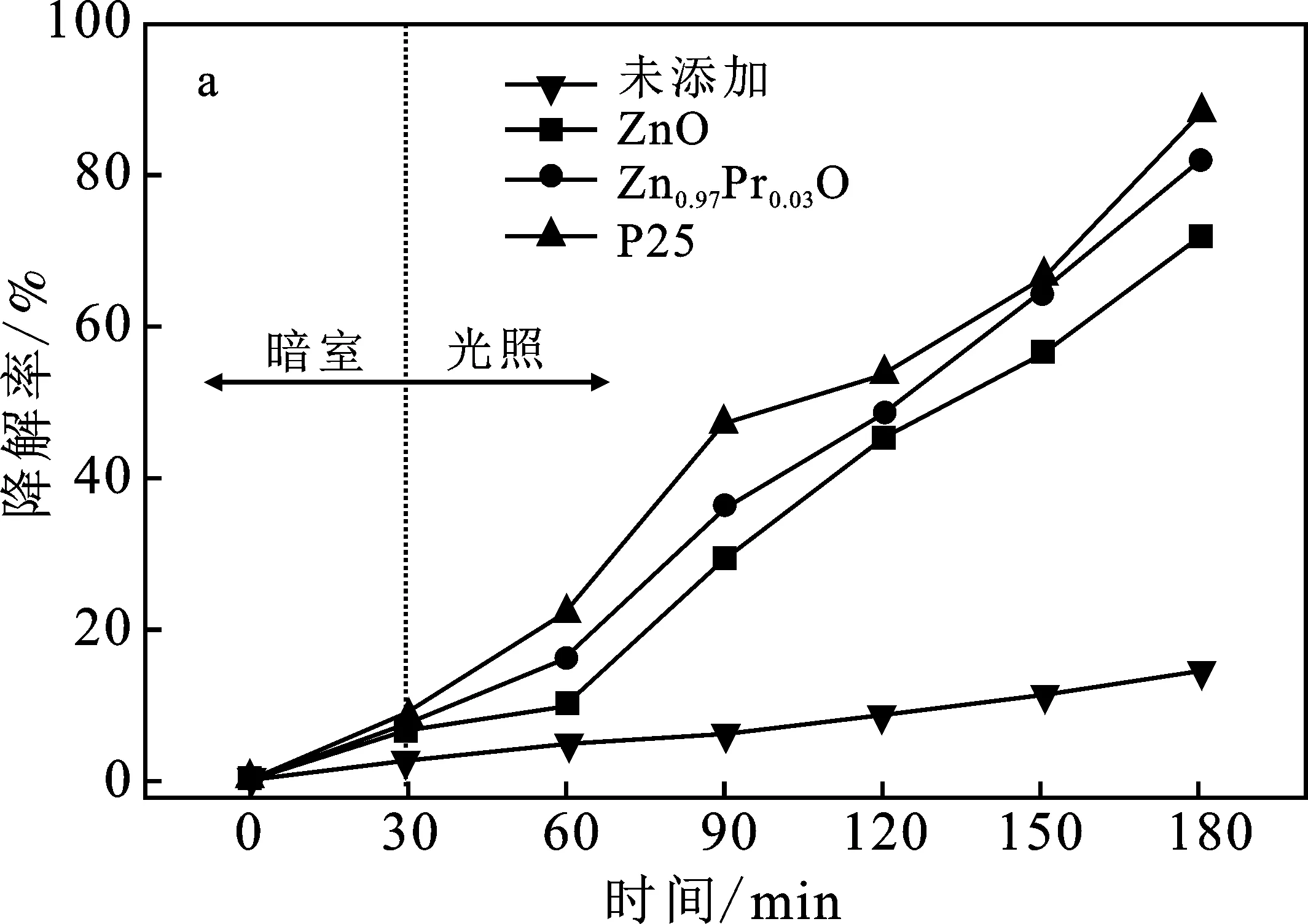

圖7 樣品對苯酚溶液(a)和間苯二酚溶液(b)的降解效率圖Fig.7 The degradation efficiency of the sample to the phenol solution(a) and the resorcinol solution(b)
由圖7可知,在暗室中進行反應時,苯酚溶液和間苯二酚溶液幾乎沒有得到降解。催化反應在紫外光照射下進行時,含有催化劑的苯酚溶液和間苯二酚溶液的降解性能得到大幅度提高,其中Zn0.97Pr0.03O的催化效果明顯優于純ZnO的催化效果。由圖7a可知,紫外光照射150 min后,Zn0.97Pr0.03O對苯酚溶液的降解效率為82.2%,而商業光催化劑P25對苯酚溶液的降解效率為88.5%,制備催化劑對苯酚的降解效率略低于P25。由圖7b可知,紫外光照射150 min后,Zn0.97Pr0.03O對間苯二酚溶液的降解效率為91.5%,P25的降解效率為92.6%,兩者均具有良好的降解效果。因此,所制備的稀土元素Pr摻雜的ZnO催化劑對模擬含酚廢水的光催化降解效果與商業光催化劑P25相比基本相當,具有一定的應用前景。
稀土元素Pr摻雜能影響ZnO催化活性的原因可能是:①晶粒尺寸會直接影響催化活性。稀土元素Pr摻雜降低了ZnO的晶粒尺寸,會使得光催化的比表面積增大,光生電子-空穴的擴散時間縮短,從而有利于提高光催化活性[29-30];②半導體粒子表面氧空位和缺陷也會影響光催化過程。稀土元素Pr均勻分布在ZnO的表面,增加了光催化劑表面的氧空位,有助于提高光催化活性[31];③稀土元素Pr的摻雜拓寬了光催化材料的光吸收范圍,當稀土元素摻雜量過多時,過量的稀土元素Pr就會沉積在ZnO表面,反而會阻礙光催化反應的進行,引起ZnO光催化活性的降低[32]。
3 結論
(1)稀土元素Pr的摻雜能細化ZnO的晶粒,且以Pr2O3形式高度分散在ZnO的表面,增加了光催化劑表面的氧空位,有助于提高光催化活性。
(2)在對亞甲基藍溶液的光催化降解中,摻雜的最佳摩爾比為n(Pr)∶n(ZnO)=0.03∶0.97,其對亞甲基藍的降解效率可達94.5%,較單一ZnO光催化劑的降解效率提高了32.5%。
(3)制備的Zn0.97Pr0.03O光催化劑對模擬苯酚廢水同樣有效,其降解效果與商業P25基本相當,說明Pr摻雜的ZnO制備的光催化劑具有潛在的商業價值。

