金花葵花總黃酮的微膠囊條件優化及其對冷鮮肉保鮮作用的研究
王菲,于蘇琦,宋力,侯雨歌
(遼寧石油化工大學 化學化工與環境學部,遼寧 撫順 113001)
金花葵花黃酮是一種安全、無毒、易制備的生物活性物質,具有較好的抗氧化和抗菌等活性[1]。但若直接作為生物保鮮劑使用,其穩定性稍差,且保鮮時間較短,實際應用受到極大限制。
冷鮮肉含豐富營養,但冷鮮肉如何保鮮成為業界面臨的難題[2]。冷鮮肉富有水分,長時間、無任何措施的放置會出現干癟、腐爛等狀況,造成嚴重浪費。通過微膠囊技術可以在一定程度上保護活性物質不受外界不良因素(如光、熱等)的影響[3-4],穩定性高、緩釋性好、產率高、保鮮效果理想,可控制水分流失,抑制微生物生長與繁殖,延緩冷鮮肉發生腐敗變質。
1 實驗部分
1.1 試劑與儀器
金花葵花,由遼寧恒生實業集團有限公司提供;新鮮豬后腿肉,市售;蘆丁標準品,色譜純;無水乙醇、鹽酸、硝酸鋁、氫氧化鈉、亞硝酸鈉、氯化鈉、硼酸、氧化鎂、溴甲酚綠、甲基紅、殼聚糖均為分析純;安琪酵母,購自超市;酵母提取物、葡萄糖、蛋白胨、瓊脂粉均為生物試劑;去離子水,實驗室自制。
AR124CN電子天平;ALC-1100.2電子天平;UV-2600可見分光光度計;LGJ-10型冷凍干燥機;RE-52AA型旋轉蒸發器;SHB-Ⅲ型循環水式多用真空泵。
1.2 金花葵花黃酮酵母微膠囊制備
1.2.1 金花葵花總黃酮的提取 準確稱取一定量金花葵花粉末,按料液比1∶30 g/mL加入體積分數75%的乙醇溶液,在60 ℃水浴提取2.5 h,離心,取上清液,濃縮,冷凍干燥后備用。
1.2.2 酵母細胞制備 稱取一定量安琪干酵母,按1∶20 g/mL加入質量分數5% NaCl,在54 ℃水浴振蕩5 h,離心后水洗2次。冷凍干燥,得到酵母細胞。
1.2.3 金花葵花總黃酮酵母微膠囊制備 稱取一定量酵母細胞,加入10 mL金花葵花總黃酮濃縮液,水浴振蕩6 h,離心,水洗3次。冷凍干燥,得到金花葵花總黃酮酵母微膠囊[5]。
1.3 保鮮冷鮮肉
1.3.1 冷鮮肉的處理 在進行實驗之前,先用75%酒精進行相應實驗用具的消毒滅菌工作,再經20 min紫外照射滅菌處理。在無菌操作下,清理掉豬后腿冷鮮肉的筋、膜及脂肪,切成140 g/塊。實驗分為4個實驗組,即空白組、2%黃酮粗提液組、2%黃酮酵母微膠囊組(以黃酮含量計)和2%殼聚糖組。在這3種不同保鮮液中進行浸泡30 min,夾出并晾干,置于自封袋中排氣封口。與空白組一同放入4 ℃冰箱冷藏[6]。于第0,1,3,5,7,9 d取出,測定并計算各實驗組中相關的微生物指標和理化指標。
1.3.2 測定指標
1.3.2.1 汁液損失率 原料肉中汁液損失的質量占原料肉的質量百分比即為汁液損失率。實驗當天稱取每塊冷鮮肉初始質量(M)和托盤質量(m)。于第1,3,5,7,9 d取出肉樣,將汁液倒盡,瀝干水分,再次稱取肉塊與托盤的總質量(W),計算各實驗組的汁液損失率(X,%)。
1.3.2.2 揮發性鹽基氮(TVB-N) 參照GB/T 5009.228—2016,從各實驗組稱取10.00 g肉樣,剪碎,放在三角瓶中,加入100 mL水,搖勻,浸泡0.5 h,過濾,留濾液。實驗時,事先在三角瓶中裝好已加入5~6滴混合指示液的2%硼酸吸收液10 mL,注意將蒸餾器的冷凝管下部插至三角瓶內液面下,以防漏氣。準確吸取各實驗組樣品濾液10 mL,加入蒸餾器反應室中,加入5 mL質量分數 1% MgO混懸液,立即蓋塞,做好水封。通入加熱蒸汽發生器,當蒸餾裝置中充滿蒸汽時,立即關閉蒸汽出口管,從第1滴冷凝水產生時開始計時,5 min后停止蒸餾。移走吸收液,用0.01 mol/L HCl標準溶液進行滴定,滴定終點為藍紫色[7]。同時做試劑空白。
1.3.2.3 pH值 從各實驗組稱取10.00 g樣品,剪碎,加入蒸餾水90 mL,振蕩0.5 h,過濾、取濾液,測定各實驗組的pH值。
1.3.2.4 菌落總數 參照GB 4789.2—2010,在無菌條件下,從各實驗組稱取10.00 g樣品,剪碎,置于事先盛有90 mL 0.85%無菌生理鹽水的三角瓶中,封口,于搖床中充分振搖3 min。吸取1 mL上清液,并進行10倍遞增稀釋,從中挑選適當稀釋度的樣液倒入,再慢慢倒入PCA培養基,于37 ℃恒溫培養,于第1,3,5,7,9 d對各實驗組分別進行菌落總數的計數[7]。
2 結果與討論
2.1 金花葵花總黃酮微膠囊制備條件優化
主要考察芯壁比(黃酮含量與預處理酵母細胞質量之比)、振蕩溫度和振蕩時間對金花葵花總黃酮微膠囊包埋效果(包埋率)的影響。
2.1.1 芯壁比對包埋率的影響 稱取一定量預處理過的酵母細胞6份,分別按芯壁比4∶1,2∶1,1∶1,1∶2,1∶3,1∶4加入10 mL總黃酮濃縮液,于60 ℃下恒溫水浴中振蕩6 h,離心、冷凍干燥,計算各實驗組的包埋率,結果見圖1。

圖1 芯壁比對包埋率的影響Fig.1 Effect of core wall
由圖1可知,芯壁比增大時,包埋率先緩慢增長,隨后快速上升,芯壁比1∶3時包埋率達到最大,隨后包埋率逐漸減小。這是因為酵母細胞對黃酮的包埋有一定的承載能力,因此隨芯壁比增加,酵母細胞對黃酮的包埋能力逐漸增強,而當芯壁比達到 1∶3 時,酵母細胞對黃酮的包埋能力已經飽和,若再繼續增加壁材用量,會出現包埋量超載的問題,影響包埋率[6]。
2.1.2 振蕩溫度對包埋率的影響 稱取一定量預處理過的酵母細胞5份,各按芯壁比1∶1加入10 mL總黃酮濃縮液,分別在30,40,50,60,70 ℃的恒溫水浴振蕩6 h,離心、冷凍干燥,計算各實驗組的包埋率,結果見圖2。

圖2 振蕩溫度對包埋率的影響Fig.2 Effect of vibration temperature
由圖2可知,隨著振蕩溫度增加,包埋率先增大后逐漸減小。振蕩溫度為40 ℃時包埋率最大。主要是由于在一定振蕩溫度范圍內,溫度逐漸升高時,黃酮分子熱運動加劇,有助于酵母細胞包埋黃酮。但當溫度>40 ℃時,分子熱運動過于劇烈,反而破壞包埋效果,包埋率顯著減小[8]。故振蕩的適宜溫度為40 ℃。
2.1.3 振蕩時間對包埋率的影響 稱取一定量預處理過的酵母細胞5份,各按芯壁比1∶1加入10 mL總黃酮濃縮液,于60 ℃水浴中分別振蕩2,4,6,8,10 h后,離心、冷凍干燥,計算各實驗組的包埋率,結果見圖3。

圖3 振蕩時間對包埋率的影響Fig.3 Effect of vibration time
由圖3可知,隨振蕩時間延長,包埋率先增大后逐漸減小,在振蕩7 h時包埋率達到最大值。這是因為酵母細胞主要是借助由細胞內外濃度差而產生的擴散作用進行黃酮包埋[9]。振蕩初期,隨著時間延長,黃酮的擴散作用加快,被酵母細胞很好地包埋,包埋率不斷增大。但繼續增加振蕩時間,反而導致已經被包埋的黃酮從酵母細胞中擴散出來,使得包埋率驟降。故振蕩時間宜為7 h。
2.1.4 正交實驗 根據單因素的實驗結果,考察芯壁比、振蕩溫度和振蕩時間對微膠囊包埋率的影響,確定制備金花葵花總黃酮微膠囊化最適條件。實驗結果見表1,方差分析見表2。

表1 正交實驗結果Table 1 The resalt of orthogonal test

表2 方差分析結果Table 2 The result of variance analysis
由表1可知,最佳因素水平組合為A2B2C1,即芯壁比為1∶3,振蕩溫度為30 ℃,振蕩時間為7 h。按此條件進行3組平行驗證實驗,測得包埋率分別為55.16%,50.33%,56.09%,平均包埋率為53.86%,大于表1中所有實驗組的最大包埋值(52.3%),故此因素水平組合即為金花葵花總黃酮酵母微膠囊化的最適條件。將3組驗證實驗所制備的微膠囊進行混合,測定并計算得到其中黃酮含量為55.19 mg/g。
由表1可知,各因素對包埋效果的影響程度為:A>C>B,即芯壁比>振蕩溫度>振蕩時間,其中,芯壁比對包埋率影響最大。
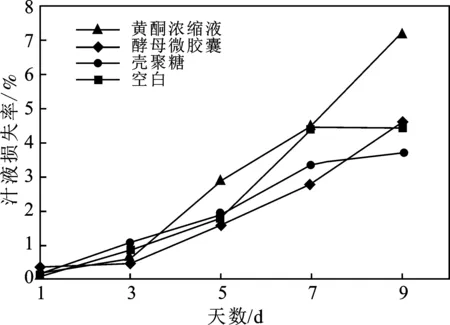
對于表2,查F分布臨界表,F0.01(2,2)=99,F0.05(2,2)=19,F0.1(2,2)=9;當F(2,2)>F0.01(2,2)時顯著記為**,當F(2,2)值介于F0.05(2,2)~F0.01(2,2)之間時顯著記為*,當F(2,2) 2.2.1 汁液損失率 在實際的加工生產和貯存中,冷鮮肉常常會發生揮發、汁液流失等現象,會嚴重影響其營養價值、感官價值和銷售價值,故可用汁液損失率來衡量肉質持水力[10]。各實驗組中汁液損失率見圖4。 圖4 各實驗組中汁液損失率的變化Fig.4 Changes of the juice loss rate in each experimental group 由圖4可知,冷鮮肉保藏時間越長,其汁液損失率越大。在整個實驗過程中,黃酮粗提液組汁液損失率變化幅度最大,酵母微膠囊組和空白組次之,而殼聚糖組汁液損失率變化幅度最小。在實驗的前5 d 里,酵母微膠囊組的汁液損失率變化最小,這是因為實驗初期,即前5 d的時間里,微膠囊組冷鮮肉的表面黃酮濃度較低,故與黃酮粗提液組相比,滲透到肉內部的黃酮量更少,故持水力與空白組接近,且好于黃酮粗提液組;但隨保存時間延長,第5 d以后,微膠囊組中的黃酮不斷被釋放出來,造成冷鮮肉表面不斷滲透進黃酮,形成濃度差,從而導致冷鮮肉失水加劇。綜上分析可知,酵母微膠囊及殼聚糖都有一定的持水作用。 2.2.2 揮發性鹽基氮(TVB-N) 由于冷鮮肉自身含有酶類及微生物,此外還受到來自于環境中微生物的污染,故在貯存期間,其所含蛋白質會被酶及微生物分解,從而產生具有揮發性的堿性含氮物質,如氨及胺類等。變質肉中揮發性鹽基氮含量高(TVB-N),大于20 mg/100 g[5]。不同實驗組的TVB-N含量見圖5。 由圖5可知,不同實驗組的TVB-N含量不同,但變化規律一致。酵母微膠囊處理、黃酮粗提液組以及殼聚糖組在第9 d時,其所含TVB-N含量均低于20 mg/100 g,均未超標。但空白組TVB-N含量一直高于其他三組,且在第7 d時數值高于20 mg/100 g,說明此時肉質已經變質。結果表明,酵母微膠囊組TVB-N明顯小于空白組,其能有效抑制微生物的生長繁殖,延長貨架期。 圖5 各實驗組中揮發性鹽基氮的變化Fig.5 Changes of TVB-N in each experimental group 2.2.3 pH值 冷鮮肉在貯存過程中pH值會逐漸增大,肉質變差,這主要是因為冷鮮肉中蛋白質會被其所含酶和微生物分解而產生氨及胺類等堿性化合物[10]。各實驗組中冷鮮肉pH值見圖6。 圖6 各實驗組中pH的變化Fig.6 Changes of pH in each experimental group 由圖6可知,各實驗組中冷鮮肉pH值均隨時間延長而不斷增大,但增長幅度各不相同,即黃酮粗提液組<殼聚糖組<酵母微膠囊組<空白組,即黃酮粗提液組能較好地抑制pH增長。這是黃酮粗提液組中黃酮含量很高,能效抑制微生物生長,延緩蛋白質分解,使pH保持較低值。殼聚糖組中殼聚糖具有成膜性,能減小肉質與氧氣的接觸,抑制微生物生長繁殖以及對蛋白質的分解作用。酵母微膠囊組pH值比前兩組稍高一些,主要是由于酵母微膠囊組具有緩慢釋放黃酮的作用,開始幾天黃酮濃度較低,抑菌作用較弱,隨時間延長,大量黃酮被釋放出來,有效抑制微生物的生長,故第7 d以后,pH值激增的趨勢被抑制。綜上可知,3種保鮮液對冷鮮肉均具有一定的保鮮作用。 2.2.4 菌落總數 隨保存時間延長,冷鮮肉中的菌落總數逐漸增多,當達到6 lgcfu/g時,說明肉已經腐敗變質[3]。指標的評價標準為:一級鮮肉菌落總數≤104cfu/g;二級鮮肉104cfu/g<菌落總數≤106cfu/g;腐敗肉菌落總數>106cfu/g[10-11]。各實驗組冷鮮肉中的菌落總數見圖7。 圖7 各實驗組中菌落總數的變化Fig.7 Changes of colonies number in each experimental group 由圖7可知,各實驗組中保鮮劑的抑菌性能力不同,即酵母微膠囊組>殼聚糖組>黃酮粗提液組>空白組。經過不同保鮮液處理的實驗組,其菌落總數均明顯低于空白組。且空白組在第9 d時菌落總數為8.15 lgcfu/g,已達到腐敗肉的標準。而另外三組在實驗的9 d內,仍處于二級鮮肉標準。其中,酵母微膠囊組表現的抑菌性最佳,這是由于黃酮較好的抑菌性以及微膠囊的緩釋作用而實現的,且在第9 d時菌落總數為6.51 lgcfu/g,為所有實驗組中的最低值。表明酵母微膠囊組具有較好的抑菌效果。 (1)金花葵花總黃酮的酵母微膠囊化最適條件:芯壁比1∶3,振蕩溫度30 ℃,振蕩時間7 h,此時微膠囊包埋率可達53.86%。 (2)與空白組相比,各保鮮液對冷鮮肉都有一定保鮮作用,酵母微膠囊與殼聚糖的保鮮效果十分接近。金花葵花總黃酮酵母微膠囊在汁液損失率、揮發性鹽基氮和菌落總數實驗中均表現出了較好的保鮮,可保鮮9 d左右。2.2 冷鮮肉保鮮效果



3 結論

