借助電離學說史料突破電解質教學難點
邢瑞敏 劉真真 許英 范艷花 劉山虎
摘要:理清電解質和電離的概念是中學化學教學中的重難點之一。結合電離學說這一史料,圍繞“電解質導電的實質”和“電解質電離的能量來源”這兩個核心內容,突破電解質及其電離的教學難點,加強學生對電解質定義的深度理解,掌握電解質導電的實質,理解電解質電離的驅動能量。
關鍵詞:電解質;導電實質;能量
文章編號:1008-0546( 2019)08-0021-02
中圖分類號:G633.8
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2019.08.006
電解質及其電離是人教版高中《化學必修l》(以下簡稱教材)第二章第二節的內容,在高中化學教學中占據重要地位,起著承上啟下的作用。在教學過程中我們發現學生不能很好地理解電解質概念和電離的過程,通過調研開封市杞縣三所高中2018年秋季學期高一期中考試580份試卷發現,這一內容所涉及到的題目得分率約11%。經過分析試卷以及對學生、一線教師的訪談,發現學生在學習上存在以下易錯內容:(1)電解質、非電解質的判斷;(2)電解質的電離是否需要通電;(3)電解質是否一定能導電、非電解質是否一定不導電、在水溶液中能導電的物質是否一定是電解質。
一、重現史料,探尋難點
1799年意大利物理學家伏打(Alessandro,V.1745-1827)發明電池以后,英國化學家尼柯爾森( Nic- holson.W. 1753-1815)和卡里斯爾(Carlisle,A.1768-1840)最先發現溶液具有導電性[1]。英國化學家法拉第( Faraday,M.1791-1867)將分解前的物質稱為電解質,并根據通電使其分解的現象提出了陰陽離子的概念[2]。英國化學家威廉遜( Willianson,A.W.1824-1904)和德國化學家克勞胥斯(Clausius,R.JE.1822-1888)則認為,電解質分子與其形成的陰陽離子之間存在著動態平衡,在常溫下溶液中的分子不可能大量地離解[3]。最后瑞典物理化學家阿倫尼烏斯( Arrhenius,A.1859-1927)通過氨的實驗發現這種物質在氣體狀態時是不導電的,而它的水溶液卻是導體,溶液越稀,導電性越好[4],于1883年5月得出結論:溶液稀釋時,導電性增加的原因是水而不是由于通電,提出了電離學說。
科學概念形成的突破點、轉折點往往是中學教學過程中的重難點。結合法拉第的觀點以及學生的易錯點,我們發現電解質導電的條件是一個教學重點,由于電解質導電的微觀現象比較抽象,所以講解電解質導電的實質便成為本節課的教學難點。威廉遜、克勞胥斯提出了電解質分子與其形成的陰陽離子之間存在著動態平衡且沒有驗證,原因在于他們對電解質電離的驅動能量不清楚;阿倫尼烏斯的理論最初沒有得到大家的認可,是因為導電使電解質電離的思想觀念還未扭轉,那么電離的能量來源又成為教學的另一個難點。
經過分析,我們發現電解質及其電離的教學難點有兩個方面:一是電解質導電的實質;二是電解質電離的驅動能量。我們根據存在的問題,從化學史料出發,重構化學課堂,幫助學生理解電解質和非電解質的相關知識,掌握科學方法,提升學科素養。
二、立足史料,突破難點
1.難點一:電解質導電的實質
設計思路及意圖:
本設計不加外接電源,通過觀察電流表指針的偏轉判斷物質是否導電。不僅驗證了法拉第的觀點,而且從宏觀角度使學生理解電解質電離的條件。探究引起NaCl溶液或者熔融狀態下的NaCl(以下簡稱)NaCl溶液/熔融)導電的物質是水?或NaCl固體?或NaCl溶液/熔融?從微觀角度理解電解質導電是因為有自由移動的離子,并與S02在水溶液中導電行為進行比較,使學生清楚電解質導電的實質,提升“宏微結合”的化學學科核心素養。
教學過程:
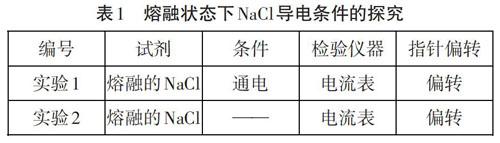
【環節一】電解質的研究始于法拉第,命名起源于法拉第錯誤地認為電解質是一種能被電流分解的物質,他把電解以前被分解的物質稱為電解質。隨著科學家的進一步研究發現:通電以前電解質在水溶液中已經解離了,電離不需要電流。但是由于歷史的原因,電解質這個名字卻被保留了下來。電解質是否真如字面意思一樣,是一種通電分解的物質,我們采用小組實驗探究一下。實驗記錄結果見表1。
根據實驗可以得出:2中的電流表發生了偏轉,說明通電不是電解質電離的必要條件。所以法拉第做出了錯誤的解釋。那么電解質導電的微觀世界到底是怎樣的呢?
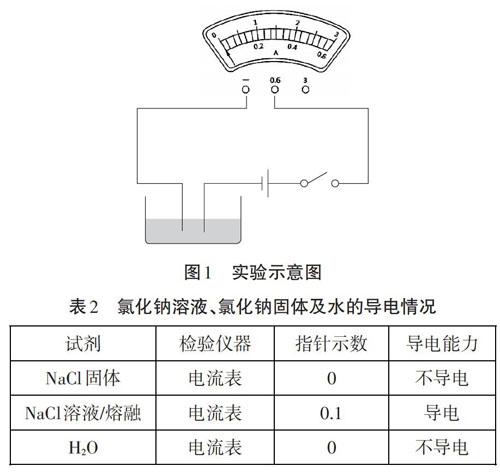
【環節二】猜測引起NaCl溶液導電的物質可能是NaCl固體本身、可能是NaCl溶液/熔融產生新粒子、可能是H20。運用圖l實驗裝置進行小組實驗,電流表量程選用0-0.6A,結果記錄見表2。
通過實驗我們發現,NaCl溶液/熔融能夠導電,NaCl溶液/熔融導電是因為有自由移動的離子。
【環節三】NaCl溶液能夠導電是因為氯化鈉本身含有鈉離子和氯離子,S02能導電是因為它與水反應產生了H2S03,H2S03電離出了自由移動的離子,使得溶液能夠導電,并不是S02自身電離出來的離子使溶液能夠導電,引導學生回答判斷電解質和非電解質時,還要看是否為自身電離。
【小結】電解質導電的實質是其在水溶液或者熔融狀態下自身解離出自由移動的離子。
2.難點二:電解質電離的能量來源
設計思路及意圖:
電解質(以氯化鈉為例)電離是什么驅使的呢?本設計從H20是極性分子,氧原子上聚集著負電荷,氫原子上聚集著正電荷角度出發,引出電解質在水溶液中電離的驅動力是水的靜電引力,進而大膽猜測熔融狀態下電離的驅動力。
教學過程:
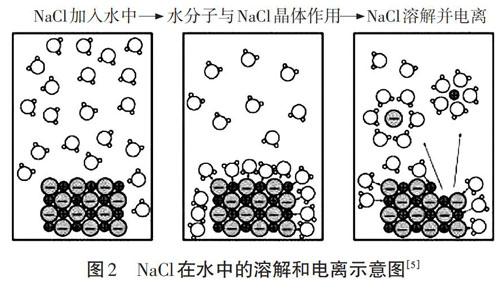
【環節一】阿倫尼烏斯的觀點沒有很快得到大家的認可,是因為通電使電解質分解的思想觀念還未扭轉,更不知道電解質借助什么來破壞其內部強烈的相互作用力。結合圖2分析,水分子是一個極性分子,不斷撞擊氯化鈉晶體表面,水分子中氧原子上聚集著負電荷容易與鈉離子結合形成水合鈉離子、氫原子上聚集著正電荷容易與氯離子結合形成水合氯離子,使學生明白在水溶液中電解質電離出來陰陽離子的關鍵在于水的靜電引力。
【環節二】NaCl由固態變為熔融的液態的過程中,被束縛著的鈉離子和氯離子在加熱提供的熱能的作用下掙脫束縛,變成自由移動的鈉離子和氯離子而能夠導電。
【小結】電解質電離的能量來源是水溶液提供的靜電引力或加熱提供的熱能。
三、突破難點,加強對電解質、非電解質定義的理解深度
無論是2002年人教版教材還是2007年新版人教版教材,電解質的概念是一致的。教材中給出的電解質概念關鍵詞突出——“水溶液”“熔融狀態”“導電”“化合物”。經過上面的分析,我們可以嘗試對電解質的定義做一個補充。電解質:在水溶液或熔融狀態下自身解離出自由移動的陰陽離子而導電的化合物。非電解質:在水溶液和熔融狀態下不能自身解離出自由移動的陰陽離子而不能導電的化合物。在定義中增加了兩個關鍵詞——“自身電離”“自由移動”。
描述電解質導電的微觀現象,有利于學生對電解質、非電解質相關內容作出正確的判斷,“自由移動”這一微觀描述對判斷電解質非電解質能否導電提供依據。例如:氯化鉀溶液中鉀離子和氯離子能自由移動能導電,氯化鉀固體中鉀離子和氯離子不能自由移動不能導電。“自身解離”這一微觀描述為判斷二氧化硫、氨氣、二氧化碳、蔗糖等這類分子化合物是不是電解質提供依據。例如:蔗糖自身不能解離所以是非電解質。
四、總結與思考
通過對電離學說發展史的梳理,學生不僅清晰地認識電解質的概念、掌握電解質導電的實質、明白電解質電離的驅動能量,也感受到科學概念發展過程中科學家們不斷完善的艱辛。因此,在教學過程中,合理引入化學史是十分必要的,不但可以把難點講得通透,而且可以培養學生的科學探究精神。
參考文獻
[1]袁翰青,應禮文.化學重要史實[M].北京:人民教育出社,1989:336-339
[2] Charles A.Kraus.The present state of the electrolyte problem[J].Journal of Chemical Education, 1958(7):324
[3] Ran Friedman.Electrolyte Solutions and Specific Ion Effectson Interfaces[J].Journal of Chemical Education, 2013(8):1018-1023
[4]高曉偉,鄭長龍,徐潔.“電解質”的教學設計與反思[J].中學化學教學參考,2015(13):19-23
[5]宋心琦,普通高中課程標準實驗教科書(化學)[M].北京:人民教育出版社,2007

