寶藿苷Ⅰ減輕鏈脲佐菌素誘導大鼠海馬神經元結構損傷的作用機制研究
尹彩霞 陳晶 張玨
【摘 要】 目的:探索寶藿苷I(Baohuoside I)對鏈脲佐菌素(STZ)所致大鼠神經元結構損傷的影響及其可能的機制。方法:HE、Nissl染色分別觀察海馬神經元結構損傷情況及存活情況,Western blot檢測海馬過氧化物酶體增殖物激活受體α(PPARα)和PPARγ的蛋白表達。結果:Baohuoside I高劑量組能減輕大鼠海馬神經元結構損傷,阻遏存活神經元數目的減少,上調海馬PPARα、PPARγ蛋白表達。結論:Baohuoside I具有改善STZ所致大鼠海馬神經元結構損傷的作用,其作用機制可能與上調PPARα、PPARγ的蛋白表達有關。
【關鍵詞】 寶藿苷I;鏈脲佐菌素;過氧化物酶體增殖物激活受體
【中圖分類號】R965 【文獻標志碼】 A【文章編號】1007-8517(2019)10-0012-05
Study on the Effect and Mechanism of Baohuoside I in Attenuating Streptozotocin-Induced Hippocampal Neuronal Injury in Rats
YIN Caixia CHEN Jing ZHANG Jue*
Zunyi Medical And Pharmaceutical College, Zunyi 563003, China
Abstract: Objective To explore the effect and possible mechanisms of Baohuoside I on neuronal injury induced by streptozotocin(STZ)in rats. Methods HE staining and Nissl staining were used to detect neuronal injury and neuronal survival of hippocampus, respectively; Western blot was used to examine the protein expression of peroxisome-proliferator-activated receptor α(PPARα)and PPARγ. Results Baohuoside I high dose group could attenuate the neuronal injury, inhibit the decrease of the number of surviving neurons, and up-regulate the protein expression of PPARα and PPARγ. Conclusion Baohuoside I has an improvement effect on STZ-induced neuronal injury of hippocampus in rats, and the underlying molecular mechanism may be related to the up-regulation of PPARα and PPARγ.
Key words:Baohuoside I; Streptozotocin; Pperoxisome-Proliferator-Activated Receptor
阿爾茨海默病(Alzheimers Disease, AD)又名阿爾采末病,是老年性癡呆最常見的類型,主要臨床表現為持續性記憶丟失和漸進性認知功能障礙[1]。其神經病理學特征主要包括海馬和皮質部位神經元的缺失、細胞外β-淀粉樣蛋白(β-amyloid,Aβ)沉積形成的Aβ斑(老年斑)、細胞內tau蛋白異常磷酸化形成的神經原纖維纏結[1-2]。其中,Aβ沉積是導致海馬神經元病變、引發AD最主要的原因[3],而且研究已經證實過氧化物酶體增殖物激活受體(Peroxisome-Proliferator-Activated receptors,PPARs)可參與調節這一過程[4]。鏈脲佐菌素(Streptozotocin,STZ)化學名為2-脫氧-2-{(甲基-亞硝基氨基)羰基-氨基}-D-吡喃葡萄糖,是一種具有毒性的氨基葡萄糖-亞硝基脲化合物,可選擇性地摧毀胰島β細胞,使得胰島素信號途徑受阻[5-6] 。除此之外,側腦室內注射STZ可引發皮質與海馬的葡萄糖代謝減慢,導致突觸丟失、神經元結構損傷,促進Aβ的異常增加,最終誘導學習記憶功能障礙[7]。目前,應用STZ誘導海馬神經元結構損傷建立AD動物模型已被廣泛用于體內實驗研究[8-10]。迄今為止,臨床用于抗AD的藥物(如膽堿酯酶抑制劑加蘭他敏、NMDA受體拮抗劑美金剛)只能延緩AD的病程及發生,又因其毒副作用大,使得療效受限。因此,基于AD的發病機制探索新型AD治療藥物迫在眉睫。
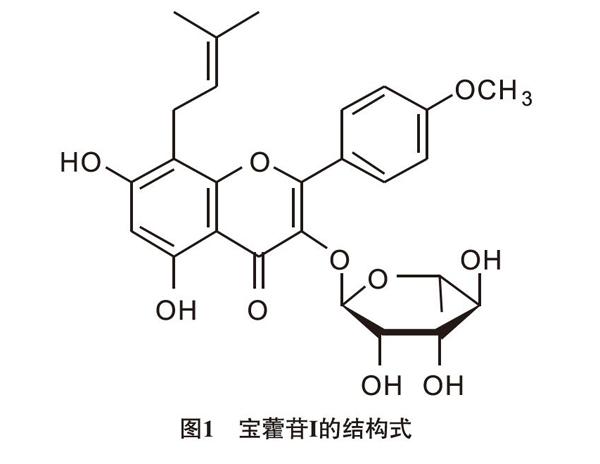
寶藿苷Ⅰ(Baohuoside I)又稱淫羊藿次苷II,是我國傳統中草藥淫羊藿(Herba Epimedii)的基本藥用活性成分之一,屬于天然黃酮醇苷類化合物,具有抗炎、減輕缺血性腦損傷、抗腫瘤、改善性功能障礙等多種藥理學作用,其分子量為514.53,結構式如圖1所示[11-14]。而且,新近研究發現Baohuoside I減輕缺血性腦損傷的機制與PPARα、PPARγ的上調有關[13]。值得注意的是,已有研究證實Baohuoside I 可通過增加PPARγ的蛋白表達,從而抑制BACE1的轉錄,促進Aβ代謝,最終減輕APP/PS1轉基因小鼠的學習記憶下降及海馬神經元結構損傷,起到抗AD的作用[15]。此外,本課題組研究發現Baohuoside I能改善側腦室內注射STZ所致的AD大鼠認知功能減退及海馬神經元結構損傷,其機制與阻遏Aβ的異常增加有關[8],同時綜合上述的前期研究我們推測PPARα、PPARγ參與了這一過程。因此,本研究繼續采用STZ誘導的類AD樣大鼠模型,探索Baohuoside I減輕該模型大鼠神經元結構損傷的機制是否與PPARα、PPARγ有關,為Baohuoside I用于AD的防治提供新的藥理學依據。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 本研究所用的40只成年雄性SD大鼠購買于重慶第三軍醫大學實驗動物中心,均為SPF級,體重260g~270g,許可證號為SCXK-(軍)2012-0011。大鼠以每籠5只適應性飼養一周后進行實驗。
1.1.2 主要藥品、試劑、儀器設備 鏈脲佐菌素(貨號S0130)購自美國Sigma公司;寶藿苷I(純度≥98%,批號140701)購于南京澤朗醫藥有限公司;甲苯胺藍購于北京索萊寶科技有限公司;PPARα兔多克隆抗體及PPARγ兔多克隆抗體均購于英國Abcam有限公司;β-actin小鼠單克隆抗體購自江蘇碧云天生物技術有限公司;SR-6N大鼠腦立體定位儀購自日本東京Setagaya.ku 公司;全波長酶標儀及Quantity One-全自動凝膠成像分析儀購自美國BIO-RAD公司;BX43正置顯微鏡購于日本Olympus 公司。
1.2 實驗方法
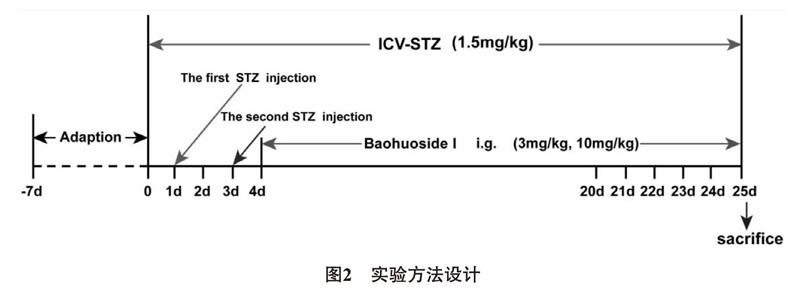
1.2.1 動物分組、造模及給藥方法 將40只成年雄性SD大鼠隨機均分為4組:假手術組、STZ組、Baohuoside I低劑量組、Baohuoside I高劑量組。用7%水合氯醛將大鼠麻醉(0.5 mL /100 g,i.p),然后再將其頭部固定于大鼠腦立體定位裝置上,沿頭皮中間位置切一矢狀切口,根據《大鼠腦立體定位圖譜》確定大鼠側腦室進針坐標(前囟后0.8mm,中線旁開1.5 mm,顱骨下3.6mm)進行模型的制備。STZ組和Baohuoside I低、高劑量組大鼠經微量注射器在第1天和第3天分別向雙側側腦室勻速推注STZ(濃度為1.5mg/kg,用0.05mmol/L 檸檬酸緩沖液配置,并調節pH 值為 4.2,需現配現用,冰上操作)5μL,同法向假手術組大鼠雙側側腦室推注等體積溶媒(檸檬酸緩沖液)。第3天手術結束后次日開始給藥,Baohuoside I經雙蒸水溶解,低劑量組每日灌胃Baohuoside I 3mg/kg,高劑量組每日灌胃Baohuoside I 10mg/kg,連續給藥21d,假手術組和STZ組同法灌胃等體積雙蒸水,同時監測大鼠體重的變化。實驗方法設計如圖2所示。
1.2.2 HE染色、Nissl染色 大鼠經Baohuoside I給藥結束后,各組隨機抽取3只,用4%多聚甲醛進行透灌,透灌結束后立即斷頭取腦,取下的全腦用4%多聚甲醛溶液固定5d,進行常規石蠟包埋,最后將蠟塊切片(厚度為5μm),置于60℃烘箱中粘片,分別進行HE染色(主要用蘇木素、伊紅染色)和Nissl染色(主要用甲苯胺藍染色),BX43正置顯微鏡觀察海馬神經元結構損傷情況及海馬神經元的存活情況。
1.2.3 Western blot檢測蛋白表達 Baohuoside I給藥結束后,處死大鼠,冰上分離雙側海馬,置于-80℃低溫冰箱保存備用。稱取海馬組織50mg,用RIPA裂解液提取總蛋白,蛋白濃度用BCA試劑盒進行檢測。制備含20μg蛋白的上樣樣本,用10% SDS-聚丙烯酰胺凝膠電泳將蛋白進行分離。電泳結束后,用電轉的方式將蛋白轉至PVDF膜上,5%的脫脂牛奶封閉120 min,加入一抗(PPARα,1∶1000;PPARγ,1∶1 000;βactin,1∶5000)于 4℃孵育過夜,再加入二抗(1∶2000)于常溫孵育60min。二抗反應結束后,相應的條帶用ECL發光劑顯影,并置于全自動凝膠成像分析儀中測定泳帶的吸光度積分值。
1.3 統計學分析 所有數據均用SPSS 16.0統計軟件進行單因素方差分析,并用均數加減標準差(x±s)表示。P<0.05為差異有統計學意義。
2 結果
2.1 Baohuoside I對STZ誘導的大鼠海馬神經元結構損傷的影響 HE染色觀察大鼠海馬神經元結構損傷情況。如圖3所示,假手術組大鼠海馬神經元結構清晰完整,無明顯損傷;STZ組大鼠海馬神經元萎縮,核出現深染甚至消失,損傷嚴重;Baohuoside I高劑量治療后,大鼠海馬神經元結構較為清晰完整,損傷明顯減輕。
2.2 Baohuoside I對STZ誘導的大鼠海馬存活神經元數目減少的影響 尼氏染色觀察大鼠海馬存活神經元情況。如表1及圖4所示,假手術組大鼠海馬神經元形態正常,結構清晰完整;STZ組大鼠海馬神經元萎縮,存活神經元數量顯著減少;Baohuoside I高劑量治療后,大鼠海馬神經元少有萎縮,存活神經元數量明顯增加。
2.3 Baohuoside I對大鼠海馬PPARα蛋白表達的影響 Western blot檢測大鼠海馬PPARα蛋白表達。如表2及圖5所示,與假手術組比較,STZ組PPARα 蛋白表達增加;Baohuoside I高劑量連續給藥21 d后,顯著增加了STZ 大鼠海馬PPARα的蛋白表達。
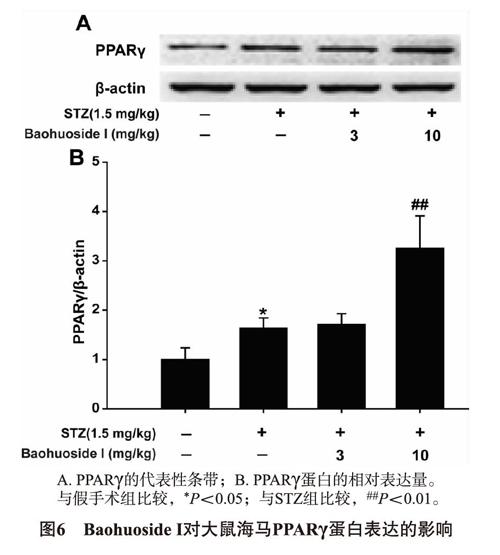
2.4 Baohuoside I對大鼠海馬PPARγ蛋白表達的影響 Western blot檢測大鼠海馬PPARγ蛋白表達。如表3及圖6所示,與假手術組比較,STZ組PPARγ 蛋白表達增加;Baohuoside I高劑量連續給藥21d后,顯著增加了STZ 大鼠海馬PPARγ的蛋白表達。
3 討論
AD是一種由多因素導致的中樞神經系統退行性疾病,其初始階段主要表現為腦內胰島素抵抗引起的胰島素信號障礙和葡萄糖攝入不足引起的葡萄糖代謝減慢[1, 16]。STZ作為一個有毒的烷基化氨基葡萄糖-亞硝基脲化合物,可激活聚腺苷酸二磷酸核糖轉移酶[poly (ADP-ribose) polymerase,PARP],使DNA發生烷基化,進而導致細胞壞死[6]。近年來,大量研究表明雙側側腦室內注射STZ可引起胰島素受體功能障礙、葡萄糖代謝率降低,最終表現出Aβ異常增加、tau蛋白異常磷酸化、海馬神經元受損缺失、突觸丟失等類似于AD的病理學特征[7, 17]。因此,本研究采用STZ雙側側腦室注射誘導類AD樣大鼠模型,探索Baohuoside I能否減輕該模型大鼠的神經元結構損傷及初探其可能的機制。眾所周知,海馬和皮質部位的膽堿能神經元缺失變性是AD的特征性病理學變化之一[18]。本研究采用HE染色觀察大鼠海馬CA2區神經元的形態,結果顯示STZ組大鼠海馬神經元變性且核固縮,結構明顯受損,與Rostami等的研究一致[17],提示大鼠經雙側側腦室注射STZ后可引起海馬神經元結構損傷。與此同時,大鼠經Baohuoside I 10mg/kg治療后神經元結構損傷得到明顯緩解。由此可見,Baohuoside I 10 mg/kg可阻遏STZ組大鼠的海馬神經元受損缺失。值得注意的是,Baohuoside I 3mg/kg連續給藥不能減輕STZ誘導的大鼠海馬神經元損傷,提示Baohuoside I在本實驗條件下的閾劑量大于3 mg/kg。神經元的功能狀態主要由尼氏小體反映,尼氏小體數量多且體積大,說明神經元合成蛋白質的功能較強。然而,一旦神經元受到損傷,尼氏小體就會溶解甚至消失。因此,本研究采用尼氏染色法對海馬神經元存活情況進行檢測,結果表明STZ組大鼠尼氏小體的數目明顯減少,與前期研究一致[8]。長期給予Baohuoside I 10mg/kg治療后大鼠尼氏小體的數量顯著增多。由此可見,Baohuoside I 10 mg/kg可阻遏STZ誘導的大鼠海馬存活神經元數目的減少,進而維持海馬存活神經元的數量。
實際上,本課題組前期研究已經證實,Baohuoside I可通過減少淀粉樣前體蛋白APP(amyloid precursor protein,APP)、β-分泌酶(β-site APP cleavage enzyme,BACE1)的蛋白表達抑制Aβ的生成,同時還能增加腦啡肽酶(neprilysin,NEP)的蛋白表達促進Aβ的代謝,最終減少Aβ的異常增加,改善STZ誘導的大鼠學習記憶功能障礙,起到抗AD的作用。而且,越來越多的研究表明在AD動物模型腦內Aβ的減少與PPARα、PPARγ密切相關[4]。PPARα、PPARγ均屬于核轉錄因子,在激活狀態下,能與視黃素x受體形成異質二聚體,形成的異質二聚體可與過氧化物酶體增殖物反應元件結合,調控基因的表達[4-19]。其中,PPARα激活后可上調α-分泌酶(a disintegrin and metalloproteinase domain 10, ADAM10)的基因表達,使APP降解,從而減少Aβ的生成。而PPARγ激活后能抑制BACE1的轉錄,調控APP的進程,從而影響Aβ的生成。此外,PPARγ對Aβ的清除具有促進作用[4]。由此可見,PPARα和PPARγ在Aβ的生成、代謝過程中均起著至關重要的作用。綜上所述,筆者推測本課題組前期研究發現的Baohuoside I減少STZ大鼠腦內Aβ異常增加的機制與PPARα和PPARγ的激活有關。因此,本研究采用Western blot法檢測大鼠海馬PPARα和PPARγ的蛋白表達。本實驗結果發現STZ組大鼠海馬PPARα和PPARγ的蛋白表達高于假手術組,同時Baohuoside I 10mg/kg給藥組PPARα和PPARγ的蛋白表達明顯高于STZ組,與Li等的研究結果類似[20]。此結果提示,Baohuoside I 10 mg/kg可通過激活PPARα和PPARγ,減少STZ誘導的Aβ異常增加。然而,為什么STZ組PPARα和PPARγ的蛋白表達高于假手術組,可能與STZ制模時的時間點有關,這是本課題組后續研究的重點。
總之,本研究證實了PPARα和PPARγ參與了側腦室內注射STZ誘導的大鼠海馬神經元結構損傷的調控過程,加深了課題組對AD腦內Aβ異常增加機制的認識。Baohuoside I可減輕STZ誘導的大鼠海馬CA2區神經元結構的損傷,其機制與PPARα和PPARγ的激活有關。
參考文獻
[1]Bazazzadegan N, Dehghan Shasaltaneh M, Saliminejad K, et al. Effects of Ectoine on Behavior and Candidate Genes Expression in ICV-STZ Rat Model of Sporadic Alzheimers Disease [J]. Adv Pharm Bull, 2017, 7(4):629-636.
[2]Dos Santos JPA, Vizuete A, Hansen F, et al. Early and Persistent O-GlcNAc Protein Modification in the Streptozotocin Model of Alzheimers Disease [J]. J Alzheimers Dis, 2018, 61(1):237-249.
[3]Jiao C, Gao F, Ou L, et al. Tetrahydroxy stilbene glycoside (TSG) antagonizes Abeta-induced hippocampal neuron injury by suppressing mitochondrial dysfunction via Nrf2-dependent HO-1 pathway [J]. Biomed Pharmacother, 2017(96) :222-228.
[4]Vallee A, Lecarpentier Y. Alzheimer Disease:Crosstalk between the Canonical Wnt/Beta-Catenin Pathway and PPARs Alpha and Gamma [J]. Front Neurosci, 2016(10):459.
[5]Shingo AS, Kanabayashi T, Murase T, et al. Cognitive decline in STZ-3V rats is largely due to dysfunctional insulin signalling through the dentate gyrus [J]. Behav Brain Res, 2012, 229(2):378-383.
[6]Grieb P. Intracerebroventricular Streptozotocin Injections as a Model of Alzheimers Disease:in Search of a Relevant Mechanism [J]. Mol Neurobiol, 2016, 53(3):1741-1752.
[7]Knezovic A, Osmanovic Barilar J, Babic A, et al. Glucagon-like peptide-1 mediates effects of oral galactose in streptozotocin-induced rat model of sporadic Alzheimers disease [J]. Neuropharmacology, 2018(135):48-62.

