龍須菜不同世代間SSH文庫差顯基因的信息學分析及部分序列的轉錄驗證*
朱瑋芳,王莉莉,徐 滌,王 潔,李鳳婷,閆 昊
(中國海洋大學海洋生物遺傳學與育種教育部重點實驗室,海洋生命學院,山東 青島 266003)
龍須菜(Gracilariopsislemaneiformis)廣泛分布于中國的黃海海域[1],是中國重要的栽培海藻,主要作為提取瓊膠的原料,也大量用于鮑魚養殖等。隨著龍須菜養殖業的不斷發展壯大,龍須菜的種質退化現象也越來越嚴重,盡管目前已有多個高產的新品種,如981龍須菜[2]、龍須菜2008[3]、魯龍1號[4]等,但仍然無法完全滿足生產上的需求。此外,目前龍須菜的養殖方式為營養繁殖,其苗種的來源與保存都存在一定風險。為了獲得穩定可控的苗種來源以及更精準的品種改良方法,都要求對其世代交替的繁殖發育調控機制有更加深入的認識。
龍須菜是典型的真紅藻亞綱(Florideophycidae)的三世代型生活史,包括二倍的四分孢子體以及附生于雌配子體藻枝上的果孢子體世代和單倍的配子體世代[5],其四分孢子體與雌雄配子體分別萌發自果孢子和四分孢子,但萌發的時間和空間相同,可形成混雜的群落。在成熟之前形態大小完全相同,無法進行區分[6]。
通過轉錄水平的比較分析來尋找世代差異表達的基因在紅藻相關研究中已經不少的報道。例如在紫菜(Pyropia/Porphyra)屬中,曾報道在孢子體中特異表達的一種延長因子EF-1a[7];還有在配子體中發現的依賴于特殊啟動子元件的PyKPA1基因,可編碼鈉離子泵[8-9];此外還有研究通過抑制性消減雜交對紫菜配子體和孢子體形態差異相關候選基因進行分析注釋,發現配子體更趨向于具有生長和自我保護的趨勢,而孢子體在發育過程中更活躍[10]。在江蘺中也報道了在果孢子體中特有的泛素基因[11]和硫轉運酶等基因[12]以及在雌配子體中特異表達的gmf-01基因[13]。丁弘葉等[14]還通過AFLP分子標記技術,得到了一個在四分孢子體和雌配子體中穩定表達,而在雄配子體中不表達的遺傳標記。
本文將利用ContigExpress、Blast2GO等生物信息學軟件對實驗所得1 873條有效序列進行進一步的聚類和分析,進一步整理并深入理解以上消減雜交的結果,并利用實時熒光定量PCR的方法對部分差顯序列進行轉錄水平的比較和驗證,為后續江蘺屬紅藻世代交替及發育的研究提供數據并開拓思路。
1 材料與方法
1.1 實驗用材料
文庫構建及RT-qPCR驗證所用材料為本實驗室保種的一株采自青島湛山灣的野生龍須菜四分孢子體以及由它放散的四分孢子所萌發培養的雌配子體和雄配子體各一株。以這3個樣品進行實驗目的是盡量減少遺傳背景的差異。
1.2 序列的聚類和Blast2GO分析
本實驗室在前期工作中構建了5個正反向的龍須菜雌、雄配子體間以及它們分別與四分孢子體之間的抑制性消減雜交文庫,再通過斑點雜交方法在各庫中進一步對差異顯示序列進行篩查,盡量去除假陽性片段。根據斑點雜交結果,總共獲得2 682個差異顯示的陽性克隆(陽性克隆的定義為該克隆與本組差減產物探針雜交的信號值同與反向差減產物探針雜交的信號值的比值≥2),測序后共獲得1 873條可用序列(見表1)[15]。將所得數據全部導入ContigExpress中進行聚類并檢查聚類結果的可行性,減少因PCR擴增或是測序過程中產生的堿基錯誤而造成的誤差。最后將這些經過聚類的序列導入Blast2GO軟件,進行一系列的比對和注釋。
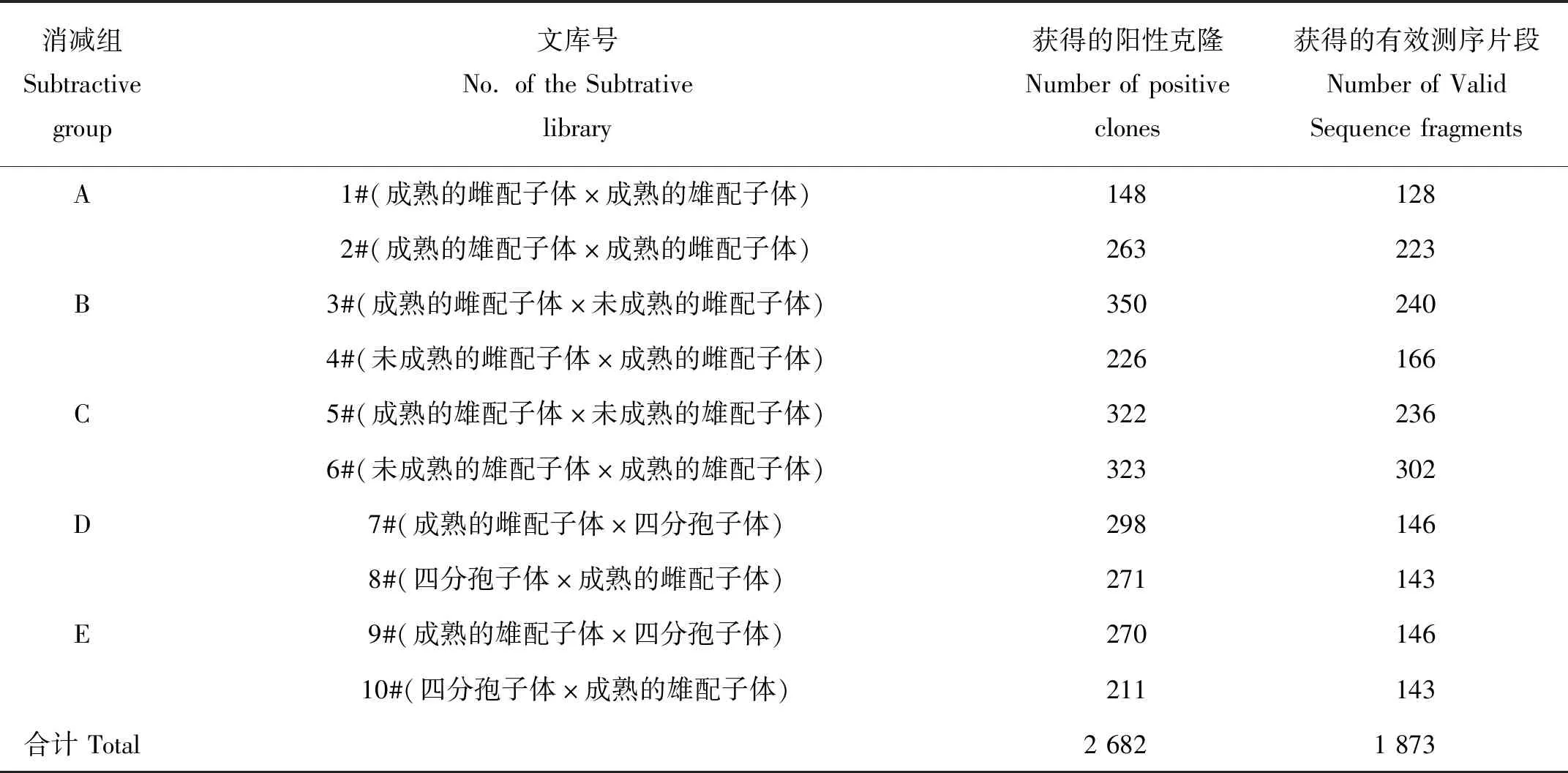
表1 斑點雜交陽性克隆的測序結果統計Table 1 The positive clones and effective sequences for the dot-blot results
注:未成熟的藻體即距離藻枝尖端1 cm以內的藻枝部分;成熟的藻體即距離藻枝尖端1 cm以下的主枝部分。
Note:Immature branches indicate the upper part of branches less than 1cm from the tip.Mature branches indicate the part of branches below the tip.
1.3 龍須菜藻體總RNA提取和cDNA合成
分別稱取龍須菜雌配子體、雄配子體和四分孢子體各約100 mg,于盛有液氮的研缽中迅速研磨至粉末,利用RNase-Free產品提取各樣品的總RNA。利用1.2%瓊脂糖凝膠電泳檢測所提取的總RNA質量,并用NanoDrop 2000C測定總RNA的濃度,用以計算反轉錄時總RNA的用量。分別以上述步驟提取的4種總RNA為模板,用PrimeScript 1st Strand cDNA Synthesis Kit(TaKaRa)將總RNA反轉錄成單鏈的cDNA,將所得cDNA樣品置于-20°C冰箱貯藏備用。
1.4 部分候選差顯基因的實時熒光定量PCR(RT-qPCR)驗證
根據比對結果中的GO IDs、KEGG Pathway Map和序列所在SSH文庫的代表性,本輪實驗選擇了9個重疊群(contig-03、contig-11、contig-19、contig-35、contig-44、contig-52、contig-60、contig-114、contig-116)及3個單條序列(7310、8142、0125)共12條候選基因,采用RT-qPCR的方法對SSH文庫篩選的結果進行進一步的定量驗證。
首先進行差異基因RT-qPCR反應的引物設計與反應條件優化,使用RealMaster Mix (SYBR Green)試劑盒(TIANGEN)進行PCR反應,使用儀器為ABI 7500熒光定量PCR儀,反應步驟如下:95 ℃ 5 min,95 ℃ 1 min,54 ℃ 30 s,72 ℃ 45 s,35個循環,最后72 ℃延長10 min。內參基因使用的是本實驗篩選出兩個在龍須菜不同世代中表達穩定的rbcL和Co基因對實驗數據進行分析[16]。待測基因的相對定量表達以2-ΔΔCt方法進行計算[17]。
2 結果與分析
2.1 龍須菜抑制性消減雜交差異表達基因的聚類
去除載體后得到1 873條序列,將其用Vector NTI Suite 6.0軟件中的ContigExpress進行聚類分析,最終獲得118個重疊群(contig),以及未被聚類進任何一個重疊群的247條單條序列,共計365個基因片段序列。
2.2 生物信息學分析
本實驗對得到的118個重疊群及247條單條序列利用Blast2GO在線軟件進行分析及注釋。結果顯示,應用blastx搜索比對上的序列所對應的生物物種大多數來自植物,但非常分散,在比對上的3 000條序列中,匹配數較高的物種有玉米(Zeamays)(52次)、小立碗蘚(Physcomitrellapatens)(53次)、水稻(Oryzasativa)(57次)、蒺藜苜蓿(Medicagotuncatula)(59次)和大豆(Glycinemax)(65次)等,前10名物種比對上的序列僅有437條。圖1中列出e值最小,即匹配度最高的blast對應的物種。結果的指向性更加明確,在比對上的183條序列中,匹配次數最高的的物種為:隱藻(Guillardiatheta)(3次)、條斑紫菜(Pyropiayezoensis)(3次)、極地膠球藻(Coccomyxasubellipsoidea)(4次)、龍須菜(G.lemaneiformis)(4次)、銅綠微囊藻(Microcystisaerugisona)(5次)、細基江蘺(Gracilariatenuistipitata)(5次)、長囊水云(Ectocarpussiliculosus)(6次)、蒺藜苜蓿(Medicagotuncatula)(6次)、小立碗蘚(Physcomitrellapatens)(9次)等,其中日本凋毛藻(Griffithsiajaponica)(17次)最多,共計62次,并且物種中藻類明顯增加。同時,可以看到blast結果中顯示大量沒有任何序列可以匹配的待測序列,推測為紅藻或龍須菜及其近緣物種的特有基因,這些序列也是未來研究的難點和重點。

圖1 Blast匹配度最高的物種分布圖Fig.1 Top-Hit species distribution
將GO注釋過的基因歸類到基因本體論的三大詞條下,如圖2、3、4所示。在對生物學途徑注釋結果的分析中發現,其中最多的為參與機體的代謝途徑的序列(210條),另外包括有關細胞途徑、生物調控、生物合成、信號傳遞、復制、應激反應、發育過程、細胞定位、細胞組分生源的序列等。分子功能注釋結果中,包括與轉移酶活性、水解酶活性、裂合酶活性、氧化還原酶活性等酶活性相關的序列,以及與小分子結合、蛋白質結合、核酸結合、離子結合等結合相關的序列等。細胞組件注釋結果中,包括細胞組分、蛋白質復合體組分、無膜細胞器組分、有膜細胞器組分等,分析顯示其絕大多數都在細胞(71條)、細胞器(78條)及蛋白質復合體(23條)水平進行描述。
2.3 熒光定量結果分析
本輪實驗原本選擇了9個重疊群(contig-03、contig-11、contig-19、contig-35、contig-44、contig-52、contig-60、contig-114、contig-116)及3個單條序列(7310、8142、0125)共12條候選基因。由于測序所得片段并非基因全長,最終僅有8條序列優化出合適的反應引物,進行了RT-qPCR驗證。檢測基因及內參基因所使用的引物見表2。
(Viral reproduction process 病毒繁殖過程 Transposition 轉座 System process 系統進程 Stem cell proliferation 干細胞增殖 Small molecule metabolic process 小分子代謝過程 Sexual reproduction 有性生殖 Secondary metabolic process 次生代謝過程 Response to stress 應激反應,脅迫應答 Response to other organism 對其他生物體的反應 Response to external stimulus 應對外部刺激 Response to endogenous stimulus 應對內源性刺激 Response to chemical stimulus 應對化學刺激 Response to biotic stimulus 應對生物刺激 Response to abiotic stimulus 應對非生物刺激 Reproductive process 生殖過程 Regulation of molecular function 分子功能的調控 Regulation of body fluid levels 體液水平的調控 Regulation of biological quality 生物質量的調控 Regulation of biological process 生物過程的調控 Primary metabolic process 初級代謝過程 Pigment metabolic process 色素代謝過程 Pathogenesis 發病機制 Oxidation-reduction process 氧化還原過程 Organophosphate metabolic process 有機磷代謝過程 Organic substance metabolic process 有機物質代謝過程 Nitrogen compound metabolic process 氮化合物代謝過程 Multicellular organismal signaling 多細胞有機體的生物信號 Multicellular organismal metabolic process 多細胞有機體的代謝過程 Multicellular organismal development 多細胞有機體的發育 Multicellular organismal reproduction 多細胞有機體的繁殖 Microtubule-based process 基于微管的生物過程 Methylation 甲基化 Macromolecule metabolic process 大分子代謝過程 Anatomical structure development 解剖結構發育 Biosynthetic process 生物合成過程 Catabolic process 分解代謝過程 Cell activation 細胞活化 Cell communication 細胞通訊 Cell cycle 細胞周期 Cell death 細胞死亡 Cell division 細胞分裂 Cell growth 細胞生長 Cell-cell signaling 細胞間信號 Cellular component biogenesis 細胞組分的生物發生 Cellular component organization 細胞組分的組織結構 Cellular component organization and biogenesis at cellular level 細胞水平上細胞組分結構和生物發生 Cellular developmental process 細胞發育過程 Cellular homeostasis 細胞穩定性 Cellular localization 細胞定位 Cellular metabolic process 細胞代謝過程 Cellular response to stimulus 細胞對刺激的反應 Chromosome segregation 染色體分離 Coagulation 凝結物 Digestion 消化 Establishment of localization 定位的建立 Immune effector process 免疫效應過程 Immune response 免疫反應 Interspecies interaction between organisms 生物體種間相互作用 Macromolecule localization 大分子定位)
圖2 生物過程功能分類中水平3的匹配序列數目
Fig.2 Number of hits for biological process at Level 3
(Transmembrane transporter 跨膜轉運蛋白 Transferase activity 轉移酶活性 Transcription factor binding 結合轉錄因子的 Tetrapyrrole binding 結合四吡咯的 Substrate-specific 基質特異性 Structural constituent of ribosome 結構組成型核糖體 Small molecule binding 結合小分子的 Site-specific recombinase 位點特異重組酶 Sequence-specific DNA 序列特異DNA Protein binding 結合蛋白質的 Cofactor binding 結合輔助因子的 Enzyme activator activity 酶激活物活性 Hydrolase activity 水解酶活性 Integrase activity 整合酶活性 Ion binding 結合離子的 Isomerase activity 異構酶活性 Ligase activity 連接酶活性 Lipid binding 結合脂質的 Lyase activity 裂合酶活性 Metal cluster binding 結合金屬原子簇的 Nucleic acid binding 結合核酸的 Oxidoreductase activity 氧化還原酶活性 Peroxidase activity 過氧化酶活性 Phosphatase regulator 磷酸酶調節物)
圖3 分子作用功能分類中水平3的匹配序列數目
Fig.3 Number of hits for molecular function at Level 3

(Virion part 病毒粒子部分 Vesicle 囊泡 Protein-DNA complex DNA蛋白復合體 Protein complex 蛋白質復合體 Organelle part 細胞器部分 Non-membrane-bounded organelle 非膜系統的細胞器 Apoplast 質外體 Cell part 細胞部分 Cell-cell junction 細胞間連接 extracellular region part 細胞外區域部分 Membrane part 膜部分 Membrane-bounded organelle 膜系統的細胞器)
圖4 細胞成分功能分類中水平3的匹配序列數目
Fig.4 Number of hits for cellular component at Level 3

表2 候選差顯基因熒光定量PCR反應的引物序列Table 2 RT-qPCR primers for candidate differential expression genes
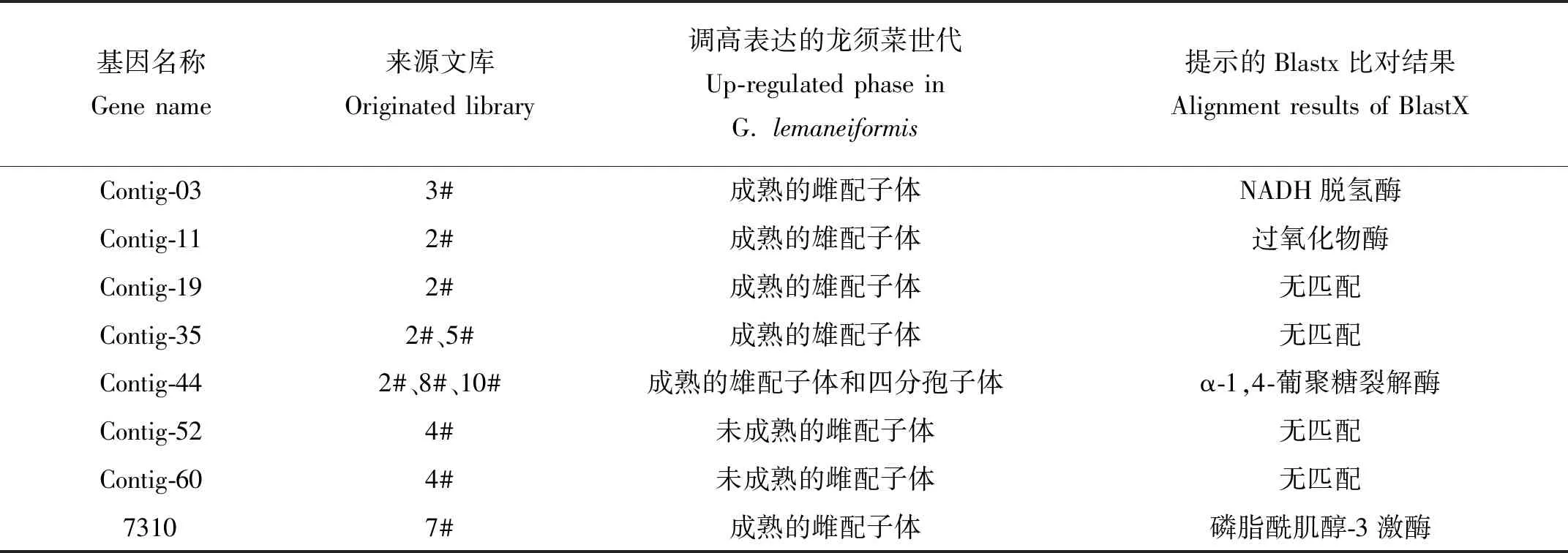
表3 候選差顯基因的來源和性質Table 3 The original library and characters of candidate differential expression genes
以上8條候選序列選自各個SSH文庫,具有一定的代表性,其來源和性質見表3。這里面既有來自于單個庫的多條序列拼接而成的contig及單條序列,也有出現在多個庫中的序列拼接而成的contig。因此有的基因僅僅出現在1個文庫內,如contig-03、contig-11、contig-19、contig-52、contig-60以及7310;有的基因僅出現在一種藻體世代內,如contig-35,盡管在2#和5#庫中都找到了該序列,但這兩個文庫都是成熟的雄配子體分別與成熟的雌配子體和未成熟的雄配子體雜交而來,所以它僅在成熟的雄配子體中調高表達;還有的基因不僅僅出現在一種藻體世代內,如contig-44在多個庫中出現,且不屬于同一個世代,因此它們的情況更加復雜,需要謹慎和深入的分析。
圖5是8條候選序列的在龍須菜不同世代中的相對表達量,每個序列的結果都以3個樣品中表達量最低的值作為參照,每個樣品計算與其的差值作圖。這8條候選基因的實時熒光定量PCR的結果可以分為兩大類,一類是與SSH文庫篩選結果基本一致的,包括contig-03、contig-11、contig-52、contig-60以及7310;另一類則是與SSH文庫篩選結果不一致的,有contig-19、contig-35和contig-44這3條序列。
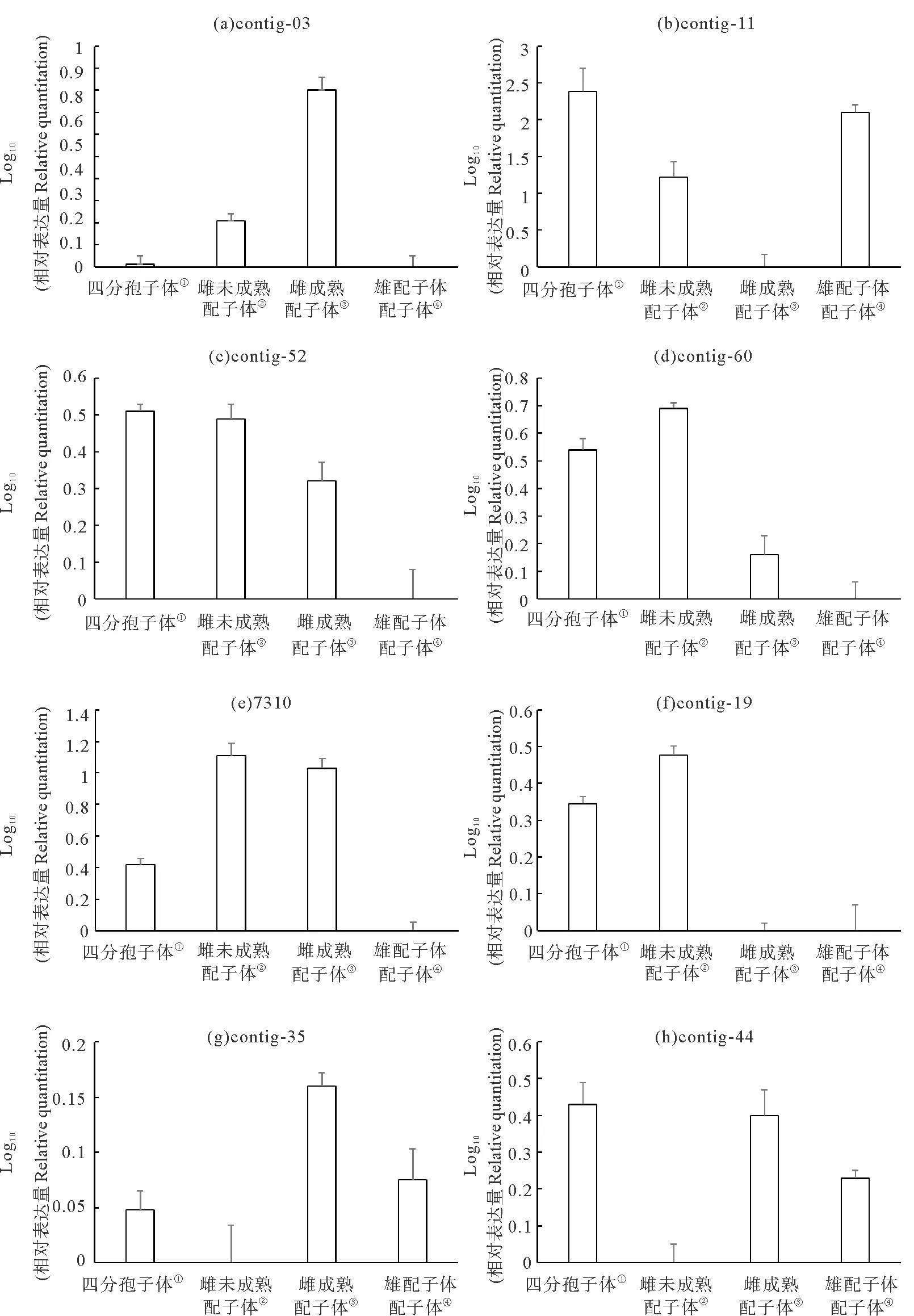
(①Tetrasporaphyte;②Immature female gametophyte;③Mature female gametophyte;④Male gametophyte.)圖5 8個待測序列在龍須菜不同世代中的相對表達定量分析Fig.5 The relative quantitation of the 8 candidate sequences in different phases of G.lemaneiformis
Contig-03來自3#庫,SSH文庫篩選結果顯示,其在成熟雌配子體的表達相對于未成熟雌配子體中調高。圖5(a)顯示的RT-qPCR結果同樣表明,該基因的確是在成熟雌配子體中的表達量顯著高于未成熟雌配子體,在四分孢子體和雄配子體中的表達量遠低于雌配子體,因此contig-03有可能是一條真正與雌配子體世代相關的序列。
Contig-11來自2#庫,根據SSH文庫篩選結果是成熟的雄配子體相對于成熟的雌配子體中調高表達的序列。圖5(b)顯示的RT-qPCR結果表明該基因在成熟雄配子體中的表達量的確顯著高于成熟的雌配子體。但是,結果還顯示該基因在四分孢子體甚至是未成熟雌配子體中也有相似的調高表達,因此contig-11看起來并不是一條與雄配子體世代相關的特異序列。
Contig-52和contig-60這2個基因非常相似,都來自4#庫,根據SSH文庫篩選結果,未成熟雌配子體相對于成熟雌配子體調高表達。圖5(c)、(d)顯示的RT-qPCR結果表明這兩個基因在未成熟雌配子體中的表達量確實都高于在成熟的雌配子體中。但是,結果還顯示它們在四分孢子體中的表達量與在未成熟雌配子體中類似,也高于成熟雌配子體,因此這兩個基因應該也都不是與雌配子體世代相關的序列。
序列7310來自7#庫,根據SSH文庫篩選結果是成熟的雌配子體相對于四分孢子體中調高表達的基因。圖5(h)顯示的RT-qPCR結果表明該基因在成熟與未成熟雌配子體中的表達量類似,都高于在四分孢子體中的表達量,并遠遠高于在雄配子體中的表達量,因此7310也很可能是一條真正與雌配子體世代相關的基因。
Contig-19來自2#庫,根據SSH文庫篩選結果該基因應該在雄配子體中上調表達,但是圖5(c)顯示的RT-qPCR結果表明它在未成熟雌配子體和四分孢子體的表達量均遠高于雄配子體,而在成熟雌配子體中的表達量也非常低,因此contig-19很可能只是一條與生長相關的基因序列。
Contig-35來自2#和5#庫,根據SSH文庫篩選結果,該基因的表達量應該是雄配子體高于成熟雌配子體。而圖5(d)顯示的RT-qPCR結果表明它在成熟雌配子體中的表達量最高,這與SSH文庫篩選結果相反。但該基因在成熟的雌配子體以及雄配子體中的表達量均高于在未成熟雌配子體和四分孢子體中的表達量,暗示contig-35有可能與配子體世代相關。
Contig-44是由2#、8#和10#庫的多條序列混雜拼接而成的一條序列,因此本身就存在矛盾性,既可能在雄配子體中調高表達,也可能在四分孢子體中調高表達。圖5(e)顯示的RT- qPCR結果表明,該基因在未成熟雌配子體的表達量非常低,而在其它3種成熟藻體材料中的表達量都較高,說明contig-44可能是一條與成熟藻體生長相關的基因序列。
3 討論
通過Blast2GO進一步對龍須菜SSH文庫中獲得的1 873條差異顯示基因的生物信息學分析可以看出,這些所得的序列廣泛分布在龍須菜生長發育的多種過程中,參與龍須菜多種生物學功能以及組分構成,更加說明龍須菜性別和世代的遺傳是由多因子參與、多細胞共同完成的復雜生命活動。文庫中大多數的序列都沒有能夠比對上準確的基因信息,說明這些序列有可能是龍須菜,或者親緣關系很近的江蘺屬物種,甚至是紅藻中所特有的基因,還需要大量細致的工作去揭示這一過程的遺傳調控。
根據Blastx的比對結果,提示contig-03 和contig-11分別與NADH脫氫酶活性和過氧化物酶的活性有關,而contig-44可能編碼α-1,4-葡聚糖裂解酶,7310與磷脂酰肌醇-3激酶基因有很高的相似性。其余4個序列均是功能未知的基因。
為了驗證SSH文庫所篩選到的差顯基因的可信度,確定真正在龍須菜不同世代及不同發育階段特異表達或差異表達的基因,本研究利用RT-qPCR方法對一些可能的差顯序列進行了轉錄水平的比較。通過上節對RT-qPCR結果的分析可以得出,contig-03和序列7310有可能是真正與雌配子體世代相關的序列,contig-35也有可能與配子體世代有關,而其余5個序列都基本只是與生長過程有關的基因。其中contig-03的部分序列與NADH脫氫酶活性有一定相似性,可能與發育過程中能量的需求有關;7310則顯示編碼磷脂酰肌醇-3激酶,可能參與了PI3K通路,與細胞的生長、極化和分化有關。但是contig-03與7310的RT-qPCR模式也不相同,盡管都是在雌配子體中的表達顯著高于四分孢子體和雄配子體,但contig-03在成熟雌配子體中的表達量顯著高于未成熟雌配子體,而7310在成熟與未成熟雌配子體中的表達量類似,這可解釋為contig-03是到雌配子體發育的后期才開始行使功能,而7310的表達從雌配子體早期發育階段就開始了。
在RT-qPCR驗證的8條序列中有5條序列與SSH文庫篩選結果基本一致,而另外3條與SSH文庫篩選結果不一致,說明SSH技術的確存在較高的假陽性率。但通過對斑點雜交結果重新的進行聚類后分析以及RT-qPCR驗證,可得到更多更準確的信息,例如contig-44這條序列既在四分孢子體文庫中出現,又在雄配子體文庫中出現,使人對它的作用產生疑惑,但經聚類和RT-qPCR分析,發現該基因很可能在龍須菜成熟部分的表達高于在未成熟部分,它的注釋表明其編碼的是葡聚糖裂解酶。該酶可以將儲存物質——紅藻淀粉降解為果糖,參與龍須菜的糖代謝[18],因此在藻體成熟部分該基因看起來更加活躍。
由此可以看出,采取構建多個SSH文庫共同篩選的方法可以較好過濾掉SSH文庫產生的假陽性克隆,使實驗結果更加準確;而對斑點雜交結果進行進一步的聚類分析和RT-qPCR驗證可以更加有效地提高實驗結果的可信度。

