瓜蔞薤白湯對博來霉素致大鼠肺纖維化內質網應激反應的影響
林家猛,李立華
(1.云南省玉溪市中醫院藥學部,云南 玉溪 653100; 2.安徽中醫藥大學第一附屬醫院藥學部,安徽 合肥 230031)
肺纖維化在臨床上被稱為“間質性肺炎”,其初期病理特征主要表現為各類急性炎癥,學術界對其發病機制尚未有共識[1-2]。在中國,肺纖維化的發病率呈現逐年上升的趨勢。目前臨床上多采用免疫抑制藥和腎上腺皮質激素治療肺纖維化,但該治療方案可造成繼發感染,且不良反應較為嚴重[3]。漢代名醫張仲景《金匱要略》中的經典方劑——瓜蔞薤白湯,在臨床上治療胸痹取得了良好的療效[4]。筆者的前期研究顯示,其對博來霉素誘導的大鼠肺纖維化具有一定的治療效果,但尚未對其治療機制進行相應的研究。本研究將探討瓜蔞薤白湯對博來霉素誘導的肺纖維化大鼠內質網應激反應的影響,從而初步明確其對肺纖維化的干預機制,為其臨床應用提供理論基礎。
1 材料
1.1 實驗動物 健康清潔級雄性Wistar大鼠40只,購于安徽醫科大學實驗動物中心[動物生產許可證號為SCXK(皖)2011-002,動物使用許可證號為SYXK(皖)2011-007],體質量160~200 g,周齡6~7周,所有大鼠均不帶有人獸共患病原、烈性傳染病病原、常見傳染病病原及對動物危害大和對研究干擾大的病原,且所有大鼠具有相同遺傳背景。實驗前對其進行1周的適應性喂養,保證大鼠可自由進食、飲水,維持正常的晝夜規律,設置環境濕度50%左右,溫度24 ℃左右。大鼠所用飼料為標準飼料,由安徽中醫藥大學實驗動物中心提供。
1.2 實驗用藥 強的松(批號 110465)由浙江仙琚制藥股份有限公司生產;瓜蔞(批號20121103)、薤白(批號 20121015)均由深南中藥飲片公司提供,購入后均由安徽中醫藥大學第一附屬醫院主任中藥師李立華進行相應鑒定,鑒定標準參考《中華人民共和國藥典》2015年版。瓜蔞薤白湯是通過正交試驗驗證的提取方案獲得的濃縮醇提取物。臨用時由生理鹽水配成使用濃度。
2 方法
2.1 動物分組及模型復制 結束適應性飼養后,將大鼠隨機分成正常對照組、模型組、陽性對照組(按照3.6 mg/kg的劑量給予強的松)、瓜蔞薤白湯組(按照2.8 g/kg的劑量給予瓜蔞薤白湯),每組10只。實驗中的藥物劑量均參考人體正常用藥量和人與大鼠體質量的比例計算獲得。將4組大鼠通過腹腔注射10%水合氯醛進行麻醉,并完成氣管插管,其中模型組、陽性對照組、瓜蔞薤白湯組按照5 mg/kg的劑量注射博來霉素復制肺纖維化模型,正常對照組則根據大鼠體質量注入同等容積的生理鹽水。隔日對陽性對照組和瓜蔞薤白湯組通過灌胃給予相應的治療藥物,正常對照組、模型組則根據大鼠體質量給予同等容積的生理鹽水灌胃,各組每日灌胃1次,每周均根據大鼠的體質量變化對用藥量進行相應的調整,給藥持續28 d。一般20 d后便可取出大鼠肺組織進行檢測,當支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)細胞數量和膠原蛋白的沉積明顯增高時可視為模型復制成功。
2.2 大鼠生理指標及肺組織病理檢測 第28天麻醉大鼠后選擇股動脈放血法處死大鼠。及時取出各組大鼠肺組織,并稱質量和觀察大體形態,統一留取各組大鼠左下肺組織置于4%多聚甲醛溶液中固定。將剩下的肺組織保存于-80 ℃的冰箱中,以備其他指標的檢測。肺系數=肺濕質量/體質量。取經過固定的肺組織,依據病理學方法步驟進行脫水、包埋、切片等操作,分別行Masson和蘇木精-伊紅染色法(hematoxylin-eosin staining,HE)染色。根據Szapiel等[5]的方案對大鼠進行肺炎癥狀評分,選擇單盲法于各組樣本中隨機選取8個視野觀察肺泡炎癥并分級,0級計1分,1級計2分,2級計3分,3級計4分。具體評級標準見表1。
依據Ashcroft等[6]的方案對肺纖維化癥狀進行評分,選擇單盲法于各組樣本中隨機選取8個視野觀察肺泡纖維化程度并分級。具體評級標準見表2。0級計1分,1級計2分,2級計3分,3級計4分,每組8個樣本分別評分,并計算平均值。
2.3 免疫組織化學法檢測內質網應激相關蛋白表達水平 取經多聚甲醛固定的肺組織切片后脫蠟,進行抗原修復,滴加磷酸化蛋白激酶RNA樣內質網激酶(phospho-protein kinase RNA-like ER kinase,p-PERK)、磷酸化肌醇蛋白酶1α(phospho-inositol-requiring enzyme 1α,p-IRE1α)、葡萄糖調節蛋白78(glucose regulated protein 78,GRP78)或激活轉錄因子6α(activating transcription factor 6α,ATF6α)抗體(按照1∶80進行配制),孵育時放置于4 ℃環境中過夜。通過DAB進行顯色,接著使用蘇木精進行復染,隨機取各切片中的200倍視野10個,從各組隨機選取切片4張,圖像采集選擇Olympus公司圖像采集系統,半定量分析則通過Image-Pro Plus圖像分析軟件進行,目的蛋白表達的計算選擇積分光密度(integral optical density,IOD)與面積比值法。

表1 肺炎癥狀評級標準

表2 肺纖維化癥狀評級標準
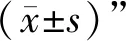
3 結果
3.1 各組大鼠肺的大體形態學變化和肺系數比較 正常對照組大鼠的肺臟為粉紅色,外觀基本正常,肺泡壁彈性正常且光滑;模型組大鼠肺顏色較暗,部分可呈現灰白色,存在分布均勻的點狀瘀血斑;陽性對照組與瓜蔞薤白湯組大鼠肺顏色較模型組紅潤,可見少量灰白色部位和點狀瘀血斑。模型組大鼠的肺系數相較于其他3組均明顯增加(P<0.05);且陽性對照組的肺系數顯著高于瓜蔞薤白湯組大鼠(P<0.05)。見表3。
3.2 各組大鼠肺組織形態學變化比較 HE染色后光鏡下發現,正常對照組大鼠肺泡壁較薄,具有完整的肺泡結構,未發現炎癥細胞浸潤或充血等情況;模型組大鼠肺泡壁變厚,眾多肺泡出現塌陷,部分可見融合成大肺泡,肺泡中具有明顯的炎癥細胞浸潤或充血等情況;陽性對照組與瓜蔞薤白湯組大鼠的炎癥程度相較于模型組顯著減輕(P<0.05);陽性對照組與瓜蔞薤白湯組大鼠的肺仍可保持肺泡結構,但肺泡間隔存在局部變厚,肺泡較少存在融合。見表3、圖1。Masson染色后光鏡下發現,正常對照組大鼠具有完整肺泡結構,無藍色膠原在肺泡間隙沉積;模型組大鼠雙肺喪失了絕大部分肺泡結構,可見藍色膠原大量沉積于間質,肺部實變,其纖維化程度相較于陽性對照組和瓜蔞薤白湯組大鼠明顯增加(P<0.05);陽性對照組與瓜蔞薤白湯組大鼠肺泡間隔的膠原沉積情況較輕,其纖維化程度與正常對照組比較,差異無統計學意義(P>0.05)。見表3、圖1。
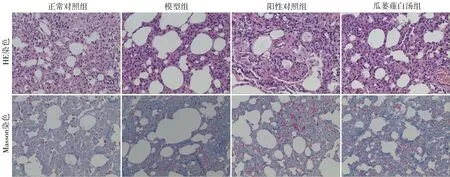
圖1 各組大鼠肺臟組織形態學變化比較(10×10倍)
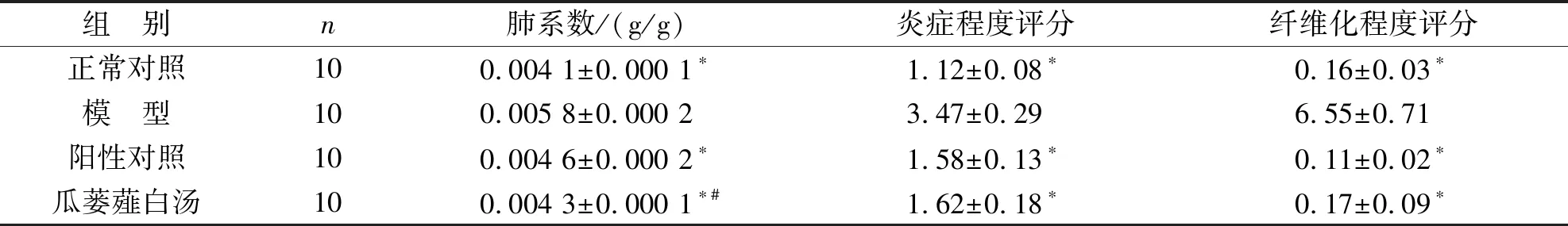
組 別n肺系數/(g/g)炎癥程度評分纖維化程度評分正常對照100.004 1±0.000 1?1.12±0.08?0.16±0.03?模 型100.005 8±0.000 23.47±0.296.55±0.71陽性對照100.004 6±0.000 2?1.58±0.13?0.11±0.02?瓜蔞薤白湯100.004 3±0.000 1?#1.62±0.18?0.17±0.09?
注:與模型組比較,*P<0.05,與陽性對照組比較,#P<0.05
3.3 各組大鼠肺組織內質網應激相關蛋白表達水平比較 與正常對照組比較,模型組大鼠肺組織中p-PERK、p-IRE1α、GRP78和ATF6α的表達水平顯著升高,差異有統計學意義(P<0.05);與模型組比較,陽性對照組和瓜蔞薤白湯組大鼠肺組織中p-PERK、p-IRE1α、GRP78和ATF6α的表達水平顯著降低,差異有統計學意義(P<0.05);與陽性對照組比較,瓜蔞薤白湯組大鼠肺組織中p-PERK、p-IRE1α、GRP78和ATF6α表達水平的差異無統計學意義(P>0.05)。見圖2、表4。
4 討論
細胞外基質的異常沉積導致的肺組織結構被取代和肺成纖維細胞聚集是肺纖維化的重要病理特征[7]。目前,與人類肺纖維化病理學變化相似度最高的模型是博來霉素誘導的大鼠肺纖維化。前期的文獻研究顯示,肺纖維化在博來霉素經氣管注入大鼠后14 d就可形成[8]。而強的松作為臨床上廣泛使用的糖皮質激素,可以控制肺纖維化,在藥理學研究中也可用作抗肺纖維化藥物篩選的陽性對照藥。本研究中,模型組大鼠肺組織病理結果顯示大鼠肺泡壁變厚,眾多肺泡出現塌陷,部分可見融合成大肺泡,肺泡中具有明顯的炎癥細胞浸潤或充血等情況,而Masson染色結果則顯示藍色膠原大量沉積于間質,肺部實變。以上證據都表明博來霉素誘導的大鼠肺纖維化模型復制成功。而瓜蔞薤白湯對于博來霉素造成的炎癥反應可發揮較好的治療效果,同時可改善纖維化程度和藍色膠原在肺泡間隙沉積,提示瓜蔞薤白湯對博來霉素所致大鼠肺纖維化具有較好的治療效果。

圖2 各組大鼠肺組織內質網應激相關蛋白表達情況(免疫組織化學法,10×10倍)
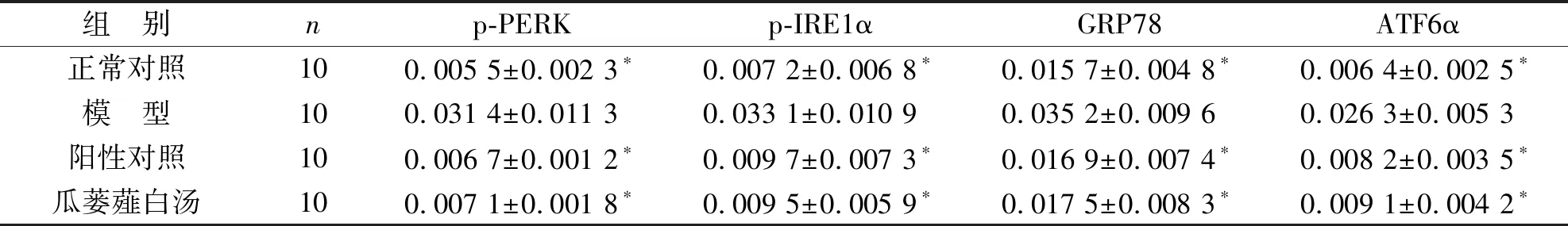
組 別np-PERKp-IRE1αGRP78ATF6α正常對照100.005 5±0.002 3?0.007 2±0.006 8?0.015 7±0.004 8?0.006 4±0.002 5?模 型100.031 4±0.011 30.033 1±0.010 90.035 2±0.009 60.026 3±0.005 3陽性對照100.006 7±0.001 2?0.009 7±0.007 3?0.016 9±0.007 4?0.008 2±0.003 5?瓜蔞薤白湯100.007 1±0.001 8?0.009 5±0.005 9?0.017 5±0.008 3?0.009 1±0.004 2?
注:與模型組比較,*P<0.05
瓜蔞薤白湯作為臨床應用中的經典方劑,其適應證主要有胸背徹痛、喘息咳唾、短氣等,對于胸痹具有顯著的療效[9]。該方的組成為薤白和瓜蔞,其中瓜蔞主要發揮滌痰散結、理氣寬胸的作用;薤白則發揮通陽散結、溫通滑利、行氣止痛之功效,經過配伍后可發揮保護缺血心肌,抗低氧及阻止血小板的聚集等作用[10-11]。對于瓜蔞薤白湯的研究重點目前主要集中在藥理活性及臨床應用方面,而對其發揮作用的相關機制研究較少[12]。
為進一步確定瓜蔞薤白湯對大鼠肺纖維化發揮治療作用機制,筆者通過免疫組織化學法對模型組和瓜蔞薤白湯組大鼠肺組織中內質網應激相關蛋白的表達進行檢測。結果顯示模型組大鼠肺組織中p-PERK、p-IRE1α、GRP78和ATF6α的表達水平相較于正常對照組大鼠顯著升高,而經過瓜蔞薤白湯干預后p-PERK、p-IRE1α、GRP78和ATF6α的表達水平顯著降低。內質網作為真核生物中的細胞器,其主要在合成脂類、蛋白質折疊及生成糖原等多方面發揮重要影響[13]。當機體出現氧化應激、化學損傷及營養缺乏等因素刺激后,內質網的相關功能均會受到影響,造成內質網腔內未折疊及錯誤折疊的蛋白質蓄積而引發內質網應激[14]。越來越多的文獻報道顯示內質網應激參與肺纖維化的發病過程中[15]。內質網應激可作用于PERK、ATF6及IRE1等相關通路,進而促進細胞凋亡、刺激炎癥反應等促進肺纖維化的發生發展[16]。當內質網的分子伴侶GRP78結合內質網應激的未折疊蛋白中ATF6、PERK和 RE1 3個跨膜蛋白,此時細胞可處在穩定狀態,當受到相關刺激時,其原本的結合狀態會出現解離,從而使未折疊蛋白的3條通路被激活,未折疊蛋白作為內質網應激的敏感蛋白,發生反應后其表達可發生上調[17]。內質網應激可以通過激活ATF6、PERK和IRE1 3條通路引起炎癥反應、細胞凋亡及上皮-間質轉化進而導致肺纖維化的形成。本實驗結果表明,模型組大鼠GRP78呈現高表達,而經過瓜蔞薤白湯干預后GRP78的表達受到抑制。當發生內質網應激反應時跨膜蛋白PERK的激活通過磷酸化進行,進而磷酸化eIF2α,最終活化核因子κB引發炎癥反應[18]。本實驗結果顯示,瓜蔞薤白湯可顯著抑制博來霉素激活的PERK磷酸化程度。IRE1α主要作用于c-Jun氨基末端激酶信號通路來引發炎癥及凋亡反應[19]。本實驗結果同樣表明,瓜蔞薤白湯可顯著抑制博來霉素激活的IRE1α磷酸化程度。活化的ATF6作用于P38,進而導致炎癥反應。研究結果顯示,經瓜蔞薤白湯干預后,ATF6α的表達水平相較于模型組顯著降低。綜合本實驗結果,提示瓜蔞薤白湯可顯著抑制博來霉素激活的內質網應激反應的3條通路。文獻報道顯示,內質網應激作用于未折疊蛋白反應的3條通路,可導致炎癥反應,同時內質網應激也可導致氧化應激和細胞凋亡等[20]。
綜上所述,本研究結果表明,瓜蔞薤白湯治療博來霉素誘導的大鼠肺纖維化可能與抑制內質網應激有關。總之,通過瓜蔞薤白湯對肺纖維化大鼠的治療作用及可能機制的研究,為其臨床治療肺纖維化提供了新的證據。

