地龍降壓膠囊對慢性間歇低氧高血壓模型大鼠心肌缺氧的影響
張小平 趙信科2 李長天* 劉永琦 王碧瑩 岳曉華 孫少伯 羅露露2 謝曉蓉
1.甘肅中醫藥大學,甘肅 蘭州 730000;2.甘肅中醫藥大學附屬醫院,甘肅 蘭州 730000
阻塞性睡眠呼吸暫停低通氣綜合征(Obstructive sleepapnea hypopnea syndrom,OSAHS)患者睡眠過程中會反復出現氣道阻塞及呼吸中斷、睡眠期間反復短暫缺氧為主要生理特征,研究已經證實間歇性低氧可以誘發持續的繼發性血壓升高,是高血壓發病的獨立危險因素之一[1]。研究發現,模擬患者的慢性間歇低氧模式可導致大鼠持續性血壓升高[2],證明慢性間歇缺氧可以導致高血壓發生。蚯蚓俗稱地龍,《神農本草經》和《本草綱目》記載地龍具有通絡、活血化瘀的功效。本研究試圖通過觀察地龍提取物地龍降壓膠囊是否能夠通過促進血液循化改善慢性間歇低氧誘發高血壓大鼠的心肌缺氧,進而探討地龍降壓膠囊臨床治療高血壓的機制。
1 材料和方法
1.1 材料 8周齡SPF級SD大鼠,平均體重 230 g,甘肅中醫藥大學實驗動物中心提供;低壓氧艙 FLYDWC 50-IIA(貴州風雷航空軍械有限責任公司);地龍降壓膠囊(甘肅中醫藥大學附屬醫院院內制劑,生產批號:151026);鼠儀BP-98A智能血壓計(北京軟隆生物技術有限公司)。超氧化物歧化酶、乳酸脫氫酶、谷胱甘肽過氧化物酶檢測試劑盒均購自南京建成生物工程研究所。
1.2 方法
1.2.1 間歇低氧高血壓模型建立 SD雄性大鼠40只隨機分成5組,每組8只,分為空白對照組(UC組,正常飼養)、慢性間歇低氧組(CIH組)、慢性間歇低氧+地龍降壓膠囊低劑量組(CIH+lowDL組)、慢性間歇低氧+地龍降壓膠囊中劑量組(CIH+midDL組)、慢性間歇低氧+地龍降壓膠囊高劑量組(CIH+highDL組)。根據文獻[3-4]建立慢性間歇低氧高血壓模型:在低壓氧艙內,每天8 h給予間歇低氧循環干預( 6%~8% 的O240 s,隨之21% 的O280 s),共2周。
1.2.2 給藥及血壓測量 地龍降壓膠囊干預組用地龍降壓膠囊溶于37℃溫水灌胃每日3次:每次低劑量組25 mg/kg體重、中劑量組50 mg/kg體重、高劑量組100 mg/kg體重。對照組及模型組給予等體積的蒸餾水灌胃。大鼠心率平穩時用智能無創血壓計套尾測量大鼠的尾動脈收縮壓(SBP)。
1.2.3 大鼠心肌組織HIF-1α免疫組化染色 石蠟切片用梯度酒精脫蠟,PBS洗滌兩次后, 0.01 M檸檬酸鈉緩沖溶液中高壓(125℃·103 KPa)修復15 min,自然冷卻后,0.02 MPBS洗3 min×3次,用3%過氧化氫孵育使內源性過氧化物酶失活,洗滌。37 ℃下兔血清封閉20 min,洗滌后加HIF-1α單克隆抗體(1∶400,武漢博士德公司) 濕盒4 ℃孵育過夜。洗滌后滴加maxvision二抗室溫30 min,洗滌后DAB顯色,蘇木精復染,樹膠封片,顯微鏡拍照。最后在 200 倍光鏡下,隨機選取5個視野,使用Image Pro-Plus6.0圖像分析軟件進行分析和平均光密度(MOD)值測定。
1.2.4 Western blot檢測心肌細胞內HIF-1α蛋白水平 大鼠心肌組織加液氮研缽研磨后,加入4 ℃預冷的組織裂解液(樣品∶組織裂解液=1∶6重量比)處理20 min后,超聲破碎,離心,提取細胞總蛋白,Bradford比色法測定蛋白質濃度。95 ℃水浴變性后每孔上樣20 μg,12%分離膠、5%濃縮膠SDS-PAGE電泳,轉膜(40 min),4 ℃下 5%脫脂奶粉封閉2 h。加一抗(HIF-1α∶1∶300;GAPDH∶1∶1000)4°C孵育過夜,TBST洗膜,再與辣根過氧化物酶標記的二抗(1∶1000)室溫孵育2 h。ECL化學發光法顯影,Bio-Rad凝膠成像儀成像, Bandscan 5.0 軟件進行灰度掃描分析。
1.2.5 相關酶指標的測定 水合氯醛麻醉后,心臟取血 5 mL,室溫靜置30 min, 3000 r /min離心5 min,吸取血清,液氮保存。按試劑盒說明檢測乳酸脫氫酶(LDH)、過氧化物歧化酶(SOD)、谷胱甘肽過氧化酶(GSH-PX)的活性。
2 結果
2.1 大鼠血壓的變化 血壓監測的結果表明,第0天各組大鼠尾動脈收縮壓沒有明顯差異,第7天CIH 組SBP 比間歇性低氧前顯著升高[(120.83±17.79) vs(149.39±13.81) mmHg,P<0.05],CIH+lowDL組、CIH+midDL組、CIH+highDL組也均有不同程度的升高,相對而言,高劑量地龍降壓膠囊干預組升高幅度較小。干預第14天,相對于UC組,CIH 組和CIH+lowDL組大鼠出現穩定的高血壓狀態(P<0.05);和CIH 組相比,中、高劑量地龍降壓膠囊干預一定程度上防止了血壓的升高(P<0.05)。見表1。
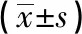

組別例數SBP/mmHg第0天第7天第14天UC組 8122.77±12.62119.38±12.55 120.52±10.71CIH組 8120.83±17.79149.39±13.81 143.57±16.77CIH+lowDL組8124.48±13.59146.74±13.62 145.94±19.21CIH+midDL組8124.67±16.32140.62±13.29 134.74±17.28?CIH+highDL組8119.61±19.84133.74±16.51? 129.78±18.63?
注:與模型組相比,*P<0.05。
2.2 大鼠心肌組織HIF-1α的表達的影響 使用Image-ProPlus 6.0軟件對免疫組化結果進行分析和平均光密度(MOD)值測定,結果見圖1、表2。與空白對照組相比,間歇低氧能導致HIF-1α表達的顯著升高(P<0.01);與模型組相比,高劑量和中劑量地龍降壓膠囊能明顯降低HIF-1α的表達(P<0.05)。見表2。

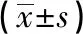

組別例數MOD值UC組80.483±0.023CIH組80.89±0.047CIH+lowDL組80.764±0.001CIH+midDL組80.673±0.003?CIH+highDL組80.532±0.036?
注:與模型組相比,*P<0.05。
2.3 對心肌細胞HIF-1α的表達的影響 Western blot檢測心肌細胞HIF-1α的表達,UC組表達非常輕微,幾乎檢測不到,CIH組HIF-1α的表達量比UC組明顯增加(P<0.01),地龍降壓膠囊干預后,HIF-1α的表達出現不同程度的下降,高劑量組下降最為明顯,是CIH組的0.57倍(P<0.05),中、低劑量組分別是CIH組表達量的0.73、0.89倍。如圖2所示。

2.4 對大鼠心肌LDH、SOD和GSH-PX 酶活性的影響 和UC組相比,CIH組SOD及GSH-PX的含量下降,而LDH含量升高。地龍干預后, 干預組LDH 活性比CIH組明顯下降(P<0.05,表3),SOD和GSH-PX 的變化不明顯(P>0.05)。見表3。


組別例數LDH SOD GSH-PXUC組81.26±0.26168.2±3.17157.1±3.67CIH組81.86±0.19157.6±2.87147.3±2.69CIH+lowDL組81.73±0.31155.2±4.32143.2±1.27CIH+midDL組81.60±0.40?157.1±3.11146.3±1.11CIH+highDL組81.54±0.22?152.6±1.78148.5±3.51
注:與模型組相比,*P<0.05。
3 討論
冠心病、高血壓、心竭等心腦血管疾病都和OSAHS存在一定的相關性[5],而且動物模型和人體模型都證實了間歇缺氧和高血壓的相關性[2]。此次研究也證實了類似的結果,證明間歇缺氧確實能引起大鼠血壓升高(表1),一周的間歇缺氧就能有效引發大鼠血壓升高,兩周的間歇缺氧能形成穩定的高血壓。
中醫學認為高血壓與血瘀關系較為密切,因氣虛而產生痰、瘀等,因此高血壓病可以從瘀辨證治療[6]。湯爾峰等利用抵當湯的活血化瘀、瀉下通腑作用通過改善組織缺血缺氧而改善高血壓癥狀[7]。地龍降壓膠囊主要成分是地龍蛋白提取物,含有蚓激酶、纖溶酶、膠原酶、纖溶激活蛋白、微量元素等多種成分。它能通過影響人體凝血系統和纖溶系統,減少了血管阻力、降低血液粘稠度而改善微循環,產生降壓作用[8]。此次研究發現,地龍降壓膠囊干預大鼠血壓明顯出現下降趨勢(表1),可能與地龍提取物通過改善微循環而改善組織缺氧有一定關系。
低氧誘導因子-1 (hypoxia inducible factor-1,HIF-1) 是低氧誘導產生的一種轉錄調節因子, 由HIF-1α和HIF-1β組成, HIF-1α的表達受氧濃度的調節,對調節氧平衡非常重要,心肌缺血缺氧會引起HIF-1α 表達增加[9]。此次研究發現, 地龍降壓膠囊除了對間歇缺氧引起的大鼠高血壓有一定的改善作用外,而且經過干預以后,大鼠心肌組織和心肌細胞HIF-1α的表達比間歇低氧組有明顯的降低(圖1、2), 可能在一定程度上,地龍降壓膠囊促進了微循環,因而改善了組織缺氧。另一方面,Harrington JP等發現地龍蛋白能夠被用作治療性氧載體[10],可能本研究中地龍降壓膠囊在改善微循環的同時,也能增加組織供氧,因此對組織缺氧有一定的緩解和改善。而且生化酶學指標檢測發現,缺氧導致LDH活性升高,可能與無氧酵解加強有關,但地龍降壓膠囊干預后LDH明顯活性下降,然而SOD和GSH-PX活性與低氧模型組相比沒有顯著性差異(表3),可能進一步證明地龍降壓膠囊是通過改善組織缺氧而不是抗氧化的方式來緩解缺氧性高血壓的癥狀。綜上所述,地龍降壓膠囊可能主要通過改善組織微循環而改善組織缺氧,因此對缺氧性高血壓的發生有一定緩解。

