HMGN5基因敲除對人膀胱上皮癌細胞順鉑化療敏感性的影響
周劍文,羅廣承,王新君,顏志堅
0 引言
尿路上皮癌(UBC)目前發病率已居于泌尿生殖道惡性腫瘤第2位,其中超過30%在首次診斷時已進入晚期,總體臨床預后仍較差[1]。對于尿路上皮癌晚期仍主要采用以順鉑(CDDP)為基礎的化療方案,但總體反應率仍不足50%,而這可能與CDDP抵抗現象發生有關[2],但目前為止,醫學界對于UBC患者CDDP抵抗形成機制尚未完全闡明。高遷移率族核小體結合域5(HMGN5),也稱為NBP-45、GARP45或NSBP1,是2001年國外學者鑒定所得HMGN蛋白質家族的最新成員[3]。近年來研究證實,HMGN5在各種人類腫瘤中呈過度表達,具有明顯致癌作用[4]。但該基因對癌細胞化療敏感性影響仍存在爭議。已有研究顯示,HMGN5基因敲除可通過調節E-Cad和VEGF表達,干擾人UBC 5637細胞活性和侵襲性;而肌動蛋白和轉錄因子與CDDP抵抗發生有關;同時抑制VEGF-C表達亦能夠逆轉UBC細胞對順鉑的抵抗效應[5-6]。本研究通過觀察HMGN5基因敲除對人膀胱上皮癌細胞CDDP化療敏感性的影響,旨在探索其具體作用機制,尋找潛在治療靶點,現報道如下。
1 材料和方法
1.1 細胞培養方法 人UBC 5637、Um-UC-3及T24細胞系均由長沙贏潤生物技術有限公司提供;細胞保存于RPMI 1640中,在恒溫(37 ℃)、5%CO2培養箱,同時添加胎牛血清。
1.2 轉染及給藥方法 轉染方法:長沙贏潤生物技術有限公司合成HMGN5(5′-GTT-GTT-GAA-GAC-TAC-AAT-3′)最有效shRNA序列,并將其克隆到pYr-LVsh載體形成針對HMGN5慢病毒載體;將UBC細胞接種于6孔板(5×104個細胞/孔)至細胞充分融合,再采用重組慢病毒感染細胞(50倍),感染時間為24 h;繼續以RPMI-1640培養基和普氏霉素(1 μg/ml)替換培養基,以篩選陽性穩定轉染子;實驗中使用空白對照(未感染對照)證明未感染對照與shcontrol慢病毒轉染細胞間無顯著差異。
給藥方法:CDDP在無菌血清中梯度稀釋為0、1、2、4、8及16 μg/ml濃度,PI3K信號激活劑和胰島素樣生長因子-1由PeproTech提供并溶解于二甲基亞砜;使用配置好梯度濃度CDDP加入UBC細胞或感染慢病毒細胞,實施72 h劑量依賴性細胞增殖試驗,同時添加IGF-1(50 ng/ml)。
1.3 Western blot試驗 UBC細胞加入CDDP(6 μg/ml)處理,加或不加IGF-1(50 ng/ml),采用溶解緩沖液溶解,參考文獻方法完成Western blot檢測;其中抗HMGN5抗體由Abcam提供(1∶1 000),抗AKT抗體、磷酸化(P)-AKT抗體、Slug抗體、E-Cad抗體、VEGF-C抗體、細胞色素C抗體、裂解半胱天冬酶-3、裂解PARP及β-actin均由Cell Signaling Technology提供。
1.4 細胞增殖試驗 采用MTT試驗評估CDDP處理后細胞增殖水平;將細胞接種于96孔板(4×103個細胞/孔)上并采用梯度濃度CDDP處理;24 h后將MTT(5 mg/ml)在37 ℃添加至細胞處理4 h;繼續采用DMSO溶解活細胞形成紫藍色甲瓚晶體,490 nm波長下測量吸光度。
1.5 菌落形成試驗 轉染72 h后,細胞以400個/孔密度接種至6孔板;RPMI-1640培養基中加入CDDP(6 μg/ml),加或不加IGF-1(50 ng/ml),每隔3 d換液,連續2周;200倍光鏡下計數菌落(≥50個菌落),室溫以純甲醇固定15 min,采用0.005%龍膽紫染色20 min。
1.6 細胞侵襲試驗 采用Transwell試驗評估細胞侵襲情況。每個Transwell插入物(孔徑8 μm)上部鋪有基底膠,接種含不同HMGN5表達水平膀胱癌5 637細胞(1×105個);細胞在37 ℃溫度下培養于血清游離RPMI 1 640培養基,采用CDDP(6 μg/ml)和IGF 1(50 ng/ml)處理;培養24 h,細胞遷移后采用棉簽去除上腔黏附細胞,室溫下加入4%多聚甲醛固定表面細胞30 min,并繼續采用0.1%結晶紫染色20 min,采用200倍共焦顯微鏡計數。
1.7 細胞凋亡試驗 采用膜聯蛋白V-熒光素異硫氰酸鹽法檢測細胞凋亡狀態,試劑盒由南京科根生物技術有限公司提供;感染、CDDP(6 μg/ml)及IGF-1(50 ng/ml)處理24 h后,收集細胞以膜聯蛋白V和碘化丙烷暗室標記。采用BD流式細胞檢測細胞凋亡,并采用BD-Facsdiva 6.1.3軟件分析。
1.8 Hoechst 33342染色 轉染后24孔板上培養細胞,采用相同方法加CDDP和IGF-1(PI3K/Akt信號激活劑)處理,并繼續添加Hoechst 33342(1 μg/ml);37 ℃下染色20~30 min;以冰PBS洗滌細胞2次,200倍熒光顯微鏡下觀察;凋亡細胞中可見濃稠熒光;凋亡細胞比例計算:5個隨機視野中凋亡細胞數/5個隨機視野中總細胞數。
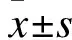
2 結果
2.1 HMGN55蛋白對UBC細胞CDDP敏感性的影響 Western blot試驗檢測UBC細胞株5637、t24及UM-UC-3中HMGN5蛋白表達,其中5637細胞系HMGN5蛋白水平最高,而UM-UC-3細胞中最低(P<0.05),見圖1A。采用細胞增殖MTT試驗檢測以上3種細胞系對于CDDP敏感性,其中5637細胞系對CDPP敏感性顯著高于其他2種(P<0.05),且UM-UC-3細胞系敏感性最高,見圖1B。UBC細胞系HMGN5敲除后P-Akt表達顯著下降(P<0.05),見圖1C。

圖1 HMGN5蛋白對UBC細胞CDDP敏感性的影響
2.2 CDDP 劑量依賴性影響UBC細胞HMGN5表達 Western blot試驗結果中,CDDP對于HMGN5蛋白表達影響具有劑量依賴性方式;同時CDDP處理后P-Akt活性亦隨之降低(P<0.05),CDDP處理還可下調VEGF-C和SLUG表達,上調E-Cad表達(P<0.05);此外,CDDP處理后細胞色素C、裂解半胱天冬酶-3及裂解半胱天冬酶表達均呈劑量依賴性上調(P<0.05),見圖2。
2.3 HMGN5基因敲除可增強5637細胞對CDDP治療敏感性 不同濃度(1~16 μg/ml)CDDP孵育24 h后,與陰性對照細胞相比,HMGN5基因敲除后5637細胞活力顯著下降(P<0.05),見圖3A。菌落形成分析結果提示,與單層培養14 d陰性對照細胞相比,HMGN5基因敲除后5637細胞形成菌落明顯減少(P<0.05),而添加IGF-1后可在一定程度上增加菌落數(P<0.05),見圖3B、3C。HMGN5基因敲除后采用CDDP處理24 h,5637細胞基質凝膠穿過數量顯著下降(P<0.05),見圖3D。流式細胞術結果顯示,5637細胞HMGN5基因敲除后早期凋亡率顯著提高,而加入IGF-1可逆轉這一過程(P<0.05),見圖3E。Hoechst 33342染色法結果顯示,與陰性對照組和IGF-1治療組相比,HMGN5敲除組凋亡核百分比顯著升高(P<0.05),見圖3F。Western blot試驗結果顯示,與對照組相比,HMGN5基因敲除顯著下調P-AKT和VEGF-C表達,上調E-Cad、細胞色素C、裂解半胱天冬酶-3、裂解PARP表達(P<0.05),而添加IGF-1可逆轉以上蛋白質表達變化(P<0.05),見圖3G。

圖2 CDDP劑量依賴性影響UBC細胞HMGN5表達

圖3 HMGN5基因敲除影響5637細胞對CDDP治療的敏感性
3 討 論
HMGN5是HMGN蛋白質家族的最新成員,已有研究顯示,HMGN5具有致癌效應,但其在化療敏感性調節中作用仍未完全闡明[7]。既往報道認為,HMGN5可通過調節E-Cad和VEGF表達,加快UBC病情進展,而這可能與與腫瘤細胞對CDDP敏感性有關[8]。
本研究結果顯示,HMGN5能夠有效調節UBC細胞中P-Akt表達;同時HMGN5表達與UBC細胞對于順鉑敏感性呈負相關。以上均提示HMGN5基因可能是CDDP化療潛在治療靶點,這與CDDP可劑量依賴性下調HMGN5基因表達有關。此外,研究顯示,HMGN5基因敲除可降低5637細胞系存活率、集落形成及侵襲水平,但CD-DP治療后細胞凋亡量升高[9]。IGF-1是PI3K/Akt信號激活劑,其能夠逆轉5637細胞系因HMGN5基因敲除引起的改變[10];隨著HMGN5基因表達水平降低,P-AKT、SLUG、E-Cad及VEGF-C表達同時受到抑制,而HMGN5基因敲除后細胞色素C、裂解半胱天冬酶3及裂解多聚ADP核糖聚合酶表達增加[11]。
國外學者報道顯示,骨肉瘤細胞系中,HMGN5均上調PI3KP85α和P-AKT表達,并可刺激腫瘤細胞惡性潛能[12-13]。本研究結果中,UBC 5637、T24及UM-UC-3細胞系敲除HMGN5基因后,P-Akt表達隨之降低,而Akt表達并未見明顯改變,說明HMGN5基因可能具有PI3K/AKT信號正調節效應,筆者認為可能機制為HMGN5具有蛋白激酶效應,可刺激Akt磷酸化,但HMGN5可能會放大PI3K催化亞單位轉錄水平[14],故這一作用仍有待進一步探討。此外,PI3K/Akt信號還能夠調節EMT進展和VEGF-C表達,基于以上推測HMGN5能夠通過PI3K/Akt信號通路對E-Cad和VEGF水平進行調節。
化療是實體瘤臨床綜合治療重要組成部分,其療效與腫瘤細胞對化療藥物敏感性密切相關[15]。但目前有關HMGN5在調節化療敏感性方面研究爭議較大。部分學者研究顯示,抑制HMGN5基因可有效提高惡性腦膜瘤細胞對替莫唑胺誘導細胞毒性敏感性[16];而在骨肉瘤細胞系中敲除HMGN5基因可通過激活凋亡信號通路增強阿霉素誘導細胞損傷敏感性[17]。但另一項研究顯示,HMGN5表達水平與前列腺癌細胞系對吉西他濱化療敏感性呈正相關,故高表達HMGN5基因可能提高化療效果[18]。MTT試驗結果顯示,與HMGN5基因表達水平較高的細胞相比,表達水平較低的UBC細胞對于CDDP治療敏感性更高;同時HMGN5基因敲除可顯著降低5637細胞系在CDDP治療過程中增殖、菌落形成及侵襲作用,故HMGN5基因表達較高的UBC細胞HMGN基因缺失可能提高腫瘤細胞對于CDDP治療敏感性。
已有研究顯示,PI3K/Akt信號通路異常激活在CDDP抵抗中發揮著關鍵作用,抑制PI3K/Akt信號通路可增強CDPP治療作用[19];同時EMT及其活化劑過度表達與CDDP抵抗性呈正相關。此外,血管內皮生長因子C已參與到CDDP敏感性調節環節[20]。本次研究采用Western blot檢測HMGN5基因敲除后5637細胞系,可見P-Akt、SLUG、E-Cad及VEGF-C蛋白水平受到顯著抑制,提示PI3k/Akt信號傳導、EMT及淋巴管生成參與到這一過程中。國外學者報道顯示,細胞凋亡激活是CDDP發揮抗腫瘤效應的主要機制[21]。本研究采用流式細胞術和Hoechst 33342染色,結果顯示,5637細胞系敲除HMGN5細胞凋亡水平顯著增強。
既往有報道顯示,CDDP可影響HMGN5基因表達及影響其下游信號分子[22]。針對這一現象,筆者認為HMGN5可能是CDDP治療相關分子靶點,故CDDP可直接抑制UBC細胞系中HMGN5表達;而另一種可能是CDDP可直接殺傷UBC細胞,從而導致HMGN5表達量減少。但這一機制仍不明確,尚需更深入研究證實。
綜上所述,HMGN5可能是順鉑治療的潛在靶點,抑制HMGN5基因有助于增加UBC細胞化療敏感性,這一作用主要通過干擾PI3K/Akt信號通路實現。

