噬菌體Guo1、Leo對不同模型休眠期 結核分枝桿菌的裂解作用
江莉莎 郭述良

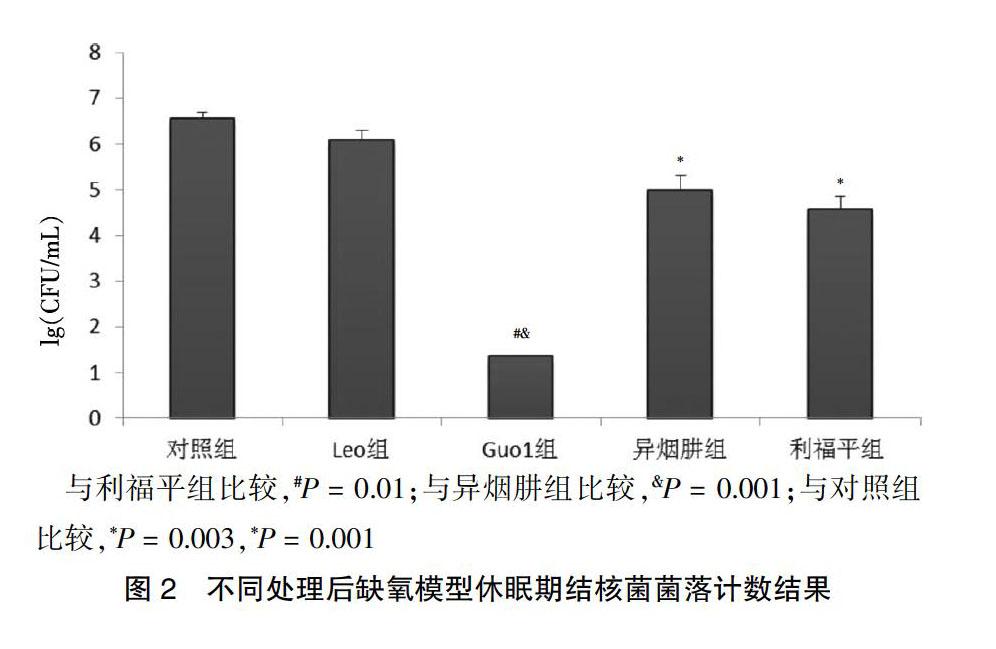
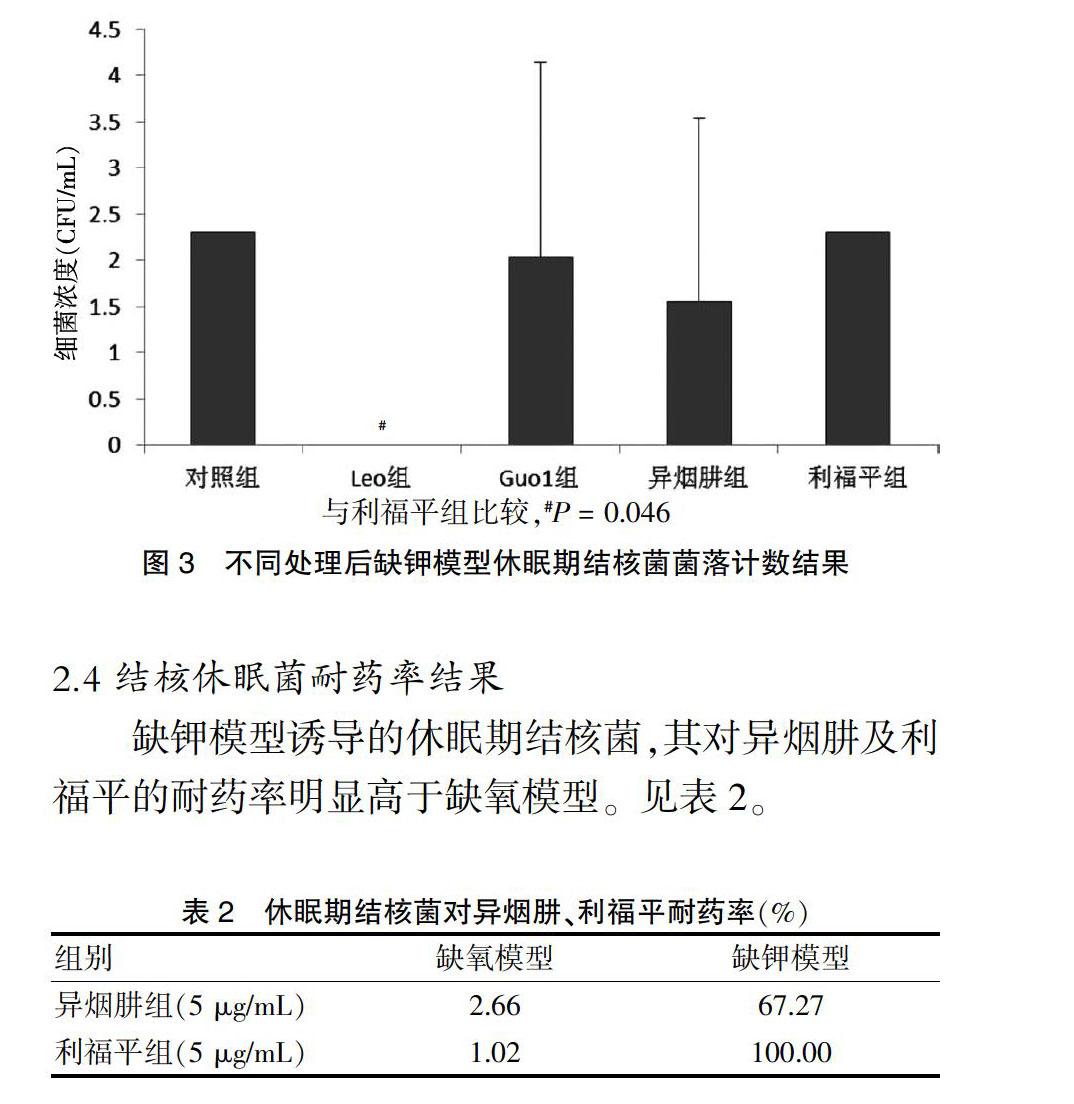
[摘要] 目的 研究噬菌體Guo1、Leo對不同模型休眠期結核分枝桿菌的裂解作用。 方法 利用ClustalX軟件作多重序列對比,尋找噬菌體Guo1、Leo的motif3基序。分別用缺氧模型及缺鉀模型建模方法構建休眠期結核分枝桿菌模型。取缺氧及缺鉀模型誘導的休眠期結核菌菌液,將其分別隨機分成5組,每組設3個復管,每支試管裝2 mL菌液。再向各組試管中分別加入100 μL的異煙肼(終濃度5 μg/mL,異煙肼組)、利福平(終濃度5 μg/mL,利福平組)、噬菌體Leo(滴度2.6×108 PFU/mL,Leo組)、噬菌體Guo1(滴度3.26×108 PFU/mL,Guo1組),對照組加入等量ddH2O。利用最大可能數法,分別檢測休眠期結核菌對異煙肼、利福平的耐藥性及噬菌體對休眠期結核菌的裂解作用。 結果 噬菌體Guo1、Leo的卷尺蛋白中均含有motif3基序,且其motif3基序含6個高度保守的氨基酸殘基、1個高度保守的異亮氨酸-色氨酸位點。當作用于缺氧模型休眠期結核菌時,與利福平組、異煙肼組較較,Guo1組菌量明顯減少(P < 0.05);當作用于缺鉀模型休眠期結核菌時,與利福平組比較,Leo組菌量明顯減少(P < 0.05)。缺鉀模型對異煙肼、利福平的耐藥率明顯高于缺氧模型。結論 相較于缺氧模型,缺鉀模型能誘導結核菌進入更深的休眠狀態。噬菌體Guo1對缺氧模型誘導的休眠期結核菌有裂解作用,噬菌體Leo對缺鉀模型誘導的休眠期結核菌有裂解作用。
[關鍵詞] 噬菌體;休眠期結核菌;缺氧模型;缺鉀模型;裂解作用
[中圖分類號] R52 ? ? ? ? ?[文獻標識碼] A ? ? ? ? ?[文章編號] 1673-7210(2019)12(c)-0004-05
Lysis effect of phage Guo1 and Leo on Mycobacterium tuberculosis in the dormant stage of different models
JIANG Lisha1,2 ? GUO Shuliang1
1.Department of Respiratory and Critical Care Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing ? 400016, China; 2.Department of Respiratory Medicine, the First Branch, the First Affiliated Hospital of Chongqing Medical University, Chongqing ? 400016, China
[Abstract] Objective To investigate the lysis effect of phage Guo1 and Leo on Mycobacterium tuberculosis in dormant stage. Methods ClustalX software was used for multiple sequence comparison. Motif3 motifs of phage Guo1 and Leo were searched. The model of Mycobacterium tuberculosis in dormant stage was constructed by hypoxia model and potassium deficiency model respectively. Hypoxic and potassium deficiency mode induce domant TB bacterial fluid, they were respectively randomly divided into 5 groups, each group was set with 3 duplicate tubes, and each tube was filled with 2 mL bacterial liquid. Then 100 liters of Isoniazid (final concentration: 5 g/mL, Isoniazid group), Rifampicin (final concentration: 5 g/mL, Rifampicin group), phage Leo (titer: 2.6×108 PFU/mL, Leo group), and phage Guo1 (titer: 3.26×108 PFU/mL, Guo1 group) were added to the test tubes of each group, and the control group was added with the same amount of ddH2O. The drug resistance to Isoniazid and Rifampicin in dormant tuberculosis bacteria and the lysis of phage in dormant Tuberculosis bacteria were detected by most probable number method. Results The motif3 motif was found in the tape rule proteins of phages Guo1 and Leo, and the motif3 motif contained 6 highly conserved amino acid residues and 1 highly conserved isoleucine-tryptophan site. When used as hypoxia model for dormant Tuberculosis bacteria, compared with Rifampin group and Isoniazid group, the bacteria quantity of Guo1 group decreased significantly (P < 0.05). Compared with Rifampicin group, the amount of bacteria in Leo group decreased significantly (P < 0.05). The drug resistance rate of potassium deficiency model to Isoniazid and Rifampicin was significantly higher than that of hypoxia model. Conclusion Compared with hypoxia model, potassium deficiency model can induce Tuberculosis bacterium to enter deeper dormant state. Phage Guo1 has cleavage effect on dormant tuberculosis bacteria induced by hypoxia model, and phage Leo has cleavage effect on dormant Tuberculosis bacteria induced by potassium deficiency model.
[Key words] Mycobacteriophage; Mycobacterium tuberculosis; Oxygen-deficient model; Potassium-deficient model; Lysis effect
結核病病程遷延,易復發,其中內源性復發占絕大部分,而導致內源性復發的關鍵因素是休眠期結核分枝桿菌。結核分枝桿菌在不利環境下會進入休眠狀態,休眠期結核分枝桿菌能長期潛伏,逃避機體的免疫殺傷,對經典抗結核藥物耐藥。當機體免疫力下降時,休眠期結核菌又重新復蘇,發展成為活動性結核病,所以休眠期結核菌是結核病復發的根源。相關學者[1-2]發現卷尺蛋白中含有motif3基序的噬菌體能夠識別、感染休眠期結核菌。因此有望找到能裂解休眠期結核菌的噬菌體,為結核病治療提供新思路。
休眠期結核菌的建模方法各異,現已報道了缺氧模型[3]、饑餓模型[4]、酸化模型[5]、多因素模型[6]、維生素C誘導模型[7]、結核肉芽腫模型[8]、缺鉀模型[9]等多種休眠期結核菌體外模型,卻各有優缺點。其中,缺氧模型由Wayne等[3]于1996年建立,是目前研究最透徹、應用最廣泛的模型。缺鉀模型由Salina等[9]于2014年建立,它能誘導出對超高濃度(10、50 μg/mL)利福平表型耐藥的結核菌。但目前國內尚無利用兩種模型同時構建休眠期結核菌,并對其誘導表型耐藥作對比研究的報道。本研究擬尋找候選噬菌體,并驗證其對缺氧模型及缺鉀模型兩種不同模型誘導的休眠期結核菌的裂解作用。
1 材料與方法
1.1 菌種
結核分枝桿菌標準株H37Rv(CMCC93004)由重慶市胸科醫院惠贈,將其接種于中性羅氏培養基(珠海貝索)中培養4~6周后用于后續實驗。分枝桿菌噬菌體Leo由加拿大拉瓦爾大學Félix d′Hérelle噬菌體中心惠贈,分枝桿菌噬菌體Guo1由重慶醫科大學附屬第一醫院傳染病病原學實驗室自行分離。
1.2 motif3基序生物信息學分析
利用ClustalX軟件,比較TM4 motif3基序及Guo1、Leo的卷尺蛋白,并進行多重序列對比,搜索Guo1、Leo的motif3基序。
1.3 構建休眠期結核菌模型
1.3.1 缺氧模型構建 ?參考文獻[3],略有改動,取結核分枝桿菌于7H9液體培養基(BD,美國,含0.2%甘油、10% ADC及0.05% Tween80)中37℃震蕩培養10~15 d。取15 mL試管,向內加入10 mL 7H9液體培養基;再取對數生長期的結核分枝桿菌菌液(OD595 0.4~0.6),研磨均勻,按1∶100的比例加入7H9液體培養基中,然后加入亞甲藍溶液(終濃度1.5 μg/mL),用橡膠塞及密封膜封閉試管口,置于37℃恒溫箱中靜止培養。結核分枝桿菌密閉培養15 d后,亞甲藍變為無色,亞甲藍作為無氧指示劑,變為無色時提示試管內進入完全缺氧狀態。將結核分枝桿菌密閉培養1年以上。一般來說,缺氧環境下培養超過1年的結核分枝桿菌可看作進入休眠狀態[10]。
1.3.2 缺鉀模型構建 ?參考文獻[9],取結核分枝桿菌菌落,轉種于蘇通培養基(含10% ADC和0.05% Tween 80)內,37℃震蕩培養10~15 d。將菌液離心(10 000 r/min),棄上清液,保留沉淀,按上述步驟,用ddH2O重復洗滌2次、保留沉淀,再用缺鉀蘇通培養基(含10% ADC和0.05% Tween 80)重懸所得細菌沉淀,37℃震蕩培養35 d。蘇通培養基成分(1 L,調節pH 7.0):KH2PO4 0.5 g,MgSO4·7H2O 1.4 g,L-asparagine 4 g,甘油60 mL,枸櫞酸鐵銨0.05 g,檸檬酸鈉2 g,1% ZnSO4·7H2O液0.1 mL。缺鉀蘇通培養基成分(1 L,調節pH 7.0):Na2HPO4·12H2O 8.9 g,MgSO4·7H2O 1.4 g,L-asparagine 4 g,甘油60 mL,枸櫞酸鐵銨0.05 g,檸檬酸鈉2 g,1% ZnSO4·7H2O液0.1 mL。
1.4 休眠菌模型耐藥性檢測及噬菌體對休眠菌殺菌作用
1.4.1 缺氧模型 ?參考文獻[9],取缺氧模型誘導的休眠期結核菌菌液,研磨均勻,隨機分成5個組,每組設3個復管,每支試管裝2 mL菌液。再向各組試管中分別加入100 μL的異煙肼(終濃度5 μg/mL)、利福平(終濃度5 μg/mL)、噬菌體Leo(滴度2.6×108 PFU/mL)、噬菌體Guo1(滴度3.26×108 PFU/mL),對照組加入等量ddH2O。將所有試管置于恒溫振蕩器(37℃ 160 r/min)中振蕩培養7 d。隨后,取各試管中菌懸液,研磨均勻,用全營養的蘇通培養基10倍梯度稀釋,加入48孔板中行最大可能數(MPN)法計數(每個稀釋度有3個復孔)測細菌濃度,將48孔板置于37℃恒溫箱內靜止培養15 d。再按3∶20的比例,向48孔板的各孔內加入0.02%刃天青溶液進行顯色,7 d后觀察顯色結果。刃天青顯色原理:藍色提示無活菌生長,變為紅色提示有活菌生長。根據觀察結果,利用MPN法計數原理計算MPN值,從而推算出細菌濃度,MPN值的計算采用標準的統計方法[11]。
1.4.2 缺鉀模型 ?方法同前述缺氧模型實驗。
1.5 統計學方法
采用SPSS 19.0統計學軟件對數據進行統計分析。缺氧模型實驗結果,取細菌濃度對數值,采用兩獨立樣本t檢驗。缺鉀模型實驗結果,取細菌濃度值,采用秩和檢驗,以P < 0.05表示差異有統計學意義。耐藥率計算方法[3,16]:耐藥率=藥物組菌濃度平均值/對照組菌濃度平均值×100%。
2結果
2.1 噬菌體motif3基序
在噬菌體Leo和Guo1的卷尺蛋白中分別找到其motif3基序(表1、圖1)。同時發現Leo和Guo1的motif3基序中含有6個高度保守的氨基酸殘基(甘氨酸、天門冬氨酸、脯氨酸、天門冬氨酸、2個組氨酸殘基)和1個高度保守的異亮氨酸-色氨酸位點(圖1)。
2.2 缺氧模型耐藥性檢測及噬菌體對休眠期結核菌的裂解作用
與對照組比較,異煙肼組和利福平組,結核分枝桿菌量減少了1~2個數量級,差異有統計學意義(P < 0.05),提示僅部分結核分枝桿菌出現表型耐藥。但異煙肼組和利福平組仍有105個結核分枝桿菌存活,該部分結核分枝桿菌已出現表型耐藥,進入休眠狀態。噬菌體Leo組菌量大于異煙肼組和利福平組,則噬菌體Leo對缺氧模型誘導的休眠期結核菌無裂解作用。Guo1組相較于異煙肼和利福平組,細菌量減少了3個數量級以上,差異有統計學意義(P < 0.05),提示噬菌體Guo1對缺氧模型誘導的休眠期結核菌有明顯裂解作用。見圖2。
2.3 缺鉀模型耐藥性檢測及噬菌體對休眠期結核菌的裂解作用
利福平組、異煙肼組與對照組菌量比較,差異無統計學意義(P > 0.05),顯示所有結核菌出現表型耐藥,進入休眠狀態。Guo1組與異煙肼組及利福平組菌量比較,差異無統計學意義(P > 0.05),則噬菌體Guo1對缺鉀模型誘導的休眠期結核菌無裂解作用。而Leo組菌量為零,與利福平組比較,差異有統計學意義(P < 0.05),則噬菌體Leo能完全殺滅缺鉀模型誘導的休眠期結核菌。見圖3。
2.4 結核休眠菌耐藥率結果
缺鉀模型誘導的休眠期結核菌,其對異煙肼及利福平的耐藥率明顯高于缺氧模型。見表2。
3 討論
世界上有23%的人口都有潛伏結核感染[12-13],此時結核分枝桿菌在患者體內處于休眠狀態,對經典抗結核化療藥物耐藥,使結核病遷延不愈。因此亟需找到能殺滅休眠期結核菌的新藥物。
噬菌體對耐藥結核病的治療,已成功應用于豚鼠模型[14]。但結核分枝桿菌進入休眠狀態后,會出現細胞壁增厚、交聯增加(透光度降低)的現象[15-16]。細胞壁增厚會增加噬菌體感染結核分枝桿菌的難度,而motif3基序則賦予噬菌體感染休眠期結核菌的能力[1]。不含motif3基序的噬菌體D29、Che12對休眠期結核菌的感染能力明顯弱于含motif3基序的噬菌體TM4[2]。迄今發現含motif3基序的噬菌體,其卷尺蛋白氨基酸含量在1100~1900 aa之間[2],而卷尺蛋白氨基酸含量與噬菌體尾部長度成正比關系[17],推測含motif3基序的噬菌體為長尾噬菌體。噬菌體Guo1(未發表)和噬菌體Leo[18]均為長尾噬菌體。Dusthackeer等[2]發現在motif3基序中含有6個高度保守的氨基酸殘基(甘氨酸、天門冬氨酸、脯氨酸、天門冬氨酸、兩個組氨酸殘基)和1個高度保守的異亮氨酸-色氨酸位點。噬菌體TM4 motif3基序中異亮氨酸-色氨酸位點的突變,可導致其對休眠期恥垢分枝桿菌的感染能力下降50%[1]。經軟件分析,噬菌體Leo、Guo1的卷尺蛋白中含motif3基序,且motif3基序中的6個高度保守氨基酸殘基和高度保守位點均未缺失,推測其對休眠期結核菌具有裂解作用。噬菌體Guo1為本實驗室自主分離,對其研究有利于后續專利的申請。
休眠期結核菌具有對異煙肼、利福平耐藥的特點,這種耐藥變異是由于細菌停止生長引起的,并未出現基因水平的改變,稱為表型耐藥[19-20]。結核分枝桿菌根據生長狀態不同分為:活躍期、靜止期(休眠早期)、完全休眠期。異煙肼主要對活躍期結核菌有殺菌作用,而利福平對靜止期結核菌亦有殺菌作用。如果對利福平耐藥,提示結核菌進入更深的休眠狀態[6]。實驗發現,缺鉀模型誘導的休眠期結核菌,耐藥率明顯高于缺氧模型,特別是對5 μg/mL利福平的耐藥率達100%,是缺氧模型的100倍,建模時間僅為缺氧模型的1/10。據報道,多因素模型建模18 d誘導出的休眠期結核菌,對5 μg/mL利福平的耐藥率僅11%[6];即使建模30 d,對1 μg/mL利福平耐藥率僅9.72%[16]。相較上述兩種模型,缺鉀模型能在短時間內誘導結核分枝桿菌進入更深的休眠狀態,具有明顯的優勢。
本研究顯示,噬菌體Guo1對缺氧模型休眠期結核菌有明顯裂解作用,而對缺鉀模型休眠期結核菌無裂解作用;噬菌體Leo對缺鉀模型休眠期結核菌有裂解作用,而對缺氧模型休眠期結核菌無裂解作用。推測這種現象可能與兩種模型所誘導的休眠期結核菌所處生長狀態不同有關。缺氧模型誘導的休眠期結核菌中靜止期菌占絕大部分,而缺鉀模型可誘導出對超高濃度利福平(50 μg/mL)耐藥的休眠期結核菌[9],則其中完全休眠期菌占絕大部分。分析本研究結果,則Leo對完全休眠期結核菌有殺滅作用,而對靜止期結核菌殺滅作用弱;Guo1對靜止期結核菌有殺滅作用,對完全休眠期結核菌殺滅作用弱。解決這一問題的最好方法就是將這兩種噬菌體混合制成“雞尾酒制劑”,優勢互補,同時還能解決單一噬菌體長期應用易誘發耐藥變異的問題[21]。
[參考文獻]
[1] ?Piuri M,Hatfull GF. A peptidoglycan hydrolase motif within themycobacteriophage TM4 tape measure proteinpromotes efficient infection of stationaryphase cells [J]. Mol Microbiol,2006,62(6):1569-1585.
[2] ?Dusthackeer A,Hassan VN,Kumar V. Tape measure protein having MT3 motif facilitates phage entry into stationary phase cells of Mycobacterium tuberculosis [J]. Comput Biol Chem,2008,32(5):367-369.
[3] ?Wayne LG,Hayes LG. An in vitro model for sequential study of shiftdown of Mycobacterium tuberculosis through two stages of nonreplicating persistence [J]. Infect Immun,1996,64(6):2062-2069.
[4] ?Betts JC,Lukey PT,Robb LC,et al. Evaluation of a nutrient starvation model of Mycobacterium tuberculosis persistence by gene and protein expression profiling [J]. Mol Microbiol,2002,43(3):717-731.
[5] ?Shleeva MO,Kudykina YK,Vostroknutova GN,et al. Dormant ovoid cells of Mycobacterium tuberculosis are formed in response to gradual external acidication [J]. Tuberculosis,2011,91:146-154.
[6] ?Deb C,Lee CM,Dubey VS,et al. A novel in vitro multiple-stress dormancy model for mycobacterium tuberculosis generates a lipid-loaded,drug-tolerant,dormant pathogen [J]. PLoS One,2009,4(6):e6077.
[7] ?Taneja NK,Dhingra S,Mittal A,et al. Mycobacterium tuberculosis transcriptional adaptation,growth arrest and dormancy phenotype development is triggered by vitamin C [J]. PLoS One,2010,5(5):e10860.
[8] ?Kapoor N,Pawar S,Sirakova TD,et al. Human granuloma in vitro model for TB dormancy and resuscitation [J]. PLoS One,2013,8(1):e53657.
[9] ?Salina E,Ryabova O,Kaprelyants A,et al. New 2-thiopyridines as potential candidates for killing both actively growing and dormant Mycobacterium tuberculosis cells [J]. Antimicrob Agents Chemother,2014,58(1):55-60.
[10] ?Sun Z,Zhang Y. Spent culture supernatant of Mycobacterium tuberculosis H37Ra improves viability of aged cultures of this strain and allows small inocula to initiate growth [J]. J Bacteriol,1999,181(24):7626-7628.
[11] ?de Man JC. The probability of most probable numbers [J]. J Appl Microbiol,1975,1:67-78.
[12] ?World Health Organization.Global tuberculosis report 2018 [C]. Geneva:World Health Organization,2018.
[13] ?董曉偉,劉玉琴,盧水華.結核分枝桿菌潛伏感染的治療:利大于弊還是弊大于利[J].中國實用內科雜志,2019, 39(5),443-446.
[14] ?彭麗,陳保文,羅永艾,等.噬菌體D29對耐藥結核病豚鼠的治療作用[J].第四軍醫大學學報,2009,30(17):1576-1579.
[15] ?Cunningham AF,Spredbury CL. Mycobacterial stationary phase induced by low oxygen tension:cell wall thickening and localization of the 16-kilodalton alpha-crystallin homolog [J]. J Bacteriol,1998,180(4):801-808.
[16] ?江莉莎,姚義勇,張莉,等.缺氧模型和多因素模型構建結核休眠菌模型比較研究[J].中國人獸共患病學報,2016, 32(4):327-331.
[17] ?Pham TT,Jacobs-Sera D,Pedulla ML,et al. Comparative genomic analysis of mycobacteriophage Tweety:evolutionary insights and construction of compatible site-specific integration vectors for mycobacteria [J]. Microbiology,2007,153(Pt 8):2711-2723.
[18] ?江莉莎,鄔亭亭,劉平,等.分支桿菌噬菌體Leo生物學特性及抗結核作用[J].中國人獸共患病學報,2015,31(3):193-198.
[19] ?李瑜,曾威,徐群芳,等.益陽地區結核分枝桿菌耐藥狀況分析[J].中國醫藥導報,2017,14(26):173-176.
[20] ?Zhang Y. Persistent and dormant tubercle bacilli and latent tuberculosis [J]. Front Biosci,2004,9:1136-1156.
[21] ?Goodridge LD. Designing phage therapeutics [J]. Curr Pharm Biotechnol,2010,11(1):15-27.
(收稿日期:2019-09-12 ?本文編輯:封 ? 華)

