羅非魚養殖環境中益生菌的篩選
趙光軍 朱海 佟延南

摘要? ? 該研究從不同的羅非魚養殖區域、養殖模式、養殖環境中分別采集樣品,經前期處理后得到262株待測菌株。以無乳鏈球菌為指示菌株,利用瓊脂擴散法篩選拮抗菌。通過安全性試驗對初篩菌株進行復篩,同時進行16S rDNA分子鑒定。結果顯示,初篩得到29株拮抗菌,其中6株對無乳鏈球菌安全,分屬于芽胞桿菌屬、假單胞菌屬、腸桿菌屬3個屬。
關鍵詞? ? 羅非魚;養殖環境;益生菌;篩選
中圖分類號? ? S917.1? ? ? ? 文獻標識碼? ? A
文章編號? ?1007-5739(2019)14-0210-02? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?開放科學(資源服務)標識碼(OSID)
Abstract? ? The study collected samples from different tilapia culture areas,culture models and culture environments,and obtained 262 strains after pretreatment.Streptococcus agalactiae was used as an indicator strain to screen antagonistic strain by agar diffusion method.The primarily screened strain was rescreened through a safety test,and the 16S rDNA sequence molecule was simultaneously identified.The results showed that,among 29 primarily screened strains of antagonistic bacteria,6 strains were safe to Streptococcus agalactiae,belonging to the genus Bacillus,Pseudomonas,and Enterobacter.
Key words? ? tilapia;culture environment;probiotics;screening
羅非魚(Tilapia)自1976年被聯合國糧農組織列為優良養殖品種進行推廣以來,現已成為世界性的養殖魚類[1]。中國的羅非魚養殖產業在世界上占有舉足輕重的地位,養殖產量在2017年達到了158.47萬t,占全部淡水養殖魚類的6.14%,是除四大家魚和鯉魚、鯽魚外唯一養殖產量超100萬t的淡水養殖魚類[2]。中國早已成為世界最大的羅非魚生產國和出口國,且南方的羅非魚是我國非常重要的養殖品種[3-4]。近幾年的鏈球菌病爆發,導致羅非魚的產量下降,加之養殖環境惡化,磺胺類、喹諾酮類抗生素等藥物的濫用,致使羅非魚的出口受限,給羅非魚產業造成了重創[5]。通過環境友好的方式進行鏈球菌病防控可改善現有狀況,為羅非魚產業的發展起到一定的推動作用。國際益生菌和益生元科學協會將益生菌定義為當達到足夠劑量時能夠給宿主帶來有益影響的活體微生物[6],通過此定義可知,具有改良水質效果、改善水產動物胃腸道、拮抗病原菌等的菌株均可歸屬為益生菌。利用益生菌進行生物防治,可減少抗生素的使用,避免出現耐藥性,達到生態養殖的效果。
1? ? 材料與方法
1.1? ? 試驗材料
該研究以無乳鏈球菌(Streptococcus agalactiae)為拮抗菌篩選的指示菌株,該菌株于2016年從海南瓊海某養殖場A的患病羅非魚中分離獲取,且經過分子鑒定,編號QHTY-3。試驗所用羅非魚由海南瓊海某養殖場B提供,選用羅非魚體重200 g左右、規格整齊、體格健壯、體表無損傷。牛肉膏蛋白胨培養基:胰蛋白胨10 g,牛肉浸粉3 g,NaCl 5 g,去離子水1 000 mL,pH值為7.2~7.4;固體培養基為1 000 mL加20 g瓊脂;半固體培養基為1 000 mL加10 g瓊脂。腦心浸出液培養基(BHI)購自廣東環凱微生物科技有限公司。其他試驗用試劑耗材均由海南諾琪蘭科技有限公司購置。
1.2? ? 樣品的采集與前期處理
1.2.1? ? 樣品采集。于2017年5月至2018年5月在海南的羅非魚主養區海口、文昌、瓊海等地采集不同水體環境中的水樣與泥樣,于4 ℃條件下帶回實驗室處理。
1.2.2? ? 水樣處理方法。用無菌去離子水對水樣進行10倍梯度稀釋,取0.1 mL合適濃度的稀釋液涂布于牛肉膏蛋白胨瓊脂平板,37 ℃倒置培養1~5 d,連續觀察菌落生長情況。挑取菌落形態不同的菌株進行純化后保種,用作待測菌株。
1.2.3? ? 泥樣處理方法。取5 g泥樣加5 mL無菌生理鹽水,于4 ℃條件下振蕩30 min(條件不允許時在渦旋混合器上以最大速度混合10 min),4 ℃靜置30 min,取上層液體4 ℃,1 000 r/m離心30 min,取上清液,以生理鹽水進行10倍梯度稀釋,取0.1 mL合適的濃度的稀釋液涂布于牛肉膏蛋白胨瓊脂平板,37 ℃倒置培養2~5 d,連續觀察菌落生長情況。挑取菌落形態不同的菌株進行純化后保種,用作待測菌株。
1.3? ? 拮抗菌的篩選
用BHI活化無乳鏈球菌,用牛肉膏蛋白胨培養基活化待測菌株。制作雙層平板,下層為固體牛肉膏蛋白胨培養基,上層為混有無乳鏈球菌的半固體BHI(50 ℃左右時在BHI中加入活化的無乳鏈球菌,混勻)。以6 mm孔徑打孔器在雙層平板上打孔,每孔加入50 μL待測菌株,以等量生理鹽水作為對照,37 ℃靜置培養20 h,測量抑菌圈大小。選取抑菌效果較好的菌株用于后續研究。
1.4? ? 安全性試驗
選取體長為20 cm左右,體重約200 g的健康羅非魚在實驗室暫養7 d后進行分組,每組10尾,飼養在約150 cm×100 cm×50 cm規格的水族箱中(或網箱中)。將待測菌株接種于普通淡水液體培養基中,37 ℃擴大培養18 h,用滅菌的生理鹽水洗菌2次,濃度調至1×108 CFU/mL,按菌液與羅非魚體重1∶1 000的質量比進行腹腔注射,對照組每尾注射等量的無菌生理鹽水,每株菌設置2個平行組進行試驗。每天正常投喂人工配合飼料,連續觀察15 d,并每天記錄實驗用魚的死亡情況。
1.5? ? 16S rDNA分子鑒定
利用通用引物擴增出前期研究篩選菌株的16S rDNA序列并委托技術公司進行測序,將測定的序列在GenBank數據庫中進行比對分析,初步得到待檢菌株的分子鑒定信息。
2? ? 結果與分析
2.1? ? 樣品的采集和前期處理
采集到的樣品經前期處理后,初步獲取不同生長形態的單菌落262株,詳細結果見圖1和表1。
2.2? ? 拮抗菌的篩選
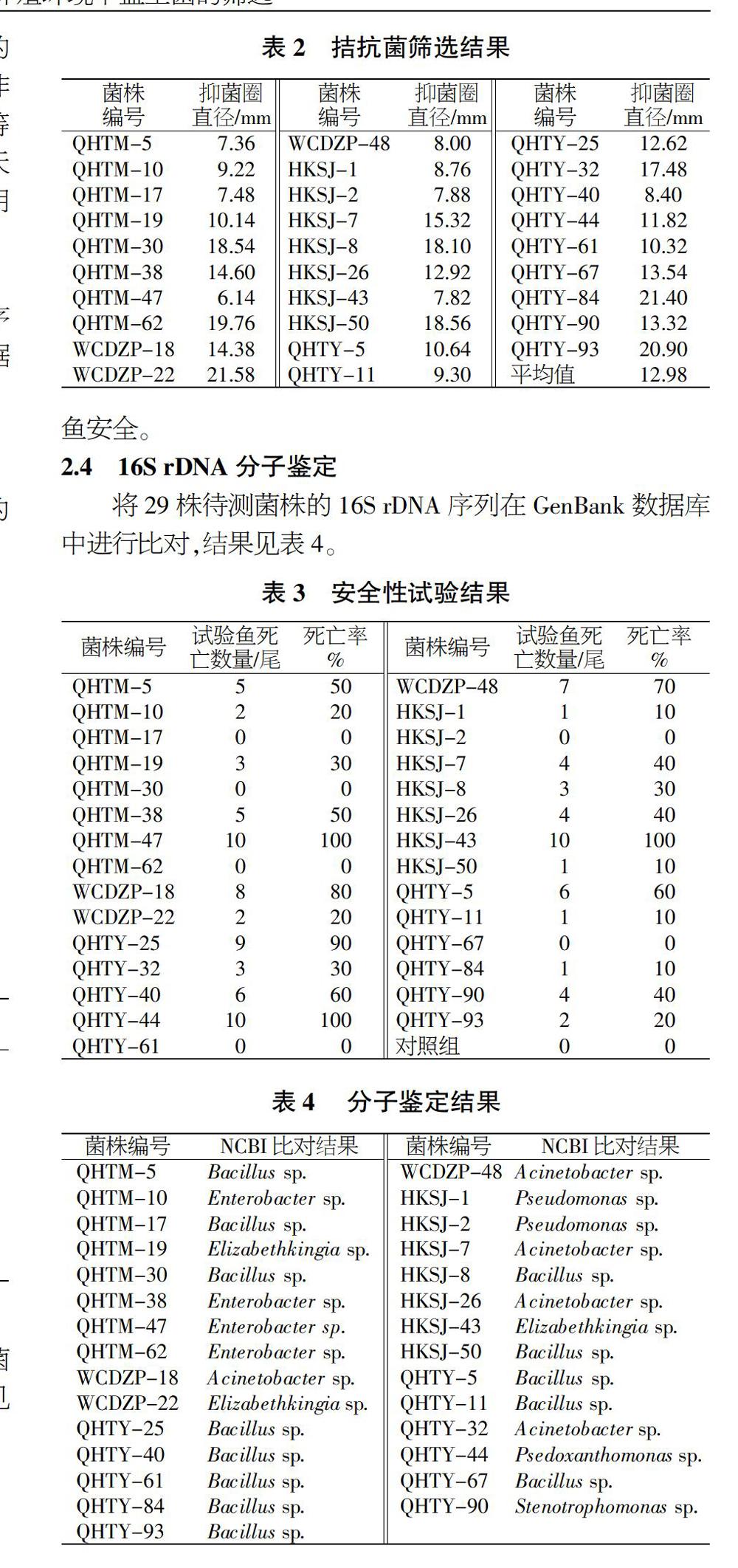
經雙層培養基的培養初篩后,得到29株對無乳鏈球菌具有較強拮抗作用的菌株,抑菌圈直徑為12.98 mm,結果見圖2和表2。
2.3? ? 安全性試驗
試驗羅非魚注射待測菌株后,經15 d的連續飼養,死亡情況見表3。其中,有6株待測菌株的致死率為0,即對羅非魚安全。
2.4? ? 16S rDNA分子鑒定
將29株待測菌株的16S rDNA序列在GenBank數據庫中進行比對,結果見表4。
3? ? 結論與討論
本次試驗共采集了4個養殖場、3種養殖模式的樣品,通過分析池塘的養殖模式可知,泥樣中微生物種類較水樣中更為豐富;養殖環境生態多樣性越復雜,微生物種類越豐富。林國榮等[7]利用Illumina高通量測序技術對不同養殖模式下養殖池塘水體和底泥中的菌群結構進行檢測,結果表明,不同養殖模式下池塘的水體和底泥之間、同一養殖池塘的水體和底泥之間,微生物的區系組成存在著一定差異;微生物的多樣性和豐富度也表現出了很大的差異,底泥的微生物多樣性明顯高于水體,與本研究的結果相符。微生物在水產養殖環境生物多樣性中占有重要的位置,并發揮著極其重要的作用,對養殖水體調控、養殖對象菌群結構穩定、養殖環境物質循環和能量流動等都有較大影響[8]。養殖環境中微生物的多樣性受到養殖模式、養殖品種影響的同時,也存在著一定的季節性差異[9-10],對于羅非魚養殖環境及腸道的微生物多樣性,已有學者做過相關研究,結果顯示,不同養殖區域、不同養殖階段、不同養殖模式、不同養殖環境下羅非魚的腸道菌群均存在顯著差異[11],微生物多樣性受養殖環境的影響,同時,微生物也可通過調節水質、增強免疫力、提供餌料利用率等方面改善養殖環境、養殖生物的現狀。因此,可通過加強對養殖環境微生物的研究對水產養殖環境調控進行科學指導。
待測菌株經20 h的體外拮抗試驗后,有29株對對無乳鏈球菌具有較強拮抗作用,抑菌圈直徑為(12.98±8.60)mm,各菌株的抑菌效果差異較大,其中WCDZP-22、QHTY-84、QHTY-93等菌株的拮抗效果最好,抑菌圈超過20 mm。國內對于水產養殖對象病原菌的拮抗菌篩選,已有超過15年的時間,并取得了一定成效,主要針對的病原菌有副溶血弧菌(Vibrio parahaemolyticus)、鰻弧菌(Vibrio anguillarum)、飄浮弧菌(Vibrio natriegen)和沙蠶弧菌(Vibrio nereis)等病原性弧菌[12-13]及嗜水氣單胞菌[14]、水霉(Saprolegnia)[15]、維氏氣單胞菌(Aeromonas veronii)[16]等。近年也有學者對羅非魚源無乳鏈球菌的拮抗菌進行了研究,結果表明,該類拮抗菌廣泛存在與羅非魚的養殖環境及其腸道內,較易分離得到,但生產應用尚需進一步研究[17-18]。
初篩菌株的安全性試驗與16S rDNA分子鑒定結果顯示,有QHTM-62、HKSJ-2、QHTY-61等6株菌對羅非魚無致病性,該6株菌分屬于芽胞桿菌屬、假單胞菌屬、腸桿菌屬等3個屬,其中有4株均為芽胞桿菌,說明無乳鏈球菌對芽胞桿菌屬的細菌表現較為敏感,這與何濤等人的研究結果一致[19-21]。在后續拮抗菌篩選可縮小研究范圍,專門針對芽孢桿菌進行篩選,這將大幅度減少工作量。
針對拮抗菌的作用機理與生產應用的研究相對匱乏,后續的研究工作方向重點偏向機理與應用,這將為今后有益微生物制劑的研發、應用及水產養殖病害防治提供科學依據。
4? ? 參考文獻
[1] 趙光軍.拮抗菌的篩選及其對無乳鏈球菌粘附羅非魚粘液的拮抗作用研究[D].海口:海南大學,2014.
[2] 農業農村部漁業漁政管理局,全國水產技術推廣總站,中國水產學會.中國漁業統計年鑒[M].北京:中國農業出版社,2018.
[3] 袁媛,袁永明,代云云,等.羅非魚供給側結構改革的思考[J].中國農學通報,2018,34(8):118-122.
[4] 張紅燕,袁永明,賀艷輝,等.中國羅非魚產品出口貿易特點及展望[J].農業展望,2017,13(9):104-107.
[5] 周遠揚,王玉梅,曹俊明,等.2015年廣東羅非魚產業發展形勢與對策建議[J].廣東農業科學,2016,43(6):23-27.
[6] HILL C,GUARNER F,REID G,et al.Expert consensus document:The International Scientific Association for Probiotics and Prebiotics consen-sus statement on the scope and appropriate use of the term probiotic[J].Nature reviews Gastroenterology & hepatology,2014,11(8):506.
[7] 林國榮,王春忠,孫富林,等.海水混養池塘蝦蛤腸道與養殖環境的微生物多樣性[J].微生物學通報,2018,45(9):1989-1999.
[8] 馬富平.主養草魚池塘微生物群落結構分析及嗜水氣單胞菌拮抗菌篩選[D].重慶:西南大學,2017.
[9] 夏海峰,杜宗軍,陳冠軍.刺參腸道及養殖池塘底泥微生物多樣性的比較研究[J].海洋湖沼通報,2015(4):105-110.
[10] 張皓.養殖環境微生物群落的動態變化及與水環境的互作[D].蘇州:蘇州大學,2015.
[11] 佟延南,李芳遠,李忠琴,等.不同養殖階段羅非魚腸道微生物多樣性的動態分析[J].南方農業學報,2018,49(7):1415-1422.
[12] 張新明.對蝦養殖用微生態制劑菌株的篩選與應用效果的研究[D].青島:中國海洋大學,2004.
[13] 李繼秋.對蝦微生態制劑的研究和應用[D].青島:中國海洋大學,2004.
[14] 張皎皎,馬富平,熊波,等.一株新型嗜水氣單胞菌拮抗菌的篩選及鑒定[J].西南大學學報(自然科學版),2017,39(12):18-23.
[15] 梁永增.魚類水霉病病原生物拮抗菌的篩選及其拮抗機理分析[D].烏魯木齊:新疆大學,2016.
[16] 何濤,鄒升,龔亮,等.草魚病原菌AvX005的分離鑒定及其拮抗菌篩選研究[J].水產科學,2018,37(1):15-23.
[17] 趙光軍,周永燦,楊慧,等.羅非魚無乳鏈球菌拮抗菌的分離、鑒定及多樣性分析[J].熱帶生物學報,2014,5(4):312-319.
[18] 高艷俠,張德鋒,可小麗,等.羅非魚源無乳鏈球菌腸道拮抗芽孢桿菌的篩選及其生物學特性[J].微生物學報,2019,59(5):926-938.
[19] 韋露,陳償,龍云映,等.一株短小芽孢桿菌B1的篩選鑒定及其抗菌特性研究[J].水產科學,2015,34(3):161-168.
[20] 王金燕,李彬,王印庚,等.刺參養殖池塘一株貝萊斯芽孢桿菌的分離及其生理特性[J].中國水產科學,2018,25(3):567-575.
[21] 趙彩春,陳國明,張家學.短小芽胞桿菌HLK8-1的分離鑒定及抑菌特性分析[J].微生物學雜志,2016,36(2):33-38.

