轉化生長因子β1對宮頸癌Siha細胞microRNA表達譜的影響
甘 露,劉曉英,王雯智,魏 榮
(1陜西省人民醫院,西安交通大學第三附屬醫院婦科,西安 710068;2陜西省榆林市第二醫院婦產科)
在我國,宮頸癌是婦科第二大腫瘤,浸潤和轉移是導致患者死亡的主要因素[1]。因此探討宮頸癌浸潤轉移的機制具有十分重要的臨床意義。TGF-β1是轉化生長因子β(transforming growth factor β,TGFβ)超家族成員之一,既往研究表明TGF-β1能夠促進宮頸癌的浸潤和轉移[2,3]。越來越多的研究表明TGF-β1與miRNAs相互影響、共同致病[4,5]。但是,TGF-β1對宮頸癌Siha細胞miRNA的調控作用國內外尚未見文獻報道。本研究利用miRNA芯片技術,檢測TGF-β1作用后宮頸癌Siha細胞miRNA的差異表達,從miRNAs水平探討TGF-β1促進宮頸癌細胞浸潤轉移的分子機制,為宮頸癌的臨床靶向治療提供可靠的實驗依據。
1 材料和方法
1.1 一般材料
宮頸癌Siha細胞由空軍軍醫大學藥物基因組學教研室饋贈。細胞置于含10%胎牛血清的RPMI1640培養基中,于37 ℃、5%CO2條件下培養。
1.2 方法
1.2.1 主要儀器和試劑 Trizol試劑(美國Invitrogen公司);TGF-β1,胎牛血清,RPMI1640培養基(美國Gibco公司);反轉錄試劑盒(美國Promega);miRNA芯片(美國Affymetrix公司);熒光定量PCR試劑盒(日本TOYOBO);ABI Prism 7500熒光定量PCR儀(美國ABI公司)。
1.2.2 實驗方法 實驗分為兩組:TGF-β1干預組和對照組。待宮頸癌Siha細胞長至70%融合度時,干預組加入10 ng/ml的TGF-β1,繼續培養48 h然后進行下一步基因芯片篩選。對照組不予以TGF-β1處理,繼續常規培養48 h然后進行下一步基因芯片篩選。

1.2.4 qRT-PCR驗證芯片結果 選擇其中差異倍數大的miRNA進行qRT-PCR驗證。Trizol抽提細胞總RNA,總RNA質檢合格后,按試劑盒說明進行逆轉錄。PCR引物序列見表1。
表1 PCR引物序列
Table 1 Primer sequences of PCR
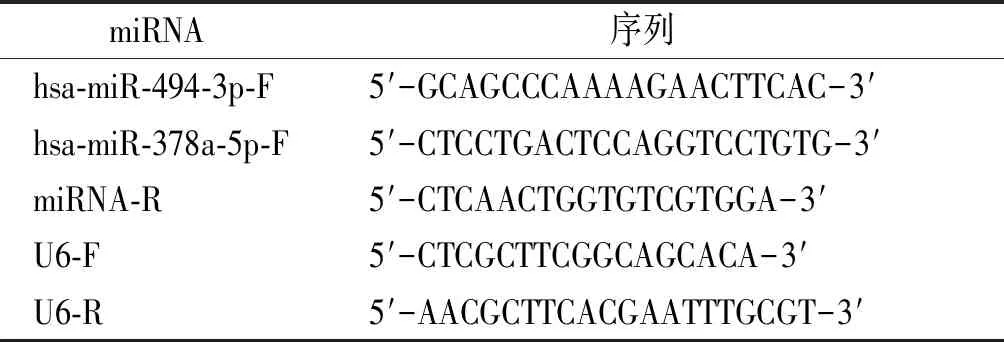
miRNA 序列 hsa-miR-494-3p-F5′-GCAGCCCAAAAGAACTTCAC-3′hsa-miR-378a-5p-F5′-CTCCTGACTCCAGGTCCTGTG-3′miRNA-R5′-CTCAACTGGTGTCGTGGA-3′U6-F5′-CTCGCTTCGGCAGCACA-3′U6-R5′-AACGCTTCACGAATTTGCGT-3′
PCR反應條件為95 ℃ 5 min,[95 ℃ 15 s,60 ℃ 15 s,72 ℃ 32 s]共40個循環。ΔCt干預組=Ct干預組-CtU6干預組,ΔCt對照組=Ct對照組-CtU6對照組,ΔΔCt=ΔCt干預組-ΔCt對照組,miRNA的相對表達水平用2-ΔΔCt形式表示,每個樣本重復3次。
1.2.5 生物信息學分析 運用Target Scan軟件預測差異表達miRNA的靶基因。
1.3 統計學分析
運用SPSS17.0統計軟件進行數據統計。兩組間比較采用配對t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 miRNA芯片結果初步篩選芯片結果
初步篩選TGF-β1處理48 h差異表達的miRNA,見圖1。篩選原則為:FDR控制在5%內,差異倍數為2倍以上。miRNAs的表達譜存在39個相同的差異表達miRNA,其中27個表達上調,12個表達下調(見表2,3)。

圖1 TGF-β1處理宮頸癌Siha細胞48 h miRNA芯片掃描圖Figure 1 The miRNA chip scan of Siha cells after treatment of TGF-β1 for 48 h
表2 TGF-β1處理宮頸癌Siha細胞48 h表達上調的miRNAs
Table 2 Up-regulated miRNAs of Siha cells after treatment with TGF-β1 for 48 h

序號名稱 倍數1hsa-let-7f-5p3.19712hsa-miR-21-5p3.26053hsa-miR-29b-1-5p2.7514hsa-miR-196a-5p2.58845hsa-miR-183-5p2.70686hsa-miR-203a2.51647hsa-let-7g-5p2.70488hsa-miR-128-3p2.43449hsa-miR-140-5p2.210610hsa-miR-125a-3p3.283911hsa-miR-365a-5p2.369712hsa-let-7d-3p2.568613hsa-miR-196b-5p2.105714hsa-miR-494-3p5.639215hsa-miR-181d-5p3.156516hsa-miR-519c-5p2.907117hsa-miR-519b-5p2.907118hsa-miR-523-5p2.907119hsa-miR-518e-5p2.907120hsa-miR-522-5p2.907121hsa-miR-519a-5p2.907122hsa-miR-1229-5p5.035823hsa-miR-12902.441824hsa-miR-12463.031425hsa-miR-42864.555726hsa-miR-3613-5p4.738327hsa-miR-23c2.2014
表3 TGF-β1處理宮頸癌Siha細胞48 h表達下調的miRNAs
Table 3 Down-regulated miRNAs of Siha cells after treatment with TGF-β1 for 48 h
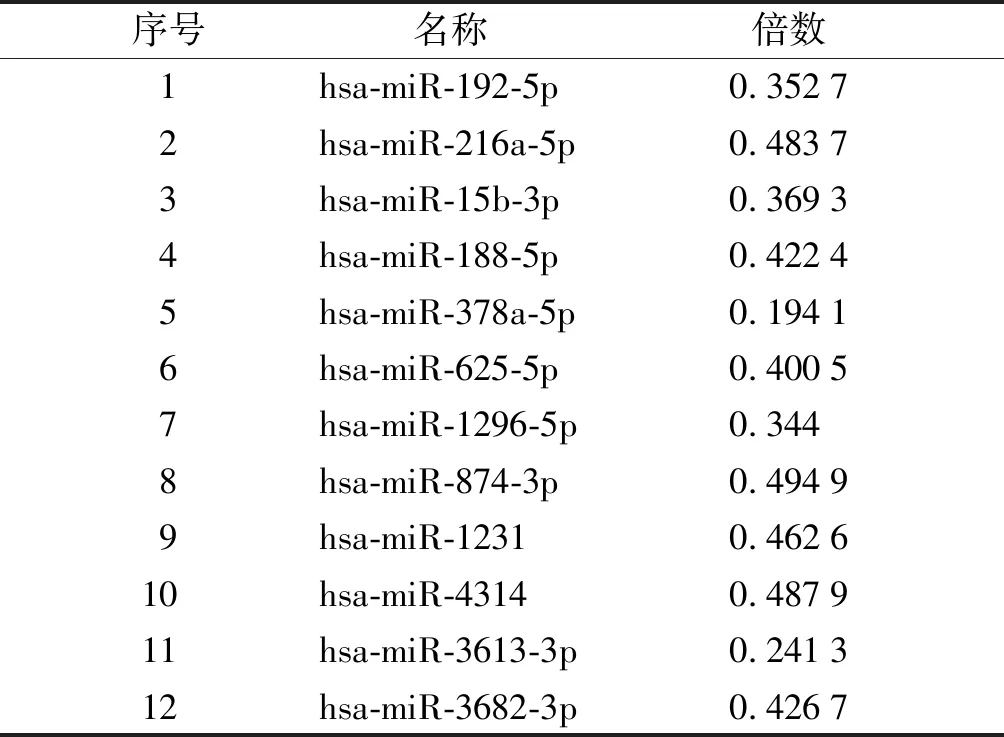
序號名稱 倍數1hsa-miR-192-5p0.35272hsa-miR-216a-5p0.48373hsa-miR-15b-3p0.36934hsa-miR-188-5p0.42245hsa-miR-378a-5p0.19416hsa-miR-625-5p0.40057hsa-miR-1296-5p0.3448hsa-miR-874-3p0.49499hsa-miR-12310.462610hsa-miR-43140.487911hsa-miR-3613-3p0.241312hsa-miR-3682-3p0.4267
2.2 qRT-PCR驗證TGF-β1處理宮頸癌Siha細胞miR-494-3p及miR-378a-5p的表達
TGF-β1作用48 h后宮頸癌Siha細胞miR-494-3p的表達顯著增加(t=15.88,P=0.003 9);TGF-β1作用48 h后宮頸癌Siha細胞miR-378a-5p的表達顯著降低(t=19.50,P=0.002 6,見圖2)。
2.3 miR-494-3p及miR-378a-5p靶基因預測
通過Target Scan軟件預測miR-494-3p及miR-378a-5p可以調控眾多的靶基因,其中還含有共同的靶基因,如結腸腺瘤性息肉病基因(adenomatous polyposis coli, APC)、缺氧誘導因子-1A(hypoxia inducible factor-1A, HIF1A)等,見表4。
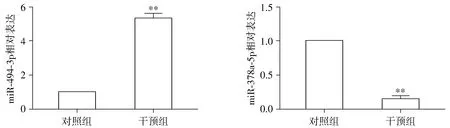
與對照組比較,**P<0.01圖2 TGF-β1處理宮頸癌Siha細胞miR-494-3p/miR-378a-5p的差異表達Figure 2 Differential expression of miR-494-3p/miR-378a-5p in Siha cell treated by TGF-β1
表4 miR-494-3p及miR-378a-5p靶基因預測
Table 4 Target gene prediction of miR-494-3p and miR-378a-5p

名稱靶基因 miR-494-3pPTEN,TNFRSF9,CADM1,IRS1,CDK4,IGF1R,IGF1,IRAK3,SAMD1,HIF1A,APC,FUT8,SIRT1,等miR-378a-5pFSHR,E2F3,EZH2,APC,MMP15,TLR5,HIF1A,IL6R,IRF1,BCL2,ESR1,GHR,SMAD3,EGFR,TEF等
下劃線表示共同調控的基因
3 討論
浸潤和轉移是導致宮頸癌患者死亡的主要因素,因此研究宮頸癌的轉移機制、探索防治宮頸癌轉移的方法,具有重大的臨床意義。既往研究發現TGF-β1處理后宮頸癌Siha細胞具有強的浸潤和轉移能力[6,7]。
miRNA是一類非編碼小RNA,大量研究發現其有望用作腫瘤和其他疾病的分子靶向治療的新分子靶標。本文采用miRNA芯片技術檢測TGF-β1處理前后宮頸癌Siha細胞miRNA表達譜的變化,共發現39個差異表達的miRNA,其中27個表達上調,12個表達下調。選擇其中差異倍數大的2個miRNA(hsa-miR-494-3p,hsa-miR-378a-5p)進行實時熒光定量RT-PCR驗證,結果與芯片結果一致。這些結果表明差異miRNA的改變由TGF-β1刺激所導致,而且可能經由TGF-β信號通路實現。
通過生物信息學預測miR-494-3p及miR-378a-5p可以調控眾多的靶基因,其中還含有共同的靶基因,如結腸腺瘤性息肉病基因(adenomatous polyposis coli, APC)、缺氧誘導因子-1A(hypoxia inducible factor-1A, HIF1A)等。
miR-494在不同類型的腫瘤中的作用不同。miR-494在結直腸癌組織中明顯上調,而這一增加與APC表達呈負相關。APC被證實是結直腸癌中miR-494的直接靶點。此外,過表達miR-494促進結直腸癌細胞生長[8]。在A549肺癌細胞中,miR-494-3p的過表達促進了腫瘤的形成,增強了腫瘤細胞的活力,增加了干細胞相關基因的表達[9]。miR-494可通過直接靶向TET1抑制基因組DNA的去甲基化,從而觸發多種侵襲抑制基因沉默,最終導致腫瘤血管的侵襲[10]。但在軟骨肉瘤中,miR-494的作用則相反,它通過直接靶向SOX9抑制體內和體外軟骨肉瘤細胞的增殖和侵襲[11]。
在乳腺癌組織中miR-378a-3p的表達水平較低,并與患者預后不良有關。miR-378a-3p通過靶向高爾基體轉運蛋白1A調節乳腺癌MCF-7細胞的三苯氧胺敏感性[12]。miR-378的降低促進非小細胞肺癌的進展和血管生成[13]。miR-378a-3p可能作為腫瘤抑制因子在橫紋肌肉瘤中發揮作用,其表達的恢復在橫紋肌肉瘤中具有治療作用[14]。最新的研究發現,miR-378a-3p可能作為腫瘤抑制因子,與腎癌患者的預后相關,高表達miR-378a-3p的患者生存期會增加[15]。但在宮頸癌中miR-494-3p及miR-378a-5p未見相關報道。
我們推測這些差異表達的miRNAs參與宮頸癌細胞的侵襲和轉移過程,具體機制尚需進一步研究。

