腦出血大鼠腦組織中組織蛋白酶L的表達及其病理意義
陳漢澤,田力,滕偉禹
(中國醫科大學1.附屬第一醫院神經內科,沈陽 110001;2.附屬盛京醫院老年病科,沈陽 110004)
腦出血(intracerebral hemorrhage,ICH)是臨床常見的急重癥之一,占全部卒中的10%~15%[1]。其高致死率和致殘率給患者帶來了極大災難。最新調查研究[2]顯示近年來ICH患者死亡率有所下降,但是致殘率卻有升高趨勢。組織蛋白酶L(cathepsin L,Cat L)是一種廣泛存在的嗜酸性溶酶體蛋白水解酶。主要分布于溶酶體中,在細胞核、細胞質和細胞外基質中也有分布[3]。Cat L 主要參與蛋白質降解,在維持細胞內蛋白平衡方面起重要作用,與多種病理生理過程(自噬、凋亡、神經遞質加工等[4-5])有關。最近,研究發現Cat L 參與多種神經系統疾病(癡呆[6]、帕金森病[7]、腦梗死[8]等)。本研究擬建立實驗性ICH大鼠模型,檢測大鼠腦組織中Cat L表達,探討Cat L在ICH中的作用及病理意義。
1 材料與方法
1.1 實驗動物及分組
雄性SPF級Wistar大鼠135只,體質量250~280 g,由中國醫科大學實驗動物部提供。大鼠隨機分為3組:Z-FY-CHO組[45只,ICH大鼠模型建立后側腦室注射Cat L選擇性抑制劑Z-FY-CHO溶液(美國Sigma公司,2 μL,1 μg/μL)],ICH組(45只,ICH大鼠模型建立后側腦室注射2 μL 10%DMSO溶液),假手術組(45只,基底節注射100 μL生理鹽水)。在造模后1、3、7、14 d,各組中隨機選取5只大鼠進行神經功能評估以及腦含水量檢測;5只大鼠進行血腦屏障通透性檢測。
1.2 ICH大鼠模型制備及給藥
采用自體血模型構建ICH大鼠模型。大鼠用麻醉機麻醉后,取仰臥位固定,消毒后切開腹股溝皮膚暴露股動脈,用微量注射器抽取100 μL動脈血。止血后,迅速裝上耳桿,固定于立體定位儀上。將石蠟油涂在大鼠眼球上,剪去大鼠頭顱頂部毛發切開皮膚,3%雙氧水涂于大鼠顱骨表面,暴露出前囟位置。在大鼠前囟右側3.5 mm、前方0.5 mm處用手電鉆輕輕鉆開顱骨,將微量注射器固定于相應位置緩緩插入,深度5.0 mm,停留2 min,繼續插入0.5 mm,停留5 min,隨后將50 μL血液注入(10 μL/min),停留5 min后再將剩余50 μL血液以相同速度注入鼠腦中。停留20 min后將注射器緩緩拔出,縫合大鼠皮膚,待大鼠恢復意識后,將其送回鼠籠,給予充足食物和水并單獨飼養。假手術組在相同條件下,注射相同體積的生理鹽水。Z-FY-CHO組于造模后2 h,側腦室注射Z-FY-CHO溶液(2 μL/只,1 μg/μL,10% DMSO溶液),ICH組造模后2 h側腦室注射10%DMSO溶液2 μL/只。
1.3 實時PCR檢測
實時 PCR試劑盒購自北京寶日醫生物技術有限公司,所需引物購自上海生工生物工程技術服務有限公司。定量PCR所用引物及探針序列見表1。術后第3天將大鼠麻醉后取腦,通過 Taqman探針法,以GAPDH為內參。將構建的重組質粒DNA作為標準品,以質粒的初始模板絕對量對數為橫坐標、以Ct值為縱坐標建立標準曲線。以Cat L/GAPDH初始模板量代表每個標本Cat LmRNA表達水平的相對量。每個標本檢測3次,結果取平均值。分別提取假手術組、ICH組、Z-FY-CHO組腦組織的cDNA,與質粒標準品進行實時PCR,通過標準曲線計算Cat L與GAPDH的初始模板量比值。

表1 RT-PCR所需引物及探針序列Tab.1 Primers and probe sequences for real-time quantitative polymerase chain reaction testing
1.4 行為學測定
利用神經功能評分表[9]對大鼠進行神經功能評估。評估內容包括對稱性、步態、攀爬、旋轉行為、前肢對稱性、強制轉圈、胡須反應。每項分為0~4分5個等級,最高得分為28分。
1.5 腦含水量測定
大鼠麻醉后迅速斷頭取腦,去除嗅球和小腦后將大腦分成左右兩半球,取出血一側半球,稱量其濕質量后,置于100 ℃烘箱中24 h,稱量其干質量,腦含水量=(濕質量-干質量)/濕質量×100%。
1.6 血腦屏障通透性測定
大鼠處死前1 h靜脈注射2%依文思藍(北京鼎國昌盛生物技術有限公司,4 mL/kg),處死后立即心臟灌注肝素化生理鹽水,將出血一側大腦半球浸入甲酰胺(3 mL/100 mg),60 ℃孵育24 h,15 000g離心30 min,在610 nm處測上清吸光度,做出標準曲線,計算依文思藍含量。
1.7 統計學分析
2 結果
2.1 各組大鼠腦組織中Cat L mRNA表達水平
結果顯示,假手術組、ICH 組、Z-FY-CHO組腦組織中Cat LmRNA相對表達量分別為1.00±0.00、5.00±0.51、2.43±0.26。與假手術組比較,ICH組、ZFY-CHO組腦組織中Cat LmRNA表達明顯增高(P<0.05);與ICH組比較,Z-FY-CHO組腦組織中Cat LmRNA表達明顯降低(P<0.05)。
2.2 各組大鼠神經功能評分比較
結果顯示,與假手術組比較,ICH組大鼠在造模后1、3、7、14 d時神經功能評分均明顯升高(P<0.05)。與ICH組比較,Z-FY-CHO組在3 d時神經功能評分明顯降低(P<0.05),見表2。

表2 各組大鼠神經功能評分及腦組織含水量比較Tab.2 Neurologic impairment scores and brain water content of the different groups
2.3 各組大鼠腦組織含水量比較
結果顯示,與假手術組比較,ICH組在造模后1、3、7 d時大鼠腦含水量明顯升高(P<0.05)。與ICH組比較,Z-FY-CHO組在造模后1、3 d時大鼠腦含水量明顯降低(P<0.05),見表2。
2.4 各組大鼠血腦屏障通透性比較
結果顯示,與假手術組比較,ICH組在造模后1、3、7、14 d時大鼠腦組織依文思藍含量均明顯升高(P<0.05)。與ICH組比較,造模后1、3 d時Z-FY-CHO組大鼠腦組織依文思藍含量明顯降低(P<0.05),見表3。
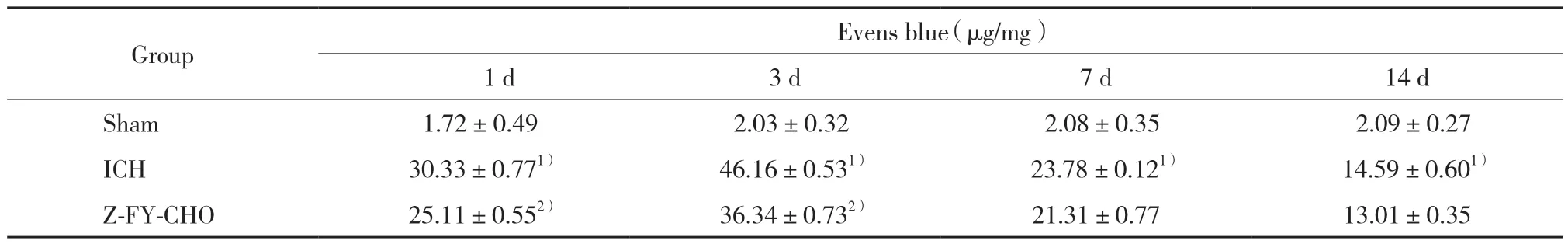
表3 各組大鼠血腦屏障通透性比較Tab.3 Eveas blue content in the brains of the different groups
3 討論
研究發現,Cat L在神經組織中有較高表達,且在腦梗死后,梗死區域周圍微血管、鄰膠質細胞和神經元中Cat L 的表達明顯升高[8],而抑制Cat L 的表達可以促進腦梗死大鼠神經功能恢復[10]。本研究結果顯示,在ICH大鼠腦組織中Cat LmRNA表達量明顯升高,Z-FY-CHO抑制Cat LmRNA表達,因此Z-FY-CHO可以有效促進神經功能恢復,減輕腦水腫,減輕血腦屏障破壞程度,提示Cat L在ICH疾病進程中發揮至關重要的作用。
ICH后進入腦組織中的血腫主要由紅細胞、凝血因子、免疫球蛋白和補體等構成。研究[11]發現,這些成分均可以通過小膠質細胞表面受體激活小膠質細胞,激活的小膠質細胞釋放大量炎性細胞因子,擴大炎癥反應,引起周圍細胞死亡,而死亡的細胞釋放的一系列危險相關模式分子又可以反過來激活更多的小膠質細胞[12],形成的惡性循環不斷加重腦組織損傷。除此之外,Cat L在小膠質細胞的激活過程中發揮重要作用[13],研究發現小膠質細胞是Cat L的重要來源,小膠質細胞接受脂多糖處理后,迅速釋放大量Cat L,釋放出的Cat L降解細胞外基質,從而導致細胞死亡,而Cat L釋放要早于一系列炎性細胞因子(iNOS、COX-2、TNF-α、IL-6、NO等),說明Cat L可能起到促進炎癥反應的作用[14]。XU等[13]研究發現不管是動物還是細胞實驗,抑制Cat L都可以有效減少小膠質細胞釋放炎性細胞因子,從而減輕炎癥反應,抑制Cat L還可以減少caspase-8激活,從而減輕凋亡反應。Cat L還可以將促凋亡蛋白Bid剪切成為tBid,繼而使線粒體釋放細胞色素C,激活caspase級聯反應,導致細胞凋亡[13]。血腦屏障是位于血液和腦組織之間的一層選擇性界面,主要由腦微血管內皮細胞、緊密連接、基底膜、周細胞和星型膠質細胞終足構成,而激活小膠質細胞釋放出的Cat L 可以破壞這些結構,從而破壞血腦屏障,加重神經損傷[15]。
本研究通過注射自體血建立ICH大鼠模型,結果顯示Z-FY-CHO可以有效抑制Cat L表達,并且隨著Cat L表達降低大鼠神經功能恢復加快,腦含水量也明顯降低。分析其原因可能是Cat L參與出血后炎癥和凋亡反應,抑制Cat L表達減輕了炎癥反應,減少了細胞凋亡,減輕血腦屏障破壞程度,從而導致大鼠神經損傷減輕。
綜上所述,實驗性ICH大鼠腦組織中Cat L表達上調,Cat L抑制劑Z-FY-CHO能夠抑制Cat L表達,降低腦含水量,減輕血腦屏障破壞,減輕神經損傷程度。Cat L參與了ICH后神經損傷過程,Cat L抑制劑可能成為ICH治療的新方向,而Cat L在ICH進程中的具體作用機制還需要進一步研究。

