羥基磷灰石在鈾富集成礦中的作用
張 慧,羅明標,徐志良,余文婷,闕為民,韓 偉
(1.東華理工大學 核資源與環境國家重點實驗室,江西南昌 330013;2.核工業北京化工冶金研究院,北京 101149;3.中國中原對外工程有限公司,北京 100044)
自然界富鈾礦石中,鈾礦物周圍存在大量磷灰石[1-4]。有關鈾與磷灰石之間的密切關系已有很多研究。溫志堅等[5-6]利用電子探針研究了相山鈾礦田磷灰石與富鈾礦形成的關系及特富礦成礦模式,提出了磷、鈾膠體共沉淀是形成富鈾礦的主要原因。但胡寶群等[7-8]對鈾礦石進行化學成分分析時發現,鈾礦石中的鈾與磷灰石中的P2O5呈正相關關系,表明鈾與磷灰石之間有更為復雜的關聯。王倩等[9]利用天然磷灰石進行鈾的吸附試驗,提出磷灰石與鈾礦物不是同時沉淀的觀點,認為磷灰石先形成,然后通過化學吸附方式吸附大量鈾,并從熱液中沉淀下來形成富鈾礦。還有一些試驗研究[10-13]也表明:羥基磷灰石有較強的鈾吸附能力,吸附前羥基磷灰石呈球狀表面有孔,吸附鈾后表面變光滑微孔被封閉,說明鈾與羥基磷灰石表面分子間發生了關聯,可能形成了礦物晶體。這很好地解釋了富鈾礦石中常見鈾礦物包裹磷灰石,或在磷灰石附近(旁側、邊部)生長,或充填于磷灰石的裂隙中[5,14]這一現象。
針對富鈾礦石中磷灰石與鈾礦物緊密共生的客觀事實,利用合成的高純度羥基磷灰石對鈾進行吸附試驗,從分子角度研究鈾與羥基磷灰石之間的相互作用的熱力學和動力學,以及通過元素分析和晶體表征揭示羥基磷灰石吸附鈾的過程,解釋磷灰石周圍富集大量鈾,甚至形成富鈾礦的內部機制。
1 試驗部分
1.1 試驗材料
羥基磷灰石(HAp)的制備:取1.0 mol/L Ca(NO3)2·4H2O的乙醇溶液50 mL于250 mL燒杯中,室溫,并在不斷攪拌條件下,用滴定管緩慢勻速滴加50 mL濃度為0.30 mol/L五氧化二磷的乙醇溶液。反應1 h后,在30 ℃恒溫水浴鍋中凝膠24 h,然后陳化24 h,得到凝膠狀的羥基磷灰石。將羥基磷灰石置于鼓風干燥箱內,于100 ℃下干燥24 h后,置于電爐中,在600 ℃下煅燒2 h,冷卻稍研磨,于105 ℃干燥2 h再研磨后備用[10,15-16]。
1.2 羥基磷灰石吸附鈾試驗方法
準確稱取10.0 mg羥基磷灰石于50 mL離心管中,加入100 mg/L一定pH的鈾標準溶液 10 mL。振蕩2 h后高速離心。取一定體積的清液,用偶氮胂Ⅲ光度法或ICP-OES法測定鈾質量濃度,計算鈾吸附量(qe)。
(1)
式中:ρ0為溶液中初始質量濃度,mg/L;ρe為吸附平衡后溶液中鈾質量濃度,mg/L;V為吸附液體積,mL;m為羥基磷灰石質量,mg;qe為平衡狀態下羥基磷灰石對鈾的吸附量,mg/g。
1.3 樣品表征
采用X射線粉末衍射(XRD)、能譜色譜儀(EDS)和掃描電鏡(SEM)對合成的羥基磷灰石和吸附鈾后的U-羥基磷灰石固體樣品進行表征。
2 試驗結果與討論
2.1 合成羥基磷灰石的表征
圖1為合成羥基磷灰石的XRD分析圖譜。與標準圖卡對比可知:合成的羥基磷灰石特征峰分別出現在10°、21°、25°、28°、32°、34°、40°、46°、47°、47.5°和53°處,與羥基磷灰石的標準圖卡相近,表明采用凝膠熱法合成的羥基磷灰石晶體較純[10,15]。
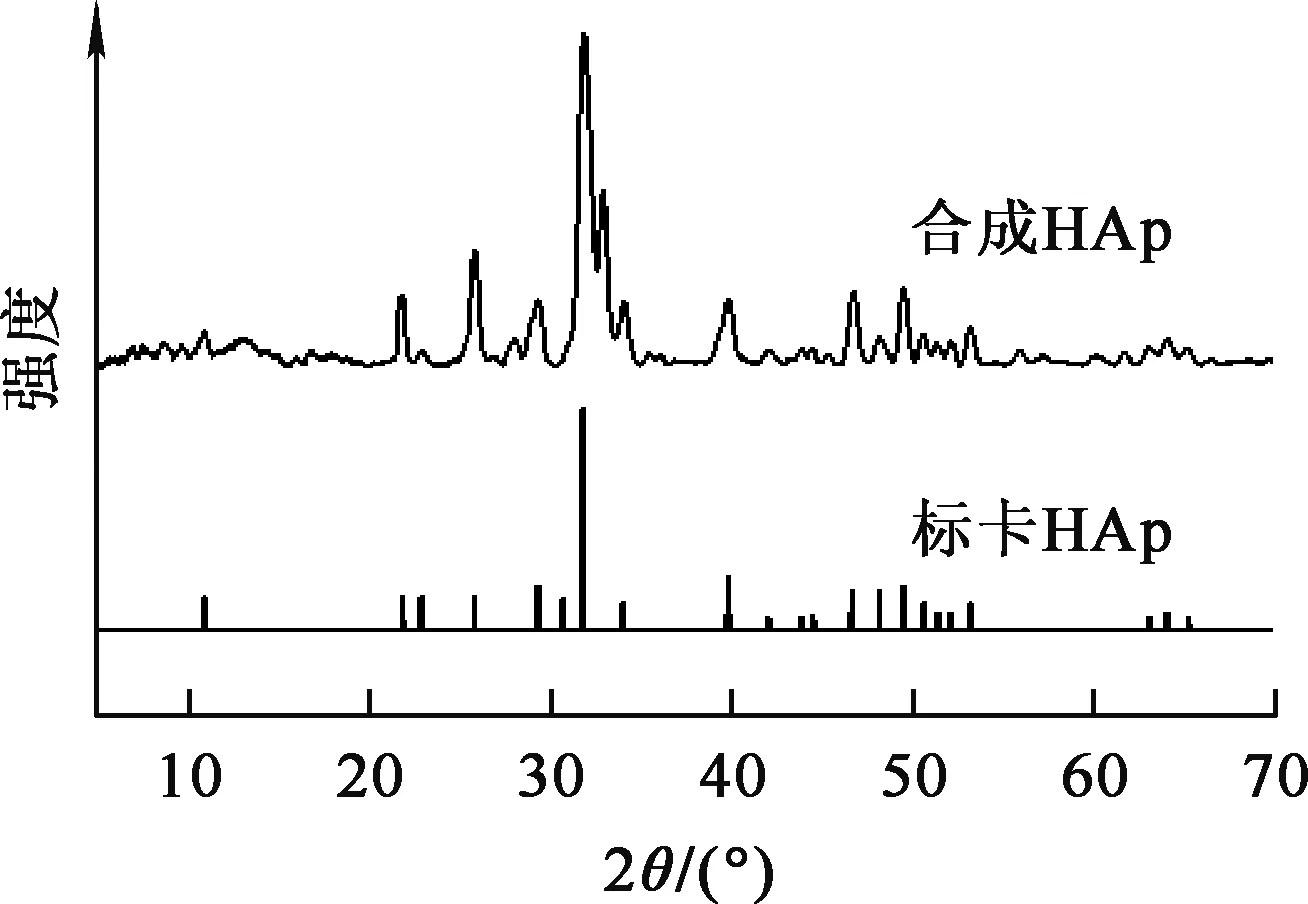
圖1 合成與天然羥基磷灰石標卡的粉末XRD圖譜
2.2 酸度對羥基磷灰石吸附鈾的影響
試驗條件:固液質量體積比為1.0 g/L,ρ0=100 mg/L,吸附時間2 h,反應溫度(20±2) ℃。溶液pH對羥基磷灰石吸附鈾的影響試驗結果如圖2所示。
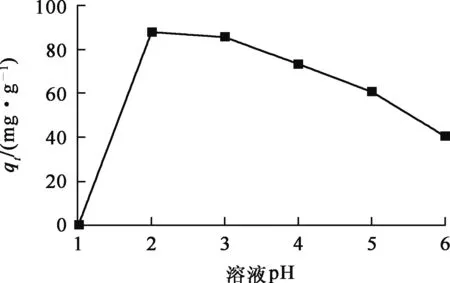
圖2 溶液pH對羥基磷灰石吸附鈾的影響
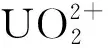
2.3 羥基磷灰石對鈾的吸附動力學
控制溶液pH=2.0,固液質量體積比1.0 g/L,ρ0=100 mg/L,溫度(20±2) ℃,接觸時間對羥基磷灰石吸附鈾的影響試驗結果如圖3所示。可以看出,羥基磷灰石吸附鈾的反應速度很快,10 min即可達吸附平衡。
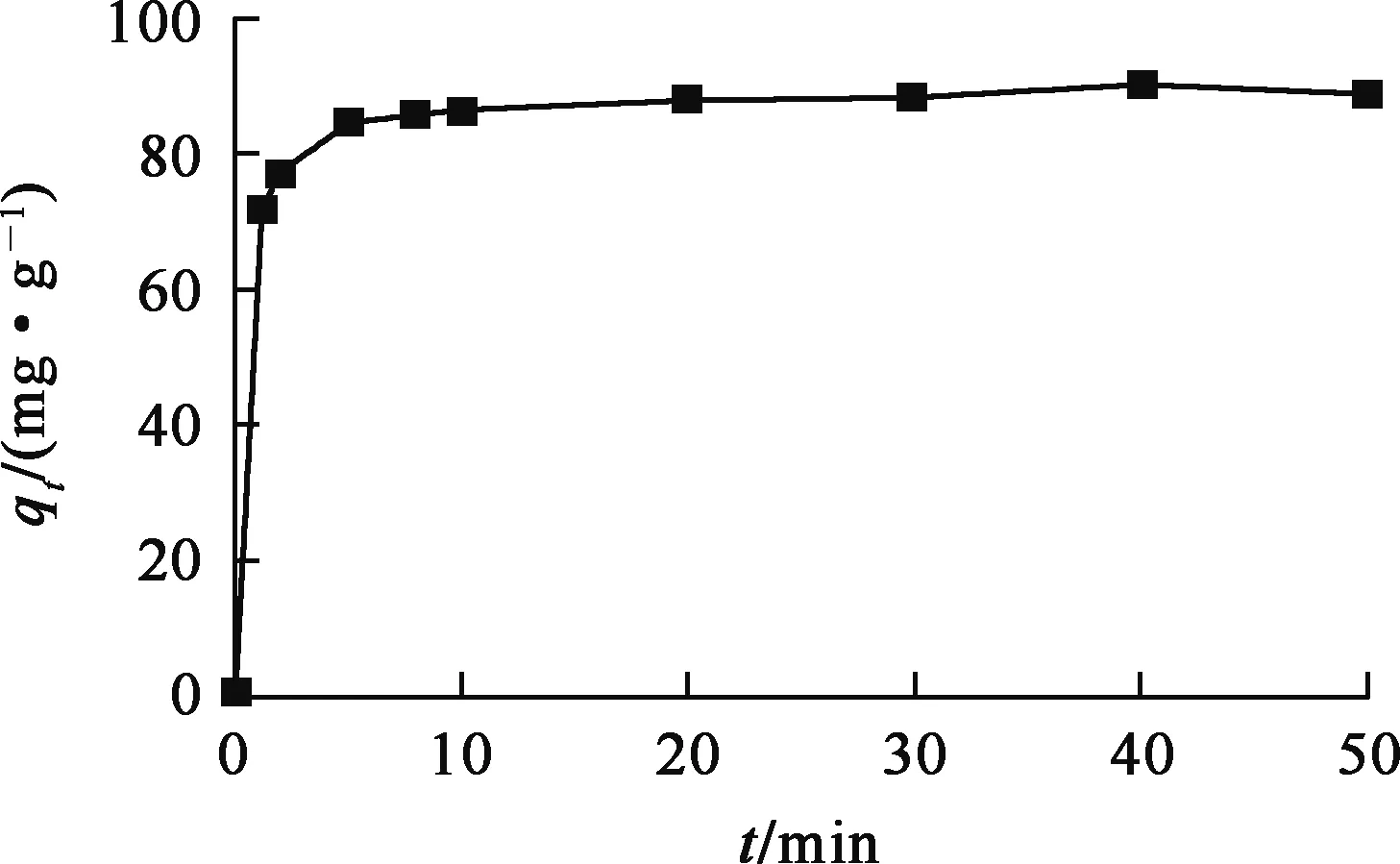
圖3 接觸時間對羥基磷灰石吸附鈾的影響
采用擬一級動力學(公式(2))和擬二級動力學(公式(3))進行模擬計算:
ln(qe-qt)=lnqe-k1t;
(2)
(3)
式中:k1為擬一級動力學速率常數,1/min,k2為擬二級動力學速率常數,g/(mg·min)。擬合曲線如圖4、5所示。

圖4 羥基磷灰石吸附鈾的擬一級動力學曲線
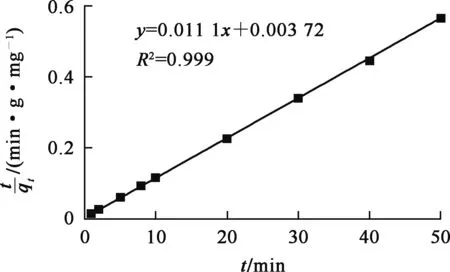
圖5 羥基磷灰石吸附鈾的擬二級動力學曲線
由圖4、5看出:吸附過程更符合擬二級動力學模型,即吸附過程主要受羥基磷灰石表面化學作用位點控制,以化學吸附為主[17];理論吸附量為90.9 mg/g,試驗所得吸附量為89.9 mg/g,二者接近;吸附反應速率常數k2為0.134 mg/(g·min)。
對鈾酰離子、羥基磷灰石和吸附后溶液進行循環伏安法(CV)測定,結果如圖6所示。可以看出:羥基磷灰石吸附鈾酰離子過程中,所有元素都沒有發生價態改變,說明羥基磷灰石與鈾形成了新物質,但沒有發生氧化還原反應[15]。
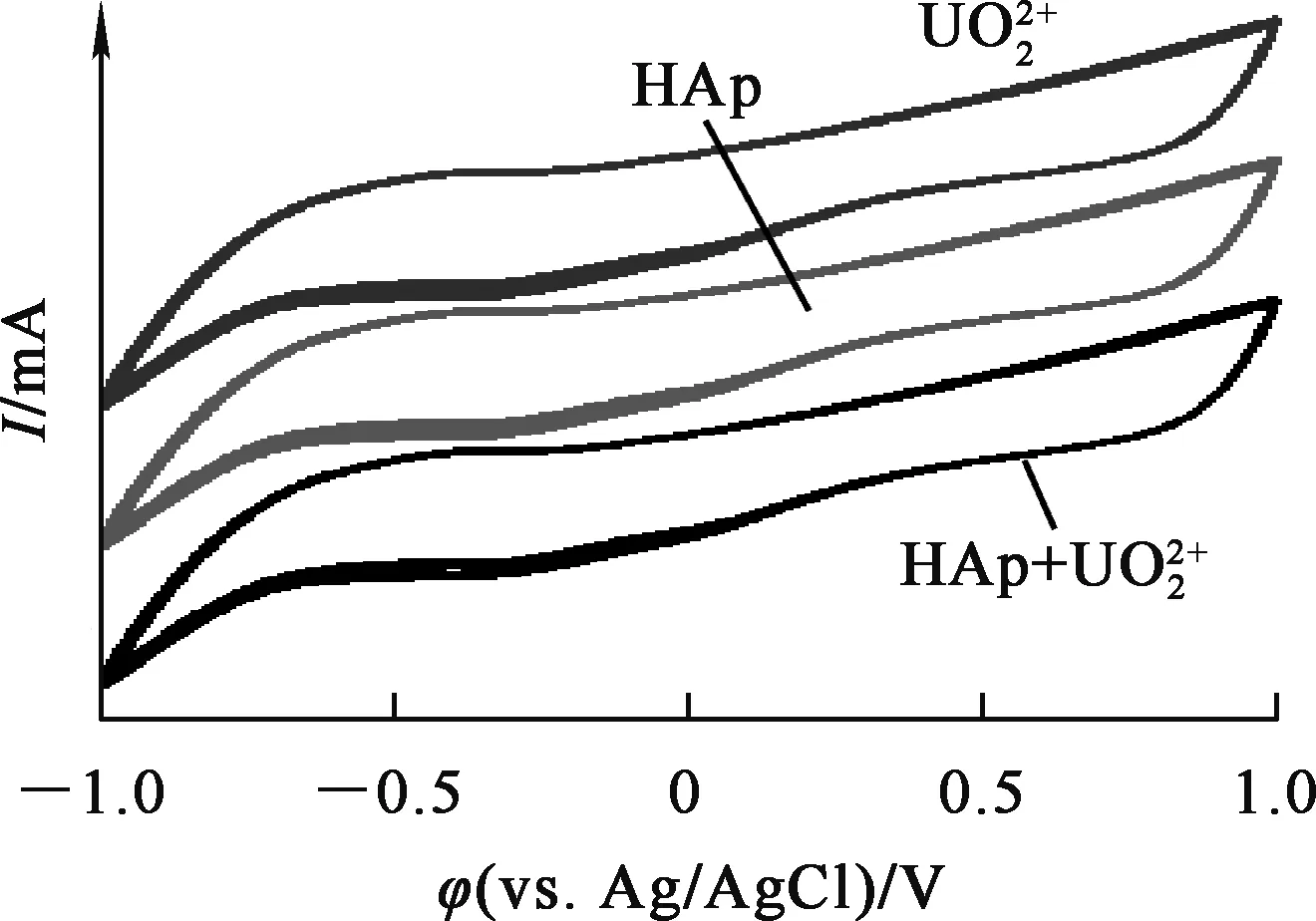
圖羥基磷灰石和羥基磷灰石的CV曲線
2.4 羥基磷灰石吸附鈾的熱力學常數
溶液pH=2.0,磷灰石質量10 mg,溶液中ρ0=100 mg/L,溶液V=10 mL,吸附時間10 min,20~60 ℃下羥基磷灰石對鈾的吸附及依據以下公式計算所得反應熱力學常數見表1。
(4)
(5)
ΔG=ΔH-TΔS。
(6)
式中:kd為分配比,mL/g;R為氣體常數,8.314 J/(mol·K);T為熱力學溫度,K。
表1 羥基磷灰石吸附的熱力學參數
由表1可知:△H0>0,表明吸附過程中吸熱,溫度升高對吸附有利;ΔG0<0,表明羥基磷灰石能自發吸附鈾。自然環境下,羥基磷灰石吸附鈾可自發進行,這是羥基磷灰石周圍存在大量鈾的理論依據。
2.5 羥基磷灰石吸附鈾的等溫模型
溶液pH=2.0,固液質量體積比1.0 g/L,反應時間10 min,反應溫度(20±2) ℃,鈾初始質量濃度對羥基磷灰石吸附鈾的影響試驗結果如圖7所示。
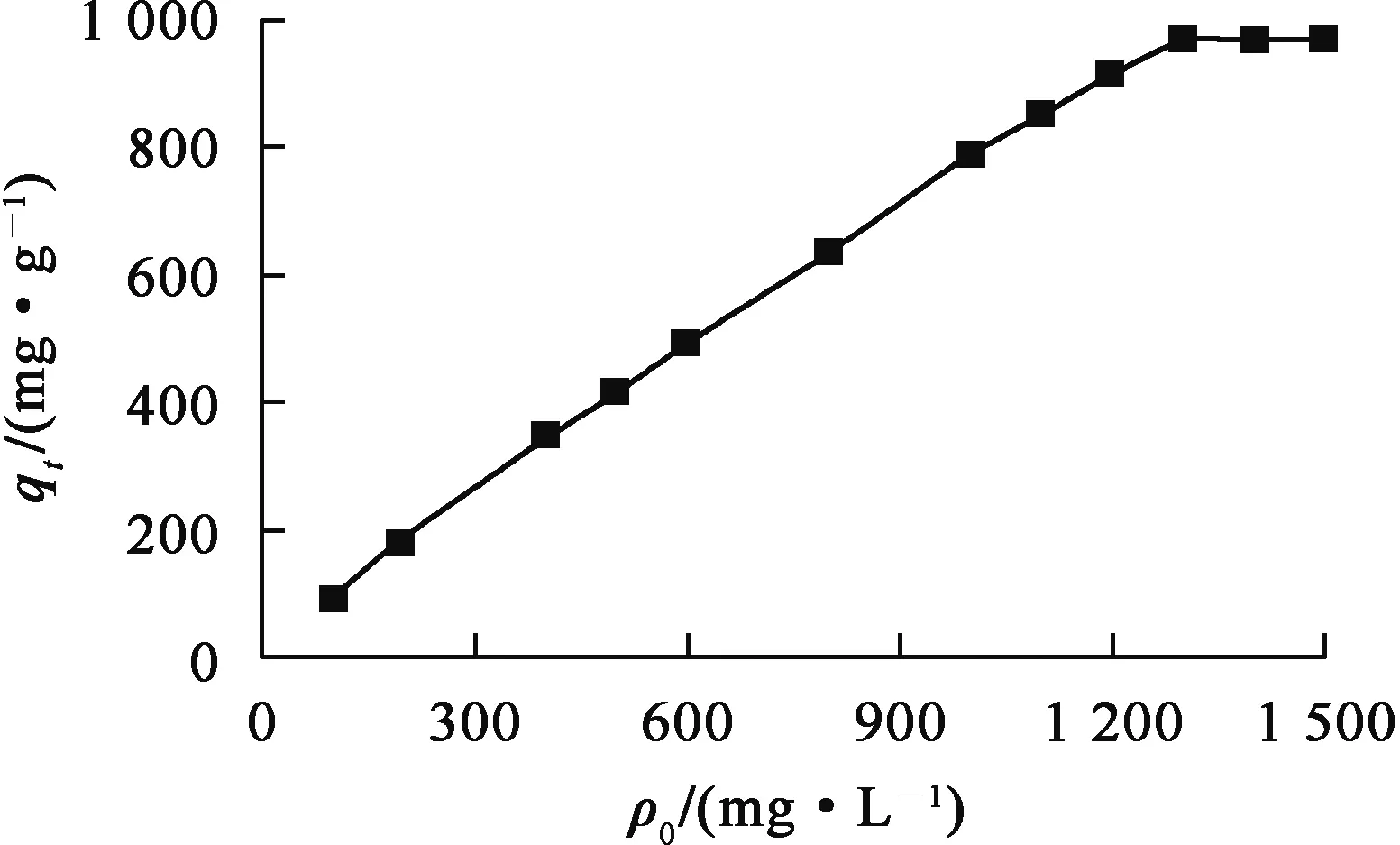
圖7 鈾初始質量濃度對羥基磷灰石吸附鈾的影響
由圖7看出:隨鈾初始質量濃度從0.1 g/L提高到1.3 g/L,羥基磷灰石對鈾的吸附量迅速上升;當質量濃度達1.3 g/L時,吸附達到飽和,羥基磷灰石對鈾的飽和吸附量為970 mg/g,說明羥基磷灰石對鈾具有極強的吸附能力。
用Langmuir等溫吸附模型(式(7))和Freundlich等溫吸附模型(式(8))對上述試驗數據進行擬合。
(7)
(8)
式中:kL為Langmuir等溫吸附常數,L/mg;qmax為理論最大吸附量,mg/g;kF為Freundlich等溫吸附常數,gn/mg1/n。擬合曲線如圖8、9所示。
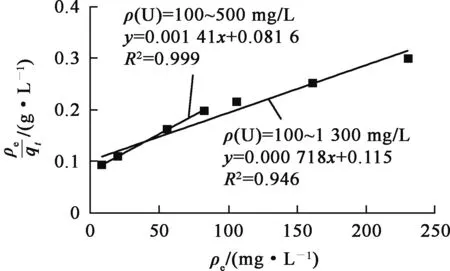
圖8 羥基磷灰石吸附的Langmuir吸附等溫線

圖9 羥基磷灰石吸附的Freundlich吸附等溫線
對比圖8、9可知,羥基磷灰石吸附鈾的過程分為2個階段:鈾質量濃度≤500 mg/L時,Langmuir等溫吸附相關系數R2=0.999,表明鈾質量濃度在此范圍內吸附以均勻單層吸附為主;隨鈾質量濃度增大,吸附向Freundlich等溫模型轉變,為非均勻多層吸附;Langmuir模型(鈾質量濃度100~1 300 mg/L)計算的羥基磷灰石吸附鈾的qmax為1 392 mg/g;Freundlich模型中,1/n<1,表明鈾很容易被羥基磷灰石吸附[17]。
2.6 羥基磷灰石吸附鈾酰溶液中Ca2+的變化
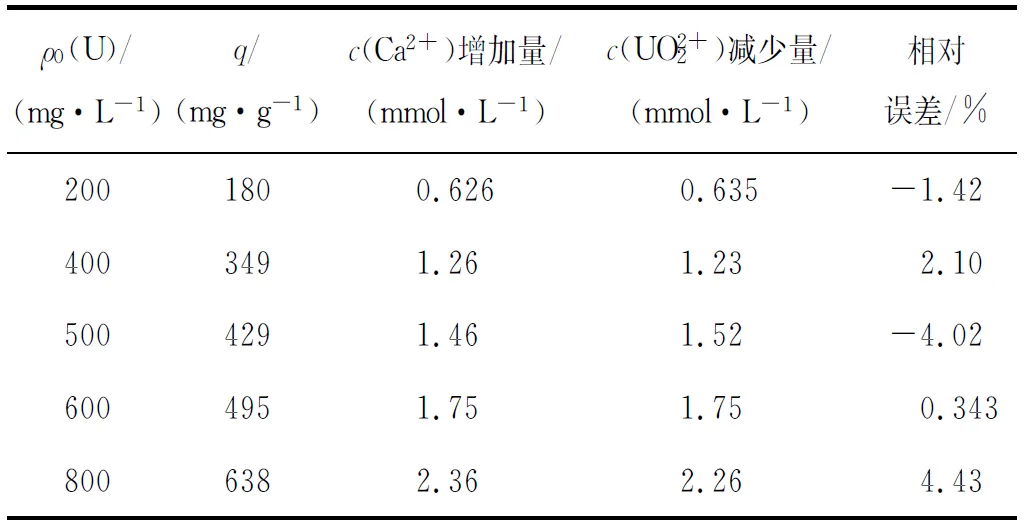
表2 羥基磷灰石吸附鈾平衡后溶液中 Ca2+、UO2+ 2 濃度變化

(9)
2.7 羥基磷灰石與飽和吸附鈾后的U-羥基磷灰石固體的表征
為更好地解釋吸附前后羥基磷灰石的變化,用FEI Nova Nano SEM 450掃描電鏡和Inca Energy X-Max20能譜儀對合成羥基磷灰石和吸附鈾的羥基磷灰石(U-羥基磷灰石)進行表征,結果如圖10、11所示。

圖10 羥基磷灰石的SEM和EDS分析結果

圖11 U-羥基磷灰石的SEM和EDS分析結果
圖10表明:合成的羥基磷灰石表面有豐富的孔隙,孔徑大小為5~10 nm[15],羥基磷灰石主要元素為Ca、P和O。圖11表明:吸附鈾后,U-羥基磷灰石的外部被片狀鈾化合物覆蓋,U-羥基磷灰石的主要元素為U、P和O,表面已無Ca2+存在,說明羥基磷灰石表層的Ca2+已全部被取代,生成了新的物相。唐文清等[18]在研究碳羥磷灰石吸附鉛離子時也得到生成新物相的結論。

圖12 羥基磷灰石和U-羥基磷灰石的XRD圖譜

圖13 羥基磷灰石與的反應機制
3 結論
羥基磷灰石對鈾的吸附符合擬二級動力學模型,為化學吸附。隨溶液中鈾初始質量濃度提高,吸附過程由符合Langmuir等溫吸附模型轉變成符合Freundlich等溫吸附模型,即吸附從單層吸附變為多層吸附。羥基磷灰石在酸性條件下對鈾的吸附能力極強,鈾飽和吸附量為970 mg/g。羥基磷灰石中的磷對鈾酰離子有很強的配位能力,配位反應的吉布斯自由能為負值,配位反應可自發進行。環境中的鈾酰離子可以自發地與羥基磷灰石中的鈣離子發生離子交換,羥基磷灰石在吸附大量鈾后由原本的六方晶型轉化成四方晶型,通過這種晶體的轉化,實現體系能量降低,為羥基磷灰石吸附大量鈾、形成富鈾礦創造了條件。

