缺氧誘導因子-1α、生長素基因沉默對CNE-2鼻咽癌細胞放療及凋亡敏感性的影響
徐茂林 陳曉華 孫 波
(淄博市第一醫院耳鼻咽喉科,淄博255200)
鼻咽癌是我國廣州等南方地區最常見的惡性腫瘤之一,因其主要定位于鼻咽腔頂部和側壁,放療成為了其最主要的治療手段[1]。隨著放療技術及方案的改進,患者的生存率有了明顯提高,但隨著治療的進展,部分患者對放射治療出現抵抗,最終導致治療失敗[2,3]。生物細胞對電離輻射的反應性受多種因素影響,其中,乏氧細胞比例、細胞凋亡調控是關鍵因素[4]。缺氧誘導因子-1(HIF-1)在腫瘤微環境中發揮著重要作用,參與了腫瘤進展、血管生成等多個環節[5]。生存素(Survivin)是一種高效能的凋亡抑制因子,可通過抑制Caspase 活性而發揮作用[6]。有研究表明,HIF-1α、Survivin的表達與患者預后相關,但機制尚不明確。
1 材料與方法
1.1材料 鼻咽癌細胞株CNE-2購于武漢博士德生物科技公司。質粒大提試劑、DH5et大腸桿菌感受態細胞購于美國Invitrogen公司,逆轉錄試劑盒、RT-PCR試劑盒購于TaKaRa公司(大連),miRNA干擾質粒由武漢博士德生物科技公司合成構建。兔抗人HIF-1α單克隆抗體、兔抗人Survivin單克隆抗體購于Abcam公司(英國)。35只4~6周齡BALB/C-nu/nu雌性裸鼠,購自武漢大學動物實驗中心。
1.2方法
1.2.1細胞培養及質粒轉染 細胞CNE-2在37℃,5%CO2條件恒溫培養箱中培養,每2 d傳代1次。制備CNE-2單細胞懸液,接種,貼壁培養后轉染,6 h后更換培養基,繼續培養48 h,熒光顯微鏡下計算轉染率;根據轉染質粒不同,將CNE-2細胞分為HIF-1α干擾組、Survivin干擾組、聯合干擾組、空載組及陰性對照組。
1.2.2小鼠移植瘤模型構建及X射線照射 將35只裸鼠隨機均分為5組,在右腋皮下注射CNE-2細胞(0.2 ml,1.5×1010L-1),密切觀察裸鼠精神狀態、活動狀況及成瘤情況等。在成瘤3 d時,各組隨機選取5只裸鼠進行放射治療,5 Gy/次,共15 Gy,每隔3 d進行一次。裸鼠在放射治療結束后3 d處死,測量腫瘤體積,計算5只裸鼠的平均腫瘤體積。
1.2.3HIF-1α和Survivin mRNA表達水平 ①組織中總RNA提取:標本組織用PBS清洗研磨后,滴加1 ml Trizol,收集裂解物。加入氯仿0.2 ml,離心后吸取上清至EP管,加入異丙醇,混勻后靜置10 min。再次離心后棄上清,取管底沉淀,加入乙醇,再次離心,保留沉淀,靜置后加入DEPC水至完全溶解。采用紫外分光光度儀測定RNA濃度及純度,瓊脂糖凝膠電泳檢測RNA完整。②逆轉錄反應:參照反轉錄試劑盒說明書進行。根據RNA濃度計算需加入的RNA體積,加入OligodT 1 μl,DEPC水,總體積13 μl。反應加樣體系包括,Buffer 4.0 μl,RNA酶抑制劑 0.5 μl,dNTP 2.0 μl,逆轉錄酶0.5 μl,Total2以上體系混勻后,離心,所得cDNA置于-20℃下保存。③RT-PCR檢測:以cDNA為模板,嚴格按照熒光定量試劑盒說明書進行操作。反應體系包括:SYBRPremixExTapTMⅡ(2×)10.0 μl、PCR Forward Primer (10 μl) 1.0 μl、PCR Reverse Primer (10 μl) 1.0 μl、DNA模板(<100 ng)1.0 μl、dH2O 7.0 μl。反應條件為,95℃預變性2 min,95℃變性30 s、60℃延伸30 s,40個循環。
1.2.4HIF-1α和Survivin 蛋白表達水平及凋亡細胞檢測 取裸鼠瘤體組織提取總蛋白。取25 μg上樣,采用SDS-PAGE進行凝膠電泳,轉膜2 h,5%脫脂牛奶封閉2 h,滴加一抗,HIF-1α單抗(1∶2 000)、Survivin單克隆抗體(1∶5 000),4℃孵育過夜,滴加二抗。以GAPDH為內參,溫室孵育,TBST洗滌,采用化學發光法進行曝光,以Image J圖像分析系統測定條帶灰度值。移植瘤凋亡細胞采用TUNEL法檢測。瘤體常規脫水,包埋,切片。染色過程按照試劑盒說明書進行。攝片后,隨機選取5個視野,計數陽性細胞數。陽性標準:胞核內出現棕褐色或棕黃色顆粒。
2 結果
2.1質粒轉染效率及基因沉默效率 轉染48 h后,質粒轉染效率高于90%,熒光細胞數量大于90%。RT-PCR檢測結果發現,HIF-1α、Survivin基因的沉默率均高于85%,可用于構建裸鼠腫瘤模型。見圖1。
2.2裸鼠皮下移植瘤及放射治療效果 各組CNE-2細胞均能在裸鼠體內良好成瘤,成瘤率100%(35/35)。第3天,陰性對照組及空載組腫塊出現,且直徑明顯大于其他組;第4天,兩基因干擾組出現腫塊;第6天,聯合干擾組出現腫塊。生長曲線顯示,隨著成瘤時間的延長,空載組、陰性對照組裸鼠的腫瘤生長速度明顯更快,腫瘤體積顯著更大,其他三組的體積變化率顯著較低。見表1、圖2。
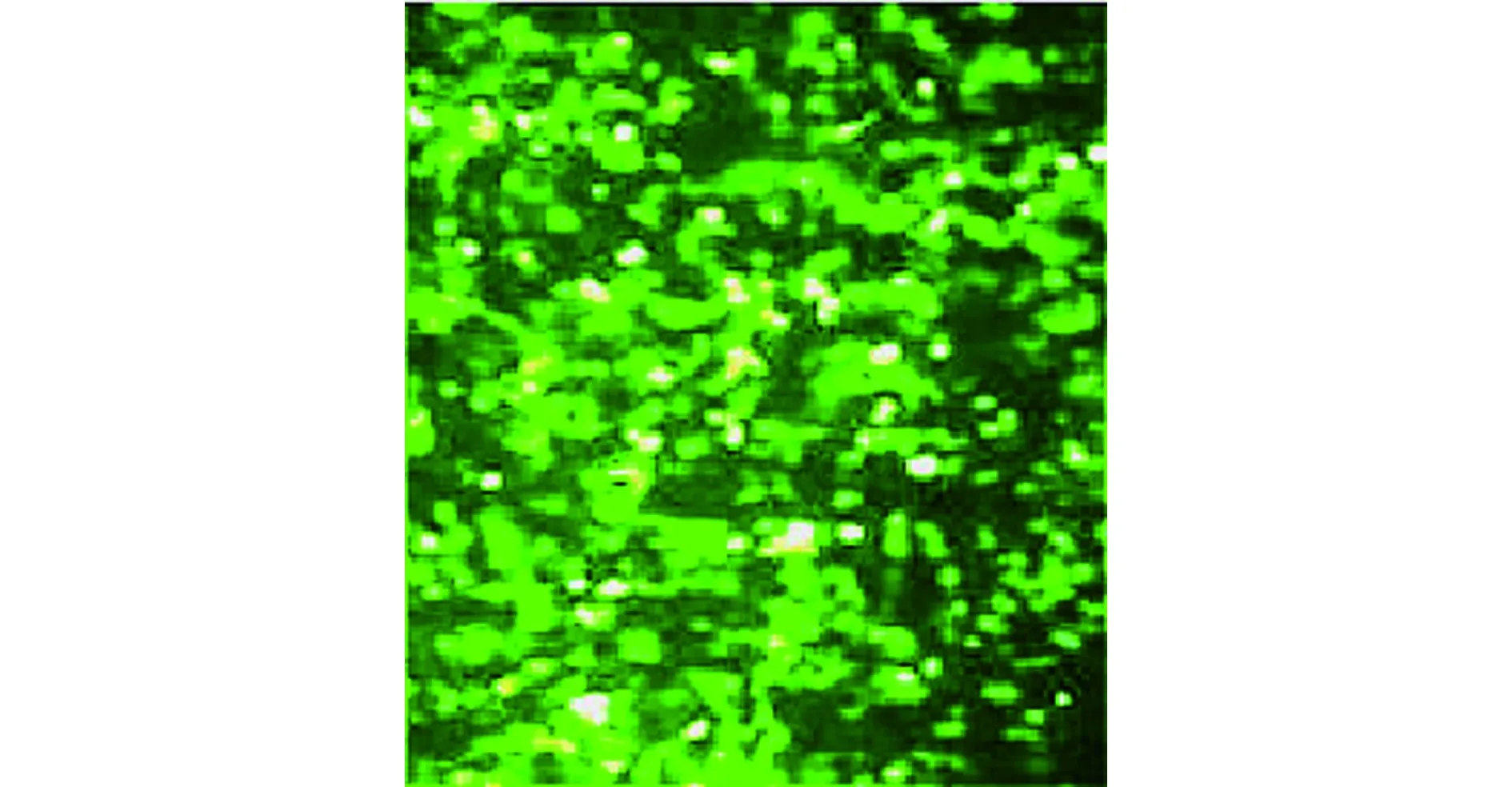
圖1 轉染干擾質粒后CNE-2細胞的熒光染色結果(×100)Fig.1 Fluorescence staining of CNE-2 cells after trans-fection of interfering plasmids(×100)
表1 各組裸鼠皮下移植瘤體積(mm3)
Tab.1 Subcutaneous tumor volume of nude mice(mm3)

TimeHIF-1α interfere groupSurvivin interfere groupJoint interfere groupBlank load transfection groupNegative group6 d59.13±13.1852.79±14.1647.68±12.33203.84±32.87294.62±49.119 d89.25±19.7287.12±18.4753.46±13.98317.28±66.14471.68±54.9712 d93.14±18.4491.28±16.5757.92±14.13476.17±187.68663.56±131.4615 d113.94±17.28119.84±16.7564.86±15.26589.73±174.13819.46±146.9818 d149.39±26.47146.28±19.7686.17±13.45813.59±186.171 094.14±199.34
表2 HIF-1α和Survivin mRNA相對表達量
Tab.2 Relative expression of HIF-1α and Survivin mRNA

GroupsHIF-1αSurvivinHIF-1α interfere group26.9±3.6-Survivin interfere group-24.5±3.1Joint interfere group18.6±2.113.5±4.5Blank load transfection group93.9±12.491.7±9.3Negative group100.0±10.2100.0±11.4
表3 HIF-1α和Survivin蛋白表達水平
Tab.3 Expression of HIF-1α and Survivin

GroupsHIF-1αSurvivinHIF-1α interfere group69.7±11.6-Survivin interfere group-46.6±5.0Joint interfere group61.9±9.039.7±7.0Blank load transfection group97.7±12.091.3±13.7Negative group100.0±13.0100.0±9.0
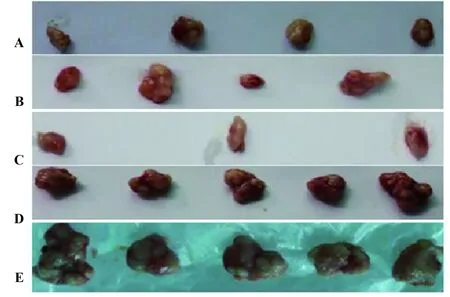
圖2 裸鼠皮下移植瘤體積Fig.2 Volume of subcutaneous transplanted tumors in nude miceNote: A.HIF-1α interfere group;B.Survivin interfere group;C.Joint interfere group;D.Blank load transfection group;E.Negative group.
2.3RT-qPCR檢測 基因的融解曲線均為單峰,無其他雜峰信號,檢測結果可靠,擴增曲線平滑,呈S型。轉染后基因沉默效應較好,各組裸鼠組織中HIF-1α和Survivin mRNA相對表達量見表2。HIF-1α干擾組、Survivin干擾組、聯合干擾組的HIF-1α、Survivin的基因沉默率均高于85%。見圖3、表2。
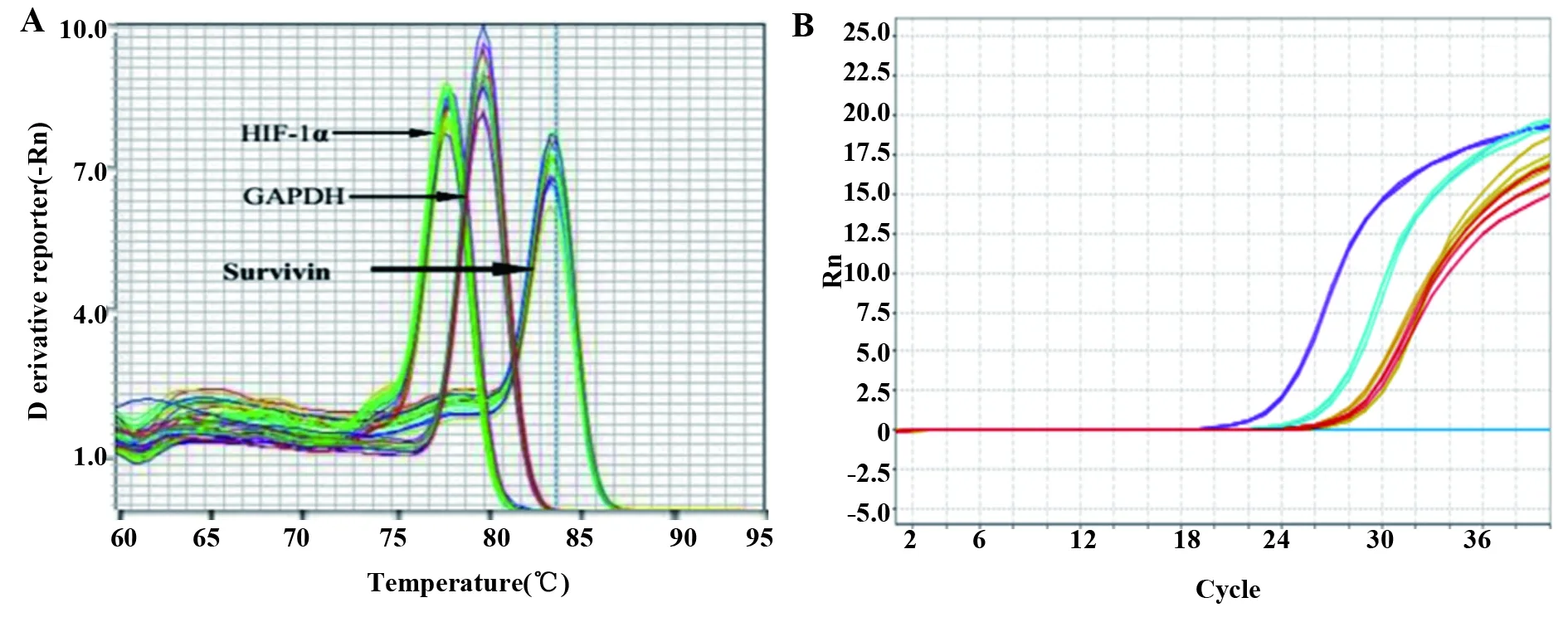
圖3 融解曲線(A)和擴增曲線(B)Fig.3 Melting curve (A) and amplification curve (B)
2.4Western blot檢測 各組裸鼠組織中HIF-1α、Survivin蛋白表達量見表3。根據公式,蛋白沉默效率=1-實驗組蛋白相對表達量/對照組蛋白相對表達量,陰性對照組與空載組的蛋白表達量無明顯差異(P>0.05),HIF-1α干擾組、Survivin干擾組、聯合干擾組的表達量均顯著小于對照組及空載組(P<0.05)。見圖4、表3。

圖4 HIF-1α蛋白、Survivin蛋白在組織中的表達水平Fig.4 Expression levels of HIF-1α protein and Survivin protein in tissuesNote: A.Negative group;B.Blank load transfection group;C.HIF-1α interfere group;D.Joint interfere group;E.Survivin interfere group.
2.5沉默基因聯合X射線照射對鼻咽癌裸鼠移植瘤凋亡的影響 TUNEL檢測結果顯示,正常細胞胞核藍染,形態均一,無黃染顆粒。凋亡細胞胞核固縮,形態異常,出現棕黃色顆粒。HIF-1α干擾組、Survivin干擾組、聯合干擾組之間,兩兩比較,凋亡細胞數量無明顯差異(P>0.05)。但三組的凋亡細胞數量均明顯多于空載組、陰性對照組(P<0.05)。
3 討論
鼻咽癌屬于放射治療中度敏感腫瘤,放療仍然是首選治療手段[7]。我國幅員遼闊,人們食物譜及生活環境、生活習慣不盡相同,不同地區之間鼻咽癌的發病率和死亡率差距相對較大[8,9]。近年來,隨著基因組學、分子生物學的迅猛發展,腫瘤的基因治療理論逐漸成熟并日趨完善。目前,腫瘤的基因治療的研究主要集中于基因沉默治療、自殺基因療法、腫瘤多藥耐藥基因治療、抗端粒酶療法等方面[10]。
腫瘤細胞代謝率顯著高于正常組織,實體腫瘤及微環境均處于缺血缺氧狀態。HIF-1α的主要功能之一就是維持腫瘤細胞在乏氧環境中生存,在乳腺癌、胃癌、肺癌等多種實體惡性腫瘤中,均有HIF-1α蛋白的異常表達[11]。Survivin則廣泛參與了細胞有絲分裂、凋亡及血管生成的調控過程[12]。在本研究中,隨著成瘤時間的延長,空載組、陰性對照組裸鼠的腫瘤生長速度明顯更快,腫瘤體積顯著更大,其他三組的體積變化率顯著較低。這表明沉默HIF-1α、Survivin基因能明顯減緩移植瘤生長速度。同時,對照組及空載組的mRNA表達量、蛋白表達量也明顯高于其他組,且凋亡細胞數量顯著更多。這提示沉默HIF-1α、Survivin基因可提高移植瘤對放射線的敏感性。夏天等[13]在視網膜母細胞瘤的相關研究中發現,沉默HIF-1α基因可有效促進視網膜母細胞瘤細胞凋亡。李潔清等[14]在裸鼠肺癌模型中也發現的同樣的現象,抑制HIF-1α基因后,肺癌移植瘤生長速度明顯放緩,放射治療效果也更加明顯。這都顯示了HIF-1α表達在腫瘤放療抵抗的重要意義,隨著其機制研究的不斷透徹,HIF-1α成為今后臨床上基因分子治療提高放療敏感性的潛在基因靶點。
為了進一步探討兩種基因的表達之間是否存在協同關系,本研究設置了聯合干擾組,結果發現,比單一干擾組相比,雖然聯合干擾組的抑瘤效率相對更高、凋亡細胞數也更多,但差異無統計學意義。這與部分研究者的結論不完全一致。任艷鑫等[15]將以HIF、Survivin基因為靶標的siRNA轉染鼻咽癌細胞后發現,腫瘤細胞增殖能力明顯下降,靶基因的mRNA、蛋白的表達水平也明顯降低,聯合轉染后細胞的所有檢測結果均顯著強于對照組。目前,關于聯合干擾HIF-1α及Survivin 基因的文獻較少,具體機制也不明確。基因的調控網絡十分復雜,二者之間、二者與其他基因之間必定還存在許多或正或負的相互關系。本研究只是單純敲除兩個基因,可能并不能體現兩者之間復雜的關聯,對二者的關系研究尚不夠深入。
綜上所述,本研究發現,單獨的HIF-1α、Survivin基因干擾能有效增強鼻咽癌移植瘤裸鼠模型對放療的敏感性,但聯合干擾后敏感性未明顯增強。