穩定表達TFEB-GFP 細胞系的構建及促TFEB 入核藥物篩選
李 薇 ,劉振興,楊 萌,趙 爽,刁愛坡
(1.天津科技大學生物工程學院,天津 300457;2.內蒙古醫科大學基礎醫學院,呼和浩特 010110)
轉錄因子EB(Transcription Factor EB,TFEB)是第一個鑒定出的MiTF/TFE 家族的基本螺旋-環-螺旋亮氨酸拉鏈(basic-helix-loop-helix leucine zipper,bHLH-Zip)類轉錄因子[1].TFEB 的細胞定位和活性調節與其磷酸化修飾狀態相關.TFEB 蛋白至少可以在20 個位點被磷酸化[2-3],其中的Ser142 和Ser211這兩個絲氨酸殘基對其亞細胞的定位具有關鍵作用[4-7].當這兩個絲氨酸殘基都被磷酸化時,TFEB 定位在細胞質中且無轉錄活性.TFEB 的活性嚴格地受到翻譯后修飾、蛋白質間相互作用和空間組織的調控.在營養豐富的條件下,TFEB 主要以無活性狀態存在于細胞質,但在饑餓或溶酶體功能發生障礙的條件下,TFEB 迅速轉位至細胞核并激活其靶基因的轉錄[4,8].研究[9]表明,很多構成溶酶體的蛋白表達由TFEB 調控.溶酶體功能正常是維持細胞穩態的必要條件[10],參與內吞作用、自噬和溶酶體胞吐作用等許多基本的細胞過程[11].表達溶酶體蛋白增強溶酶體活性,如增強細胞自噬功能,可以防止溶酶體相關疾病的發生.TFEB 的失調會導致多種類型的癌癥,腫瘤細胞依賴于有效的溶酶體功能,并且在致癌過程期間發生溶酶體組成和數量的多種改變.腎細胞癌(RCC)是由腎小管上皮產生的異質性腫瘤,其中的易位RCC(t-RCC)就是由MiTF/TFE 家族成員TFE3 和低頻率的TFEB 有關的基因融合引起的[12-13].在人類胰腺癌細胞(PANC1)中發現了TFEB 的非典型核定位[14].最近在非整倍體細胞的研究中發現,TFEB激活是對未降解的自噬物的溶酶體積累后的溶酶體應激的細胞應答[15].
TFEB 在對細胞應激反應中起作用,在細胞適應各種內部壓力和環境波動中的作用與其全面調節自噬/溶酶體系統的獨特能力密切相關.TFEB 控制參與調節自噬、線粒體功能、代謝、未折疊蛋白反應(UPR)、凋亡和炎癥反應關鍵基因的表達,具有廣泛的功能[16].此外,TFEB 的功能可能具有細胞類型的特異性,它的激活對于肝細胞中的脂質分解代謝、巨噬細胞中的免疫應答以及肌肉中有效的線粒體功能發揮重要作用.
但到目前為止,發現的具有誘導TFEB 發揮功能的化學藥物數量較少,而對于可以利用TFEB 作為靶點的治療腫瘤疾病和神經退行性疾病等頑疾的藥物鮮有報道.本研究的目的在于構建穩定表達TFEBGFP 的人子宮頸癌細胞HeLa,采用該細胞模型篩選新的促進TFEB 入核并發揮其轉錄功能的小分子化合物,并研究其對TFEB 的誘導作用及對細胞生長的影響.本研究將為以TFEB 為靶點調控溶酶體功能的藥物發現與應用提供理論和實物基礎.
1 材料與方法
1.1 材料
1.1.1 菌種、細胞及質粒
大腸桿菌(E.coli)STBL3、人胚腎細胞HEK293T、人子宮頸癌細胞HeLa、人乳腺癌細胞MDA-MB231、穩定表達EGFP-LC3 的HeLa 細胞,慢病毒表達載體系統包括 pLVX-AcGFP1-N1、pMD2.G 和psPAX2 質粒均為本實驗室保存.
1.1.2 主要試劑
Pfu DNA 聚合酶、T4 DNA 連接酶、Taq DNA 聚合酶、限制性內切酶 EcoR Ⅰ和 BamH Ⅰ、DNA marker、蛋白預染marker、TurboFect?,Thermo 公司;PCR 產物純化試劑盒、DNA 膠回收試劑盒、質粒DNA 小量抽提試劑盒,上海生工生物工程有限公司;胎牛血清(FBS),浙江天杭生物科技有限公司;胰酶、DMEM 高糖培養基、嘌呤霉素、DAPI、LC3 抗體,美國Sigma 公司;Opti-MEM 培養基,美國Gibco 公司;噻唑藍(MTT),北京索萊寶生物科技有限公司;βactin 抗體、TFEB 抗體,Santa 公司;p62 抗體,CST公司;Cathepsin B 抗體,Abcam 公司;Histone 抗體、GFP 抗體、HRP 標記的鼠二抗、兔二抗,天津三箭生物技術有限公司.引物合成和基因測序由北京華大基因公司完成.
1.2 方法
1.2.1 pLVX-AcGFP1-N1-TFEB 表達載體的構建
應用Primer 5.0 軟件,根據NCBI 數據庫中的人TFEB 基因序列設計引物.通過比對序列,選擇兩端加上EcoRⅠ和BamHⅠ酶切位點(下劃線部分)及保護堿基.引物序列上游為 5'-CGGAATTCTGATG GCGTCACGCATAGGGTTGC-3',下游為 5'-CGGG ATCCCGCAGCACATCGCCCTCCTCCATG-3'.以本實驗室保存的pcDNA3.1+-flag-TFEB-HA 重組質粒為模板,PCR 反應體系:上、下游引物(10μmol/L)各2μL、模板cDNA 1μL、10×Pfu Buffer(with MgSO4)10μL、dNTP Mix(10 mmol/ L)2μL、Pfu DNA 聚合酶(2.5 U/μL)1μL、ddH2O 82μL.反 應 條 件:95 ℃2 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,共30 個循環;72 ℃ 5 min.擴增得到TFEB 基因片段.將純化后的目的基因片段與 pLVX-AcGFP1-N1 載體采用EcoRⅠ和BamHⅠ雙酶切后純化回收,T4 DNA 連接酶于16 ℃連接過夜.連接產物轉化STBL3 感受態細胞.隨機挑取大腸桿菌轉化子,接種到5 mL 含有200μg/mL 氨芐霉素的LB 液體培養基中,37 ℃、180 r/min 搖床振蕩培養12~16 h.提質粒后采用Taq DNA 聚合酶系統進行PCR 驗證.同時采用EcoRⅠ和BamHⅠ進行雙酶切驗證.分別取5μL PCR 產物和酶切產物進行瓊脂糖凝膠(0.8%)電泳檢測.選取經酶切和PCR 驗證都正確的重組質粒進行測序鑒定.
1.2.2 細胞培養
HEK293T、HeLa、MDA-MB231 細胞均用含有10% FBS 的DMEM 培養基,置于37 ℃、5% CO2培養箱中培養,定期換液傳代.
1.2.3 慢病毒包裝
在60 mm 培養皿中接種適量HEK293T 細胞,細胞生長24 h 融合度達70%~80%時進行轉染.用TurbofectTM將pLVX-AcGFP1-N1-TFEB 重組質粒及pLVX-AcGFP1-N1 質粒分別與psPAX2、pMD2.G 兩個包裝質粒按照4∶3∶1 的比例(共加入6μg)轉染HEK293T 細胞.轉染12 h 更換新鮮培養基,再分別于24 h 和48 h 吸取上清液,將兩次收集液合并,分別為實驗組病毒收集液及對照組病毒收集液,1 500 r/min 離心15 min,小管分裝,每管500 μL,-80 ℃避光保存.
1.2.4 HeLa 細胞最佳嘌呤霉素篩選濃度的確定
在96 孔板中接種適量HeLa 細胞,常規培養24 h 細胞長至70%~80%融合度時,更換含有不同濃度嘌呤霉素的培養基,設置嘌呤霉素終質量濃度為0.2、0.4、0.8、1.6、3.2、6.4μg/mL,每天鏡下觀察,并隔天更換含有不同濃度嘌呤霉素的新鮮培養基.3~5 d 后,導致細胞全部死亡的嘌呤霉素最低濃度即為最低致死濃度(一般以4 d 完全致死為準).
1.2.5 構建穩定表達TFEB-GFP 的HeLa 細胞系
在35 mm 培養皿中接種適量HeLa 細胞,常規培養24 h 細胞長至70%~80%融合度時,更換含有8 μg/mL 聚凝胺(polybrene)的新鮮培養基;再分別加入500 μL 實驗組病毒收集液和對照組病毒收集液,溫和地混勻,37 ℃、5% CO2條件下避光侵染24 h;更換含有最佳嘌呤霉素篩選濃度(終質量濃度1μg/mL)的新鮮培養基,篩選培養5 d 后,計數并重新鋪細胞至60 mm 培養皿,一般每個培養皿700~800 個細胞,一直用含有1μg/mL 嘌呤霉素的培養基進行培養.待單克隆長至肉眼可見時,將單克隆挑起并轉移至新的培養皿擴大培養獲得穩定細胞系.熒光顯微鏡下拍照觀察,同時收集細胞,蛋白免疫印跡技術檢測成功表達TFEB-GFP 的細胞系.
1.2.6 免疫印跡實驗(Western blot)
收集對數生長期的細胞,加入適量RIPA 細胞裂解液(50 mmol/L Tris-Cl(pH 7.4),150 mmol/L NaCl,2 mmol/L EDTA(pH 8.0),1% TritonX-100,0.1%SDS)(含蛋白酶抑制劑)在冰上裂解30 min,4 ℃離心收集上清液并按比例加入SDS 上樣緩沖液,經10%SDS-PAGE 分離后轉至PVDF 膜上,用含有5%脫脂奶粉的PBST 緩沖液(膜封閉液)室溫封閉1 h,于4 ℃條件下進行一抗(稀釋比例分別為TFEB 1∶200、β-actin 1∶5 000、Histone 1∶1 000、p62 1∶1 000、Cathepsin B 1∶2 000、LC3 1∶5 000、GFP 1∶1 000)孵育過夜,PBST 洗膜后再與二抗孵育2 h,PVDF 膜在MiniChemiTM迷你型化學發光成像儀下曝光成像.
1.2.7 藥物篩選
待60 mm 培養皿中TFEB-GFP 穩定細胞系長至所需密度時即可進行96 孔板鋪板.收集細胞,血球計數板計數,調整細胞懸液的濃度,鋪板使待測細胞密度8 000 個/孔,常規培養24 h 后加入終濃度為5μmol/L 的藥物處理,24 h 時用熒光顯微鏡拍照觀察.
1.2.8 MTT 法檢測細胞活力
收集對數期HeLa、MDA-MB231 細胞接種于96孔板中,血球計數板計數,調整細胞懸液的濃度,鋪板使待測細胞密度5 000 個/孔,設復孔3 個.常規培養24 h 后加入不同濃度的藥物處理(1、2.5、5、10、15、20μmol/L),DMSO 為對照組.分別檢測24、48、72 h 的細胞活力.每孔加入20μL 5 mg/mL MTT 溶液,繼續培養4 h 后,小心吸去孔內培養基,每孔加入200μL DMSO 溶解沉淀,置水平搖床上振蕩10 min,使結晶充分溶解.利用酶標儀檢測490 nm 波長下各孔的吸光度.
1.3 統計學處理
應用SPSS 18.0 軟件進行統計分析,采用t 檢驗進行組間比較,*、**和***分別表示P<0.05、P<0.01 和P<0.001.
2 結果與分析
2.1 pLVX-AcGFP1-N1-TFEB表達載體的構建
pLVX-AcGFP1-N1-TFEB 表達載體的構建如圖1所示.對以pcDNA3.1+-flag-TFEB-HA 質粒為模板的PCR 產物進行0.8%瓊脂糖凝膠電泳鑒定,可見大小約為1.5 kbp 的特異性PCR 擴增條帶,與預期一致(圖 1(a)).將純化后的目的片段與載體 pLVXAcGFP1-N1 進行雙酶切純化后連接,轉化 E.coli STBL3 宿主菌,挑取陽性轉化子培養,提質粒后進行PCR 及雙酶切驗證,PCR 產物和酶切產物進行瓊脂糖凝膠電泳檢測.實驗結果顯示:PCR 擴增出目的條帶大小與TFEB 基因(1.5 kbp)相符(圖1(b));雙酶切重組質粒2 出現的兩條帶的大小分別與TFEB 基因(1.5 kbp)和pLVX-AcGFP1-N1 載體(8.8 kbp)大小相符(圖1(c)).選取電泳條帶位置正確的重組質粒2進行測序,驗證載體上插入的TFEB cDNA 序列方向、位置及大小均正確,表明 pLVX-AcGFP1-N1-TFEB 重組表達質粒構建成功.
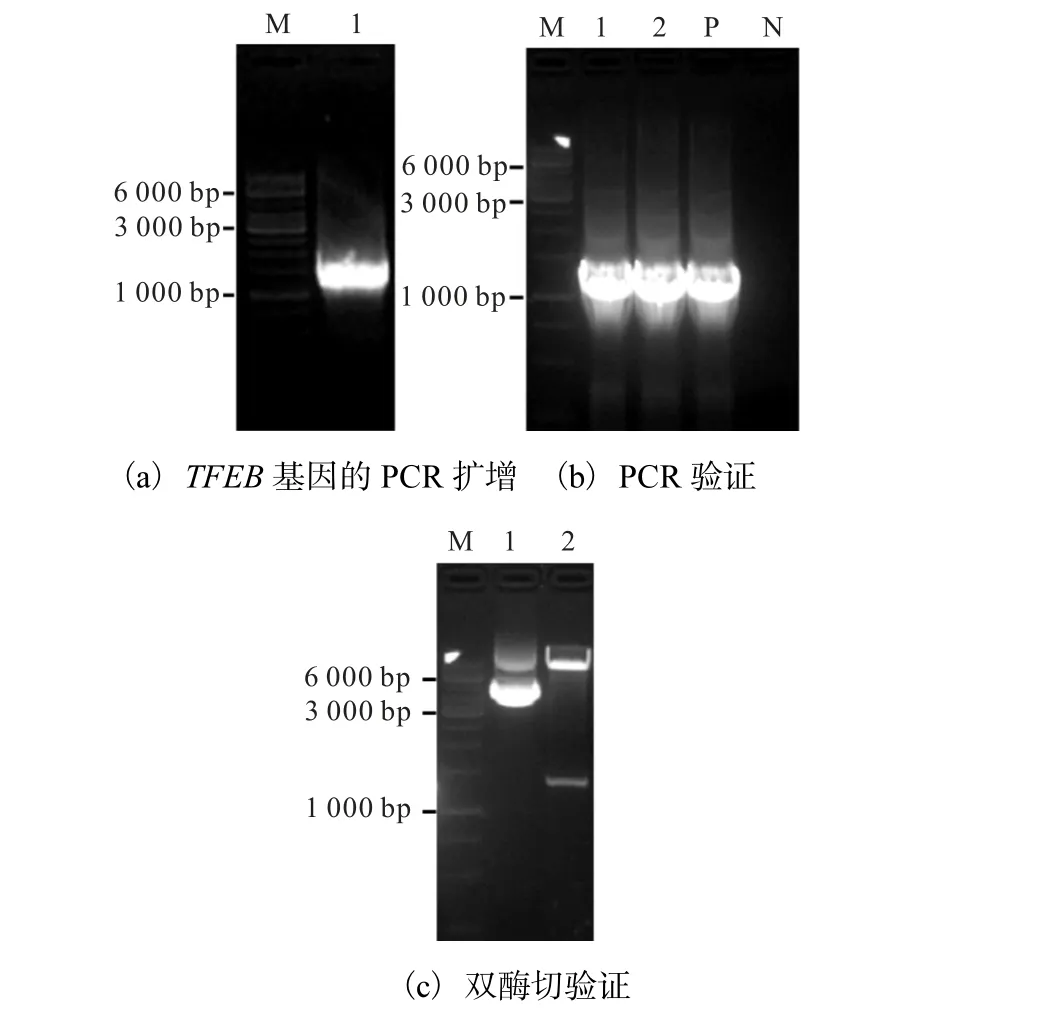
(a)中M.DNA marker;1.PCR 產物.(b)中M.DNA marker;1—2.重組質粒PCR 產物;P.陽性對照;N.陰性對照.(c)中M.DNA marker;1—2.重組質粒雙酶切產物
2.2 穩定表達TFEB-GFP HeLa 細胞系的構建
用嘌呤霉素篩選出穩定表達TFEB-GFP 的HeLa細胞株(TFEB-GFP).對照組病毒收集液侵染的HeLa細胞作為對照,通過熒光顯微鏡拍照觀察,結果如圖2(a)所示,穩定表達TFEB-GFP 的HeLa 細胞的細胞質中有綠色熒光.
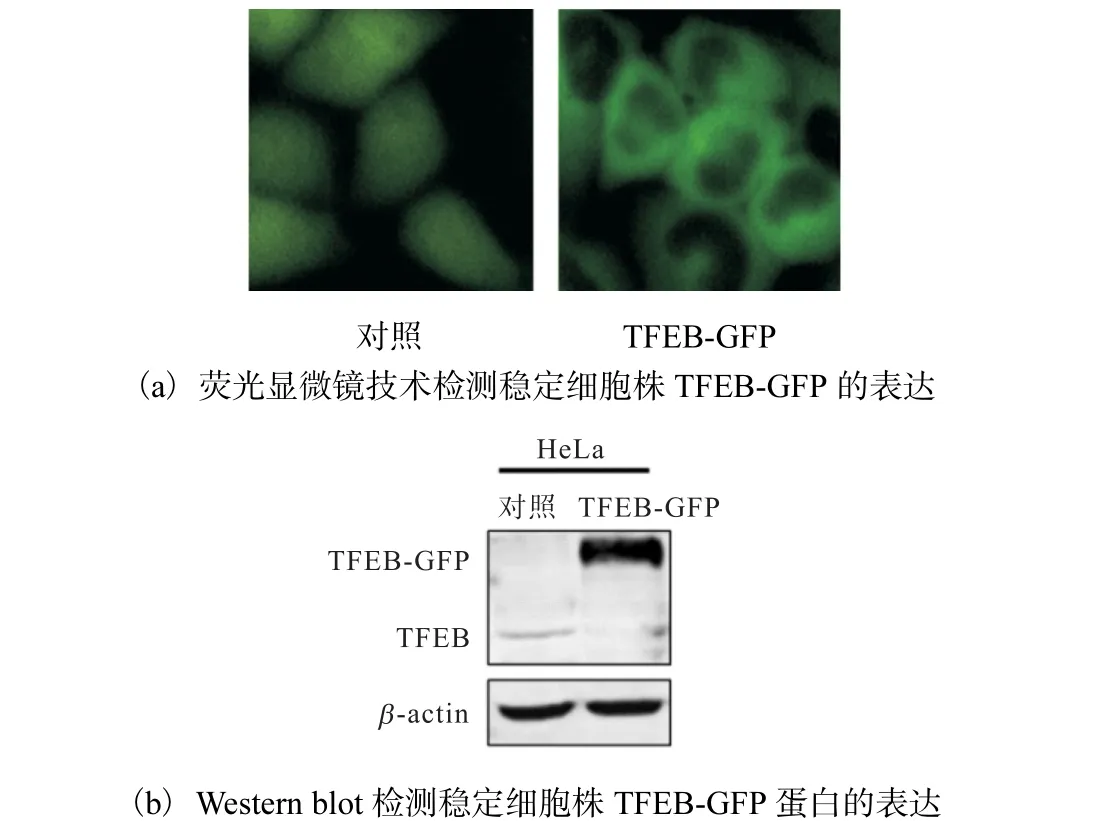
圖2 穩定表達TFEB-GFP HeLa細胞系的鑒定Fig.2 Identification of the expression of TFEB-GFP in the HeLa stable cell lines
收集細胞制成蛋白樣品,通過Western blot 證實實驗組TFEB-GFP 蛋白表達明顯增高(圖2(b)).結果表明穩定表達TFEB-GFP 的HeLa 細胞系構建成功.
2.3 Sertraline HCl促進TFEB入核
利用穩定表達TFEB-GFP 的HeLa 細胞模型,對來自 Selleck 的小分子化合物庫中的藥物進行篩選.DMSO 為陰性對照,Torin 1(終濃度250 nmol/L)為陽性對照,熒光顯微鏡下拍照觀察TFEB-GFP 的定位,確定Sertraline HCl 能夠促進TFEB-GFP 入核,并且以時間(6、12、24 h)依賴性方式誘導TFEB-GFP核聚集(圖3(a)).進一步通過核質分離方法研究Sertraline HCl 對內源性TFEB 細胞定位的影響.6 孔板中接種適宜密度的HeLa、MDA-MB231 細胞,24 h后分別換成加了Sertraline HCl(終濃度5μmol/L)的培養基處理24 h,DMSO 為陰性對照,核質分離以后,以核內TFEB 蛋白量比核內參(Histone)蛋白量統計Sertraline HCl 處理后TFEB 相對核內蛋白量,Western blot 檢測結果如圖3(b,c)所示,Sertraline HCl 處理后,HeLa、MDA-MB231 細胞核中TFEB 蛋白表達量明顯比對照組增多,差異有統計學意義,進一步確定Sertraline HCl 促進TFEB 入核.
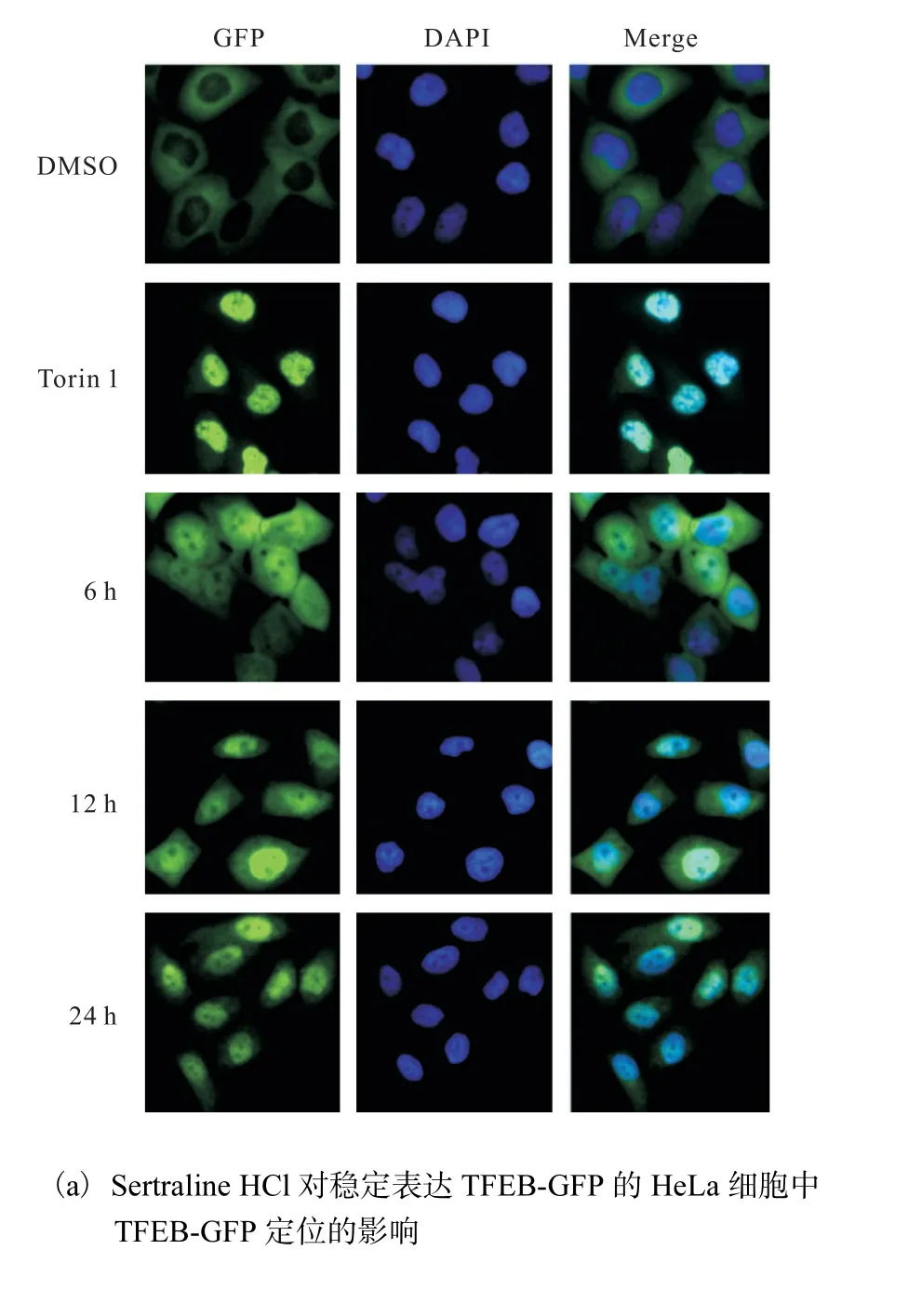
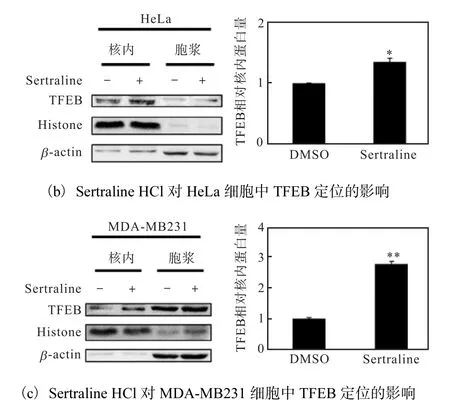
圖3 Sertraline HCl促進TFEB入核Fig.3 Sertraline HCl promoting TFEB nuclear translocation
2.4 Sertraline HCl促進TFEB靶基因表達
為了研究Sertraline HCl 對HeLa、MDA-MB231細胞中TFEB 靶基因表達的影響,以DMSO 作為對照,用10μmol/L Sertraline HCl 處理HeLa、MDAMB231 細胞48 h 后,收集并裂解細胞,蛋白免疫印跡技術檢測結果如圖4 所示.Sertraline HCl 處理后,HeLa、MDA-MB231 細胞中 p62、組織蛋白酶B(Cathepsin B)表達均比對照組增加,差異有統計學意義.這表明Sertraline HCl 促進TFEB 靶基因p62、Cathepsin B 的表達.
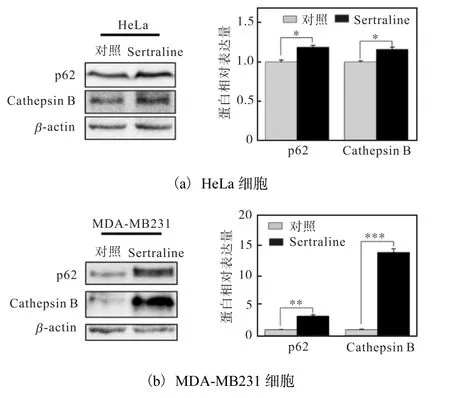
圖4 Sertraline HCl促進TFEB靶基因的表達Fig.4 Sertraline HCl promoting the expression of TFEB target genes
2.5 Sertraline HCl促進細胞自噬
以上實驗結果表明,Sertraline HCl 促進TFEB 入核并增強TFEB 的轉錄活性,而TFEB 調控很多溶酶體蛋白的表達.因此,進一步研究Sertraline HCl 對細胞自噬的作用.LC3 在自噬形成過程中發生聚集的原理為:無自噬時,EGFP-LC3 融合蛋白彌散在胞漿中;自噬形成時,EGFP-LC3 融合蛋白轉位至自噬體膜,在熒光顯微鏡下可以觀察到形成多個明亮的EGFP-LC3 綠色熒光斑點,通過計數評價自噬活性的高低.
將穩定表達EGFP-LC3 的HeLa 細胞培養于96孔板中,常規培養24 h 后加入Sertraline HCl(終濃度5μmol/L),DMSO 為 陰 性 對 照,雷 帕 霉 素(Rapamycin)(終濃度500 nmol/L)為陽性對照.繼續培養6 h,用4% PFA 室溫固定15~20 min,棄去PFA,PBS 洗3 次,熒光顯微鏡下拍照觀察EGFPLC3 點狀分布.圖5(a)結果顯示,Sertraline HCl 處理后,EGFP-LC3 綠色亮點聚集,而且數量比陰性對照增多,說明Sertraline HCl 能夠增加LC3-Ⅱ蛋白的聚集程度,由此表明Sertraline HCl 促進HeLa 細胞自噬體的形成.
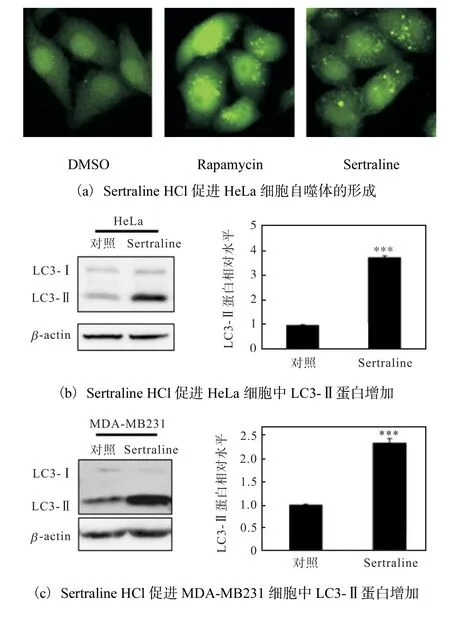
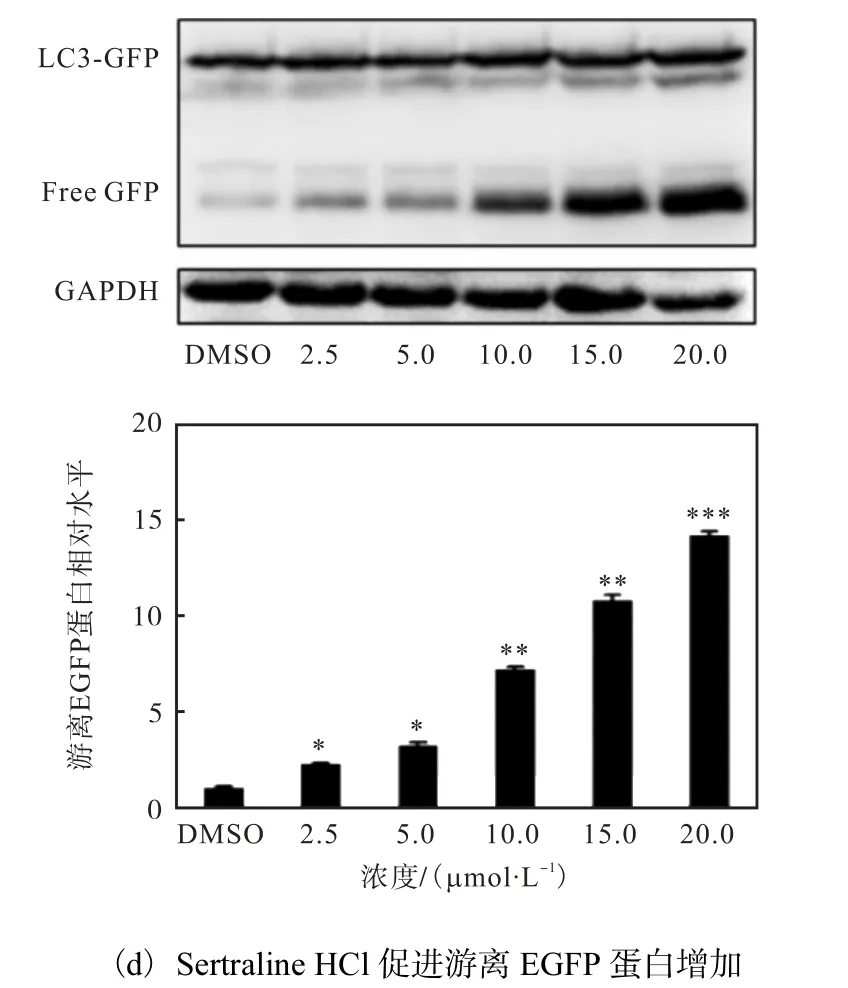
圖5 Sertraline HCl促進細胞自噬Fig.5 Sertraline HCl promoting autophagy
在自噬過程中,LC3 在相關蛋白酶的作用下轉變為具有活性的LC3-Ⅱ并結合到自噬體膜上,因此,LC3-Ⅱ蛋白水平直接反映自噬體數量.LC3-Ⅱ的含量或LC3-Ⅱ/LC3-Ⅰ或LC3-Ⅱ/β-actin 的比例與自噬體的數量呈正相關,在某種程度上反映了細胞的自噬活性[17-18].因此,進一步研究了Sertraline HCl 對LC3-Ⅱ蛋白表達的影響.將HeLa、MDA-MB231 細胞培養于6 孔板中,加入10μmol/L Sertraline HCl 常規培養48 h,DMSO 作為對照,通過蛋白免疫印跡技術檢測自噬標志物LC3 的表達情況.結果如圖5(b,c)所示,Sertraline HCl 處理的HeLa、MDA-MB231細胞中 LC3-Ⅱ蛋白水平明顯高于對照組,表明Sertraline HCl 能夠上調HeLa、MDA-MB231 細胞內自噬體數量.
自噬體形成后會運送到溶酶體,與其融合形成自噬溶酶體,在自噬發生時,EGFP-LC3 連同自噬體內膜和內容物一起被降解;但與LC3 易被降解不同的是,EGFP 在溶酶體中僅表現熒光信號淬滅,本身并不被降解,在自噬溶酶體降解后會釋放出游離的EGFP[19-20].因此,游離EGFP 也可以作為檢測自噬流降解是否發生的依據.通過蛋白免疫印跡技術檢測不同終濃度的Sertraline HCl 處理穩定表達EGFPLC3 的HeLa 細胞12 h 后細胞中EGFP 蛋白的變化,結果如圖 5(d)所示,隨著藥物濃度的增加,游離EGFP 蛋白的數量增加,表明Sertraline HCl 能夠促進自噬流.
2.6 Sertraline HCl抑制腫瘤細胞生長
為了研究Sertraline HCl 是否具有抗腫瘤活性,通過MTT 法檢測Sertraline HCl 對腫瘤細胞活力的影響,結果如圖6 所示.
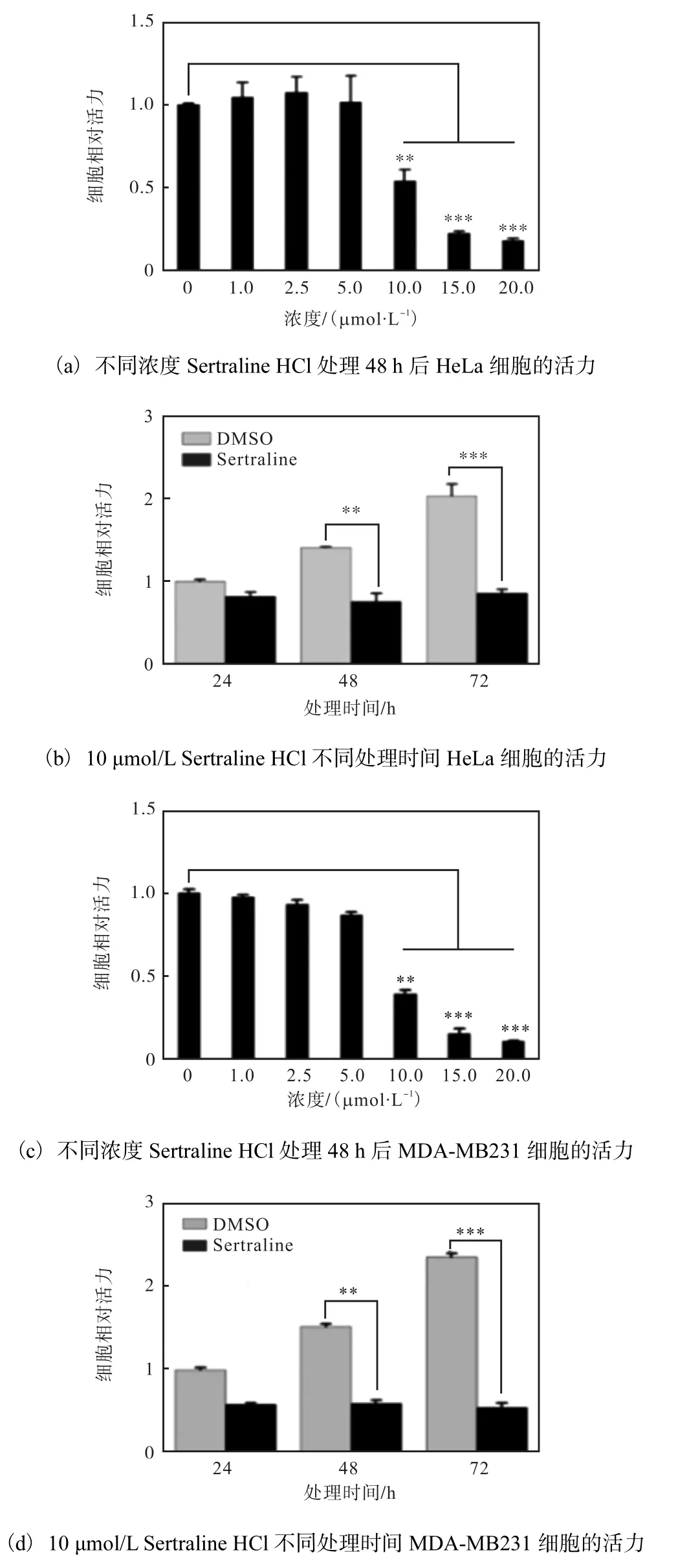
圖6 Sertraline HCl對腫瘤細胞活力的影響Fig.6 Effect of Sertraline HCl on cancer cells viability
Sertraline HCl 在10μmol/L 以上濃度時,HeLa、MDA-MB231 細胞的活力均受到抑制,并呈濃度梯度依賴性;10μmol/L Sertraline HCl 處理HeLa、MDAMB231 細胞48 h 時,細胞活力均出現了明顯降低(P<0.01),72 h 更明顯(P<0.001),并呈時間梯度依賴性,表明Sertraline HCl 抑制腫瘤細胞的活力.
3 討 論
TFEB 與人類疾病的發生存在相關性,它的激活對許多神經系統疾病和溶酶體疾病的治療有潛在的作用.因此,以精確的時間和組織特異性方式調節TFEB 活性的小分子化合物的開發具有很好的前景.這些小分子有潛力用于眾多的人類疾病的治療,包括肝細胞代謝調節、巨噬細胞炎癥反應、肌肉線粒體功能以及神經元細胞清除等方面.
TFEB 參與細胞內清除的多個途徑,TFEB 可以作為治療靶點用于治療許多與自噬或溶酶體功能障礙有關的疾病和與有毒聚集物累積相關的疾病.研究證明調節TFEB 的活性具有作為溶酶體疾病治療策略的潛力,因為自噬/溶酶體途徑的缺陷是這類疾病發病機制的重要原因[21-23].
因此,構建穩定表達TFEB-GFP 的HeLa 細胞系用于篩選和研究激活TFEB 活性小分子化合物具有重要意義.本研究篩選到Sertraline HCl 具有促進TFEB 轉錄活性的作用.Sertraline HCl 是選擇性5-羥色胺再攝取抑制劑(SSRIs)類的抗抑郁藥[24],主要用于治療抑郁癥、焦慮癥、強迫癥、恐慌癥和創傷后應激障礙,還可用于早泄[25-26]、神經心源性暈厥[2]等疾病的治療.Sertraline HCl 也適合治療包括患阿爾茨海默氏病(AD)在內的老年患者的抑郁癥狀[27],控制AD 患者出現的其他可能由血清素能系統介導的行為問題,如焦慮、易怒和攻擊性等[28].能夠改善伴有抑郁癥的穩定型慢性阻塞性肺疾病(COPD)患者生活質量的療效[29],在治療腦卒中后抑郁癥[30]、糖尿病抑郁癥[31]、冠心病介入術后抑郁癥[32]、帕金森病后抑郁癥[33]也顯示了良好的臨床效果.Sertraline HCl對腦結構的改善與強迫癥患者的癥狀改善有關,Tang等[34]研究了Sertraline HCl 對強迫癥患者腦結構的影響,結果顯示,用Sertraline HCl 進行藥物治療12 周后,有11 例強迫癥患者的灰質體積顯著增加,小腦活化增加.目前,Sertraline HCl 的抗抑郁療效明顯,但對腫瘤細胞的作用鮮有報道.
本次實驗利用高效且能穩定整合于宿主基因組的慢病毒載體構建了穩定表達TFEB-GFP 的HeLa細胞系,為研究TFEB 在HeLa 細胞中的功能及作用機制奠定了基礎,該細胞系還為針對TFEB 的靶向性研究提供了一種切實可行的細胞模型;同時利用該細胞模型篩選出了促TFEB 入核藥物Sertraline HCl,該藥物能夠促進TFEB 靶基因的表達,并促進細胞自噬,具有抗腫瘤活性.自噬在腫瘤細胞中起著抵抗腫瘤組織微環境壓力的作用,從而促進腫瘤細胞的生長.當細胞自噬處于一定的水平內,主要體現為促進腫瘤細胞存活的作用,但是也存在過度激活的自噬導致腫瘤細胞死亡的現象,這也是一個可能的抑瘤機制[35].因此,可以推測Sertraline HCl 可能通過過度激活細胞自噬引起腫瘤細胞的死亡.

