對甲氧基苯酚催化選擇性加氫制對甲氧基環己酮
高明明,張 力,程 杰,萬克柔,林 濤,趙卓然,張炳亮
(西安凱立新材料股份有限公司,陜西 西安 710201)
對甲氧基環己酮是一種重要的醫藥和農藥中間體,應用廣泛[1-2]。目前,對甲氧基環己酮制備方法有傳統合成法、環己醇氧化法和對甲氧基苯酚催化加氫法[3]。催化加氫法因其工藝簡單、產品收率高、生產清潔的優點,成為現在研究的熱點[4-5]。專利US20130165697[6]以Pd/C作催化劑,對甲氧基苯酚收率達93%,但催化劑投量大,無套用成本高;龔亞軍[7]等以5%Pd/C作催化劑,在100℃、0.8 MPa、底物濃度25%條件下,對甲氧基環己酮收率達95.3%,催化劑套用4次,活性無明顯下降。褚曉寧[8]等用沉積-沉淀法制備了Ni/Al2O3-DP催化劑,先催化對甲氧基苯酚加氫得到對甲氧基環己醇,然后以雙氧水為氧化劑氧化對甲氧基環己醇制備對甲氧基環己酮,產物選擇性達95.3%。
釜式催化加氫法雖然具有較好的產物選擇性,但釜式催化加氫法為間歇式操作,過程復雜,操作繁瑣,工作量大。因此,開發一種生產率高、選擇性好、三廢少、安全環保,能夠連續生產對甲氧基環己酮的新工藝以及專用催化劑具有重要意義。
1 實驗部分
1.1 催化劑制備
采用飽和浸漬法制備催化劑,載體為活性Al2O3(山東助劑廠,粒徑2~3 mm)。將載體加入到含Pd為0.5%的氯化鈀浸漬液中,飽和浸漬24 h,120℃干燥至恒重,300℃氫氣還原2 h得0.5% Pd/Al2O3催化劑。
1.2 催化劑表征
在ASAP2010 型物理吸附儀上測定催化劑比表面積、孔容和孔徑分布。吸附前樣品經250℃抽真空(< 6167×10-2Pa) 處理3 h。
在Bruker D8 Advance型的X射線衍射儀測定催化劑的物相結構。操作條件為:N2氣氛,Cu Kα射線源,管電壓40 kV,管電流10 mA ,步進寬度0.02°/步,掃描范圍10°~80°。
H2-TPD(氨程序升溫脫附)在裝有質譜的自制裝置上進行。載氣是流速為20 mL/min的高純Ar氣,催化劑樣品先在450℃處理60 min,然后冷卻至100℃并吸附H2至飽和狀態。吸附飽和后用Ar氣吹掃后,以10℃/min的升溫速率進行升溫脫附,脫附下來的NH3用質譜測定。
NH3-TPD測定方法同H2-TPD,只是將介質氣H2換為NH3。
1.3 活性評價
催化劑活性采用固定床列管反應器評價。反應器底部用石英砂固定,然后將一定量催化劑裝在反應器恒溫段,上段亦用同粒度石英砂固定。原料(溶劑與對甲氧基苯酚質量比=4∶1)用柱塞計量泵打入,氫氣用質量流量計控制后進入反應器上部與原料混合后進入催化劑床層反應。反應產物進入分離罐進行分離,氣相經背壓閥排空,液相由罐底放出。
反應產物采用島津GC-2019 Plus型氣相色譜儀分析,石英毛細管色譜柱,FID檢測器,檢測器溫度280℃,色譜柱溫度90℃,面積歸一化法定量分析。
2 結果與討論
2.1 催化劑表征結果
2.1.1 N2吸附表征
催化劑0.5% Pd/Al2O3的吸附-脫附等溫線如圖1所示。

圖1 催化劑吸附-脫附等溫線Fig.1 Adsorption-desorption isotherm of catalyst
由圖1可知,吸附-脫附等溫線具有滯后環,為IV等溫線,屬于介孔特征。在P/P0=0~0.7低壓階段,N2吸附量增加緩慢,此時N2分子以單層到多層吸附在催化劑內表面。在P/P0=0.7~0.9高壓階段,吸附量增加迅速,N2分子在催化劑孔道冷凝積聚。采用BET及BJH計算得催化劑比表面積及孔容為258 m2/g和0.51 cm3/g,平均孔徑為6.1 nm。催化劑孔徑大,生成的對甲氧基環己酮容易擴散,減少了進一步加氫,提高了選擇性。
2.1.2 XRD表征結果
載體及催化劑的XRD譜圖如圖2所示。

圖2 載體及催化劑XRD譜圖Fig.2 XRD patterns of support and catalyst
由圖2可知,活性氧化鋁載體衍射峰較弱,表面氧化鋁以無定型狀態存在。催化劑譜圖中未出現Pd或PdO晶粒特征衍射峰,表明Pd金屬在催化劑表面分散性好,以微晶形式存在,催化劑活性高。
2.1.3 H2-TPD表征結果

圖3 催化劑H2-TPD線Fig.3 H2-TPD profiles of catalyst
催化劑0.5% Pd/Al2O3的H2-TPD譜圖如圖3所示。
由圖3可知,催化劑有一個較寬的脫附峰,脫附峰面積大,表明催化劑表面Pd含量較高,對氫氣的吸附量大,催化劑活性高。
2.1.4 NH3-TPD表征結果
催化劑0.5% Pd/Al2O3的NH3-TPD譜圖如圖4所示。
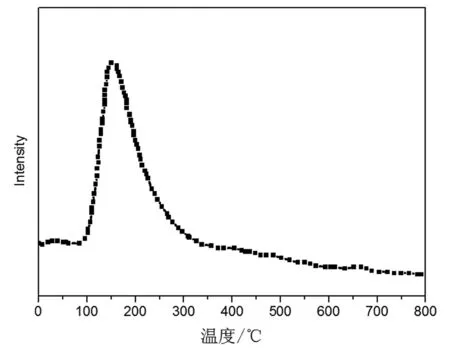
圖4 催化劑NH3-TPD線Fig.4 NH3-TPD profiles of catalyst
根據NH3-TPD脫附溫度的高低可將催化劑酸性中心劃分為弱酸中心(150~250℃),中強酸中心(250~350℃),強酸中心(350~450℃)。由圖4可知,催化劑在200~300℃有一個強的脫除峰,表明催化劑以中強酸為主。
2.2 反應器操作條件對催化劑性能的影響
2.2.1 溫度的影響
反應溫度對催化劑性能影響如圖5所示。
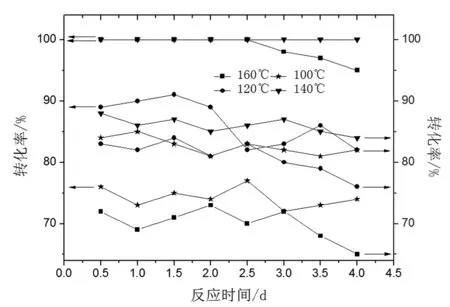
圖5 反應溫度對催化劑性能的影響Fig.5 Effect of reaction temperature on the performance of catalyst
由圖5可知,反應溫度低,產物選擇性在80%以上,但反應物轉化率較低。反應溫度升高,催化劑活性增加,轉化率和選擇性均增加,但當反應溫度達160℃,轉化率隨反應時間增加有所降低,產物選擇性較低。高溫會使產物進一步加氫生成副產物對甲氧基環己醇,且催化劑容易結焦失活。
2.2.2 壓力的影響
反應壓力對催化劑性能影響如圖6所示。
由圖6可知,隨著反應壓力升高,反應物轉化率升高,產物選擇性先增加后降低,反應壓力為0.5 MPa時,催化劑活性最高。反應壓力過高,反應物溶解氫濃度增加,產物對甲氧基環己酮過度加氫,選擇性降低。
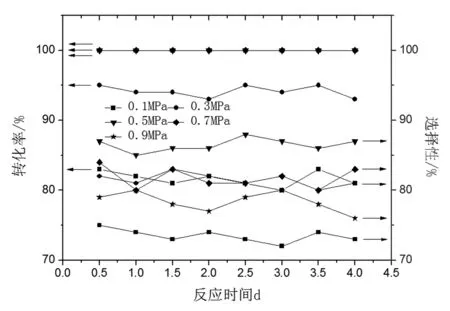
圖6 反應壓力對催化劑性能的影響Fig.6 Effect of reaction pressure on the performance of catalyst
2.2.3 空速的影響
對甲氧基苯酚質量空速對催化劑性能影響如圖7所示。
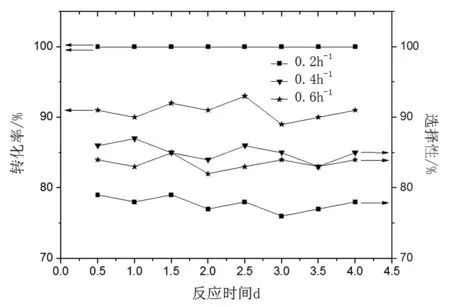
圖7 空速對催化劑性能的影響Fig.7 Effect of space velocity on the performance of catalyst
由圖7可知,反應空速增加,對甲氧基苯酚轉化率降低,對甲氧基環己酮選擇性先升高后降低。低反應空速下,反應物在床層停留時間長,產物過度加氫,選擇性低。高空速下,停留時間短,反應物轉化不完全,原料剩余。
2.2.4 溶劑的影響
溶劑對催化劑性能影響如圖8所示。
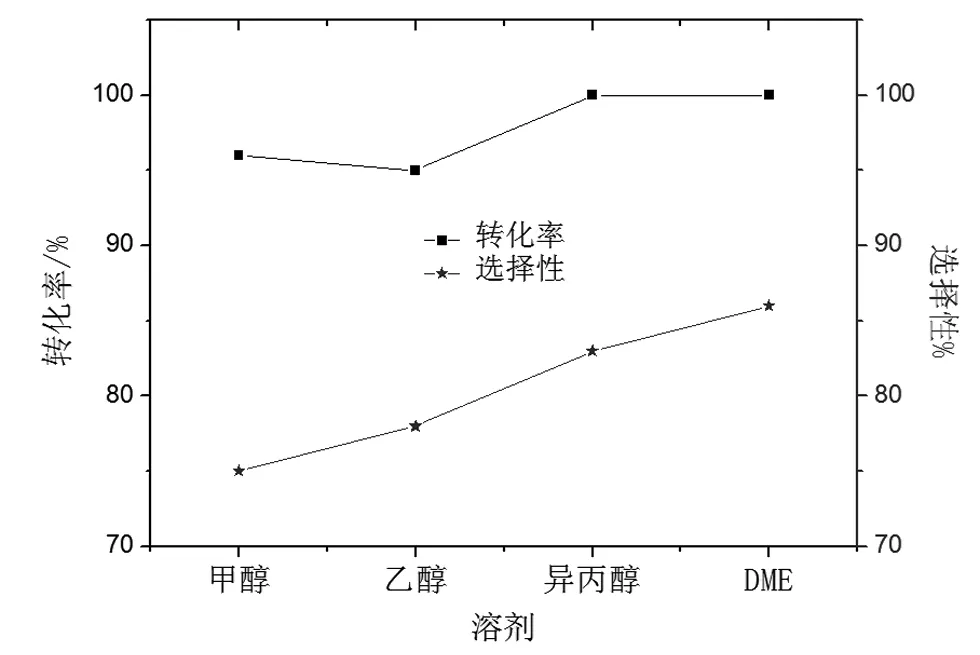
圖8 溶劑對催化劑性能的影響Fig.8 Effect of solvent on the performance of catalyst
由圖8并結合色譜結果知,甲醇,乙醇溶劑參與反應,副產物較多,異丙醇溶劑較好,DME效果最佳。
2.3 催化劑穩定性
在反應溫度140℃、反應壓力0.5 MPa、空速0.4 h-1條件下,催化劑穩定性評價結果如圖9所示。
由圖9可知,催化劑性能穩定,連續運行30天,反應轉化率保持在99%以上,產物選擇性保持在85%以上。

圖9 催化劑穩定性Fig.9 Reaction stability of catalyst
3 結論
(1)催化劑比表面積和孔徑較大,活性金屬Pd主要以微晶形式分散在催化劑表面,催化劑表面Pd含量較高,催化劑以中強酸為主。
(2)反應溫度對催化劑活性影響較大,提高反應溫度,催化劑活性增加,反應物轉化率和產物選擇性均增加,但高溫會使產物進一步加氫生成副產物對甲氧基環己醇,且催化劑容易結焦失活,轉化率隨反應時間增加有所降低,產物選擇性較低;反應壓力升高,轉化率升高,產物選擇性先增加后降低,反應壓力過高,反應物溶解氫濃度增加,產物對甲氧基環己酮過度加氫,選擇性降低;空速增加,轉化率降低,對甲氧基環己酮選擇性先增加后降低,在低空速下,反應物在床層停留時間長,產物過度加氫,選擇性低,高空速下,反應物停留時間短,原料轉化不完全。
(3)乙二醇二甲醚(DME)為溶劑,反應溫度140℃,反應壓力0.5 MPa,對甲氧基環己酮質量空速0.4 h-1條件下連續反應30天,對甲氧基苯酚轉化率維持在99%以上,對甲氧基環己酮選擇性維持在85%以上。

