原鹽中氯離子測定方法的優化
(唐山三友化工股份有限公司純堿公司,河北 唐山 063305)
原鹽是氨堿法生產純堿中用量最大、對生產影響最突出、采購所用資金最多的重要原料。其質量好壞與生產、消耗等多個環節息息相關。因此,采用準確、快速的檢驗方法對原鹽樣品進行檢驗,一方面能有效地指導生產,另一方面也是維護供需雙方經濟利益的基礎和保障。一直以來,傳統的莫爾法是測定原鹽中Cl-含量的首選。但是,此方法在實際工作中耗時耗力,工作效率低,分析數據滯后。目前,隨著科技的發展,越來越多的儀器分析方法得以應用,而電位滴定法是比較成熟的儀器分析方法之一,該方法在滴定過程中通過測量電位變化以確定滴定終點,滴定誤差更小,精密度、準確度更高。如將適用于微量分析的電位滴定法進行改進,將其應用于常量分析,實現對原鹽中高含量氯離子的測定,即可實現在確保準確度的前提下,提高工作效率。
1 試驗原理
1.1 莫爾法
在中性或弱堿性溶液中以K2CrO4為指示劑,用AgNO3標準溶液直接滴定,因AgCl的溶解度比Ag2CrO4小,所以AgCl先沉淀,至溶液中Cl-全部變為AgCl后,稍過量的AgNO3標準溶液與溶液中K2CrO4指示劑反應生成磚紅色的Ag2CrO4沉淀,即為滴定終點,主要反應式如下:
Ag++Cl-→ AgCl↓(白色)
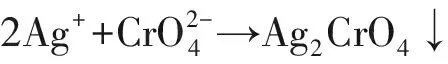
1.2 電位滴定法
選用銀電極為指示電極和參比電極與被測溶液組成一個工作電池,在滴定過程中,參比電極的電位保持恒定,隨著滴定劑(AgNO3)的加入,由于發生化學反應,被測離子的濃度不斷發生變化,因而指示電極的電位隨之變化。在滴定終點附近,被測離子濃度發生突變,會引起指示電極電位的突躍,指示電極電位的突越點就是滴定終點。因此,根據指示電極電位的突躍可確定滴定終點。
2 試樣準備
1)將500 g左右原鹽樣品,用萬能破碎機細碎至直徑小于2 mm的顆粒,混勻,放入潔凈干燥大稱量瓶中。迅速稱取20 g樣品,稱準至0.0010 g,溶于500.0 mL容量瓶中,搖勻,靜置1 h后備用。
2)將在500 ℃馬弗爐中灼燒至恒重的NaCl標準物質,冷卻后稱取20 g,稱準至0.0010 g,溶于500.0 mL容量瓶中,搖勻備用。
3 試驗方案的改進
由于原鹽中Cl-含量比較高,一般在55%左右。在滴定過程中,產生的氯化銀沉淀較多,與微量滴定相比,沉淀包裹電極和螺旋槳攪拌器現象非常嚴重,僅僅借助儀器的淋洗裝置,不能很好地解決此現象,造成數據偏差很大。為解決電位滴定中出現的這一問題,利用氯化銀沉淀為膠狀沉淀的特征,采用加入淀粉指示劑,使溶液保持膠體狀態,阻止氯化銀凝聚,從而得到很好的效果,同時也確保了結果的準確度。
3.1 精密度試驗
精密度是指在相同條件下n次重復測定結果彼此相符合的程度。精密度的大小用偏差表示,偏差愈小說明精密度愈高。
3.1.1 莫爾法
試驗儀器與試劑:AgNO3標準溶液(0.1004 mol/L)、鉻酸鉀指示劑(100 g/L)、棕色酸式滴定管(50.00 mL)、移液管(5.00 mL)、錐形瓶(250 mL)。
試驗步驟:移取5份第2節2)中的NaCl標準物質溶液(5.00 mL)于250 mL錐形瓶中,加入少量蒸餾水,加入3~5滴K2CrO4指示劑,用0.1004 mol/L AgNO3標準溶液分別進行滴定,消耗標準溶液體積為V1mL,計算NaCl%,公式如下:
式中:f——標準溶液溫度校正系數(此處溫度為20 ℃,f=1.0000);
m——NaCl標準物質質量(此處m=20.0000 g);
V0——滴定管補正值(-0.02 mL)。
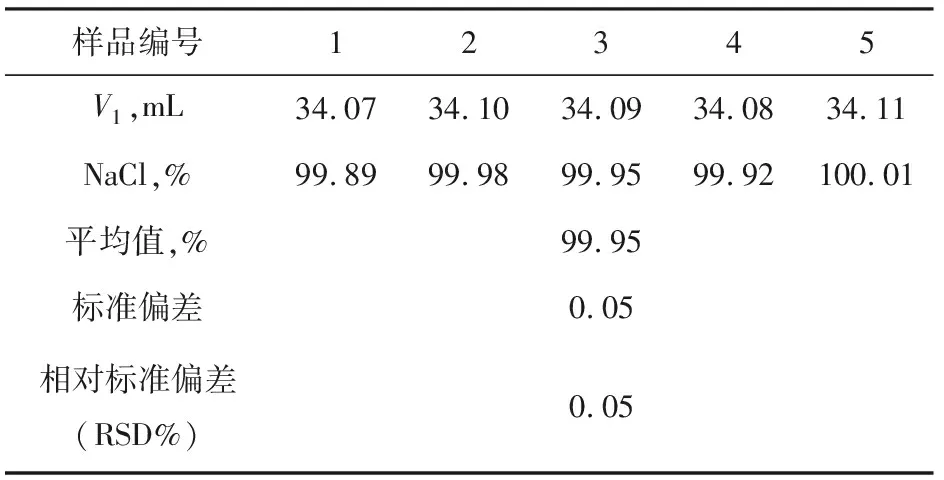
表1 莫爾法測定NaCl結果
3.1.2 電位滴定法
試驗儀器與試劑:瑞士萬通855型自動電位滴定儀、復合銀電極、AgNO3標準溶液(0.1004 mol/L)、移液管(5.00 mL)、淀粉指示劑(10 g/L)、錐形瓶(250 mL)。
試驗步驟:移取5份第2節2)中的NaCl標準物質溶液(5.00 mL)于250 mL錐形瓶中,加入10 mL淀粉指示劑,加入70 mL蒸餾水,使用瑞士萬通855型自動電位滴定儀,用0.1004 mol/L AgNO3標準溶液進行滴定,消耗標準溶液體積為V2mL,計算NaCl%,公式同第3.1.1節,V0在此為電位滴定法中的空白值(-0.04 mL)。
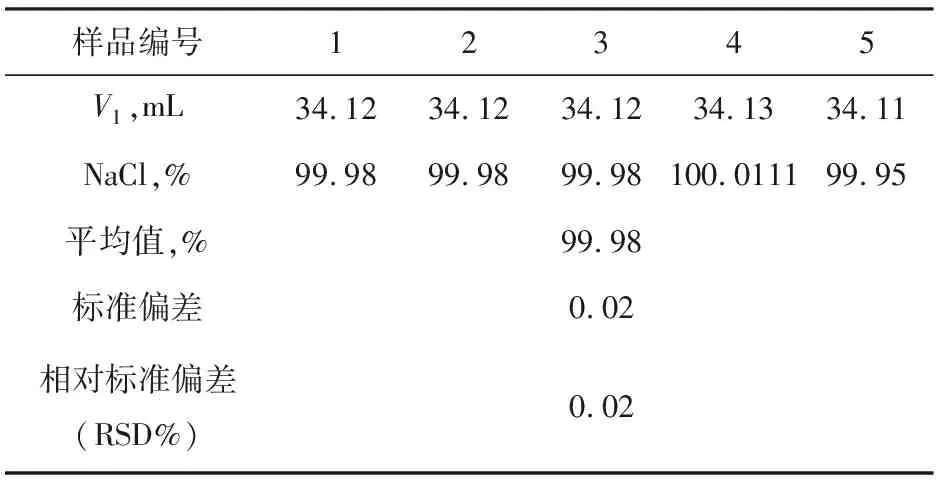
表2 電位滴定法測定NaCl結果
3.1.3 試驗結果對比
如表1與表2所示,通過用莫爾法與電位滴定法測定氯化鈉標準物質含量,并計算兩種方法測定結果的標準偏差與相對標準偏差,從數據顯示來看,電位滴定法的標準偏差與相對標準偏差明顯小于莫爾法的標準偏差與相對標準偏差。此結果說明由于莫爾法的終點不易觀察,其重現性較差,而電位滴定法是靠電極電位的突躍指示滴定終點,不受指示劑、人為等因素的干擾,因此其重現性非常好。
3.2 加標回收率試驗
加標回收率試驗是用來檢驗某一分析方法的可靠性,用加標準溶液的一份樣品所得結果減去未加標準溶液一份樣品所得結果,其差值與同加入標準溶液的理論值之比為樣品加標回收率的值。對于含量1%以上的組分,回收率應在99%以上,則說明所用方法可靠,為此采用兩種方法進行試驗比較。
3.2.1 莫爾法
1)移取5份第2節1)中樣品溶液,操作步驟同第3.1.1節,記錄消耗標液體積V1mL。
2)移取5份第2節1)中樣品溶液(5.00 mL)于250 mL錐形瓶中,依次加入第2節2)中NaCl標準物質溶液0.50 mL、0.75 mL、1.00 mL、1.50 mL、2.00 mL,加入3~5滴K2CrO4指示劑,用0.1004 mol/L AgNO3標準溶液進行滴定,記錄消耗標液體積V2mL。
根據試驗數據計算加標回收率,公式如下:
×100
式中:V1——樣品溶液消耗AgNO3標準溶液體積,mL;
V2——樣品溶液加入NaCl標準物質溶液后,消耗AgNO3標準溶液體積,mL;
V3——加入NaCl標準物質溶液的體積,mL;
f——標準溶液溫度校正系數(此處溫度為20 ℃,f=1.0000);
m——氯化鈉標準物質質量(此處m=20.0000 g);
99.96%——NaCl標準物質定值;
VD——滴定管補正值(-0.02 mL)。

表3 莫爾法加標回收率
3.2.2 電位滴定法
1)移取5份第2節1)中樣品溶液,操作步驟同第3.1.2節,記錄消耗標液體積V1mL。
2)移取5份第2節1)中樣品溶液(5.00 mL)于250 mL滴定杯中,依次加入第2節2)中NaCl標準物質溶液0.50 mL、0.75 mL、1.00 mL、1.50 mL、2.00 mL,加入10 mL淀粉指示劑,加入70 mL蒸餾水,使用瑞士萬通855型自動電位滴定儀,用0.1004 mol/L AgNO3標準溶液進行滴定,記錄消耗標液體積V2mL。
加標回收率公式同第3.2.1節,其中VD為電位滴定法中測定的空白值(-0.04 mL)。
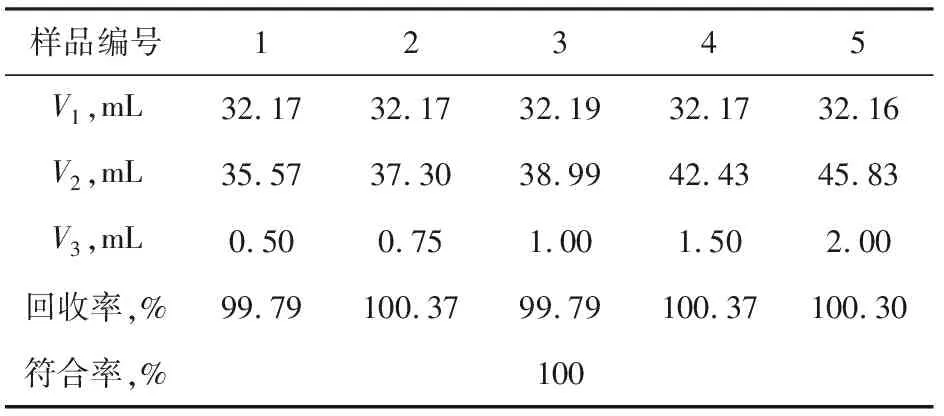
表4 電位滴定法加標回收率
3.2.3 試驗結果對比
如表3與表4所示,莫爾法加標回收符合率只有80%,而電位滴定法加標回收符合率達到100%,明顯優于莫爾法,由此說明自動電位滴定法更加可靠。
4 試驗時間
試驗時間的長短是工作效率最直觀的體現,電位滴定法與莫爾法進行對比,在用時方面具體數據如表5所示。
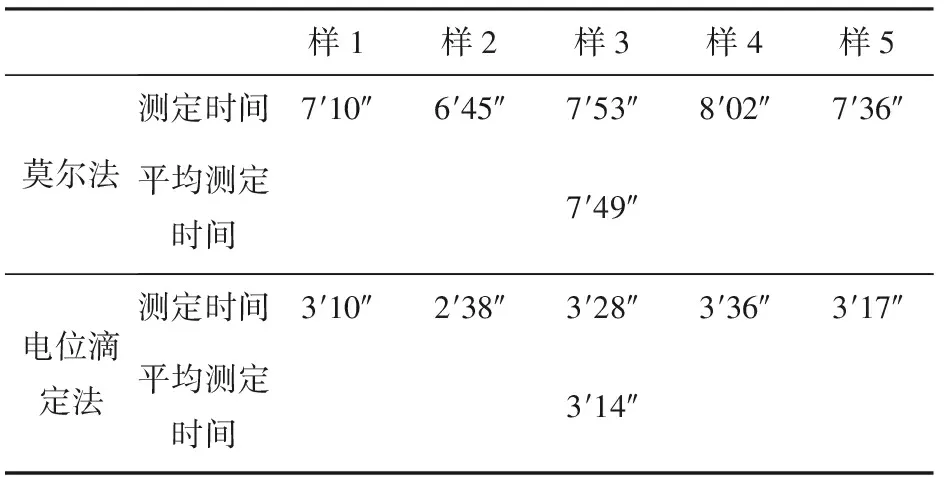
表5 電位滴定法與莫爾法試驗時間對比
注:7′10″為7分10秒。
由于莫爾法采用人工進行滴定,因此滴定速度不宜過快,要求每秒控制在3~5滴,分析時間較長;而電位滴定法采用儀器進行滴定,且瑞士萬通855全自動電位滴定儀具有標準溶液預加功能,在滴定時間上更加具有優勢,并且通過采用全自動進樣器與電位滴定儀聯合使用,可實現連續測定多個樣品,大大提高了工作效率。
5 結 論
通過試驗數據對比顯示,莫爾法和自動電位滴定法均能滿足原鹽中Cl-含量的測定。但從兩種試驗數據對比中發現,自動電位滴定法明顯優于莫爾法。采用莫爾法進行分析對檢驗人員的素質要求較高,除須掌握滴定分析的基本操作外,在終點的判斷上也要有豐富的經驗。而自動電位滴定法的應用則消除了這一弊端,整個試驗過程自動化程度高,方法可靠性高,分析結果準確度高,順應了科技發展要求,目前此方法已有效地應用于原鹽Cl-含量的測定,并取得良好效果。

