谷子對黑粉菌侵染的生物學響應
閆志鵬,儀慧蘭,張艾英,郭二虎
(1.山西大學生命科學學院,山西太原030006;2.山西省農業科學院谷子研究所,山西長治046011)
谷子(Setaria italica(L.)Beauv.),屬禾本科,又稱稷或粟,最早起源于我國,在我國有8 000 多年的種植歷史。由于其具有耐旱、耐瘠、抗逆性強、適應性廣等生物學特性,在我國北方的干旱和半干旱地區廣泛種植[1]。近年來,谷子種植面積不斷增大,各類病害的發生率也隨之增大,對其產量和品質造成嚴重影響[2]。其中,谷子黑穗病是谷子生產中的一種常見病害,按照發病特征分為粒黑穗病、腥黑穗病和黑粉病3 種類型,山西產區內谷子粒黑穗病占絕大部分[3]。谷子粒黑穗病由真菌性病原菌——黑粉菌引發,主要通過種子傳播[4],傳播的主要途徑為:谷子采收過程中病原菌污染種子,次年播種時隨著種子進入谷田并同時萌發,從而侵入幼苗,在植株體內生長蔓延,最終侵入子房,產生孢子,形成黑穗[5]。
在遭遇病原菌時,植物可依靠自身固有的免疫系統和誘導抗性抵御病原菌侵染。植物能產生多種抗菌物質,病原菌可誘導植物細胞活性氧爆發,介導苯丙烷合成途徑產生較多的類黃酮、木質素、總酚等,使抗氧化酶和病程相關蛋白(PR)表達增強、抗病相關酶(幾丁質酶和β-1,3-葡聚糖酶)活性提高,植株獲得系統抗性。有研究表明,谷子感染黑粉菌后,抗病品種體內超氧化物歧化酶(SOD)、過氧化物酶(POD)、多酚氧化酶(PPO)活性都顯著高于感病品種,表明這些酶活性的增強有助于谷子對黑粉菌的防御[6]。不同品種谷子的遺傳基礎不同,對黑穗病的抗性存在一定差異。但目前關于谷子抗黑穗病的作用機制尚不清楚。
本研究在篩選谷子黑穗病高抗品種冀谷20 和敏感品種長農35 的基礎上,對植株抗病生理過程中次生代謝途徑及其產物量、抗病酶活性及抗病相關基因轉錄進行分析,以期為谷子抗病機制的研究和抗性育種提供試驗依據。
1 材料和方法
1.1 試驗材料
連續3 a 田間試驗統計不同谷子品種黑穗病發病率,參照溫琪汾等[7]關于谷子黑穗病抗性水平分級標準,選出對黑粉菌抗性水平差異較大的2 個品種(表1)[8]作為室內試驗供試品種。供試黑粉菌菌種為2017 年采集于試驗田中發病植株的黑穗病菌冬孢子,經揉搓、過篩得到[8]。
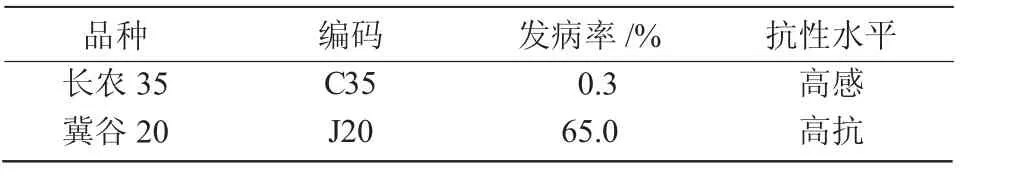
表1 供試谷子品種的發病率及抗性水平
1.2 試驗方法
試驗設對照組谷種(CK-J20、CK-C35)未拌菌,拌菌組谷種(I-J20、I-C35)人工拌黑粉菌,對照組與拌菌組同期播種于育苗盆中,于室內(25±2.0)℃培養,相對濕度47%~63%,光照強度≥3 000 lx,光照/黑暗周期為16 h/8 h。待谷子生長至五葉期,取植株地上部分檢測苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、β-1,3-葡聚糖酶和幾丁質酶活性,以及總酚、類黃酮和木質素含量。
1.3 測定項目及方法
1.3.1 酶活性檢測 取拌菌組與對照組植株地上部分用于酶活測定。PAL 活性參考ROMERO 等[9]的方法進行測定;PPO 活性采用鄰苯二酚比色法進行測定;幾丁質酶活性參考BOLLER 等[10]的方法進行測定;β-1,3-葡聚糖酶活性參考JIANG 等[11]的方法進行測定。
1.3.2 次生代謝產物含量測定 采用Folin 酚法測定總酚含量,總酚的量用每克樣品含有的焦性沒食子酸毫克數(mg/g)表示。采用NaNO2-AlCl3-NaOH比色法測定類黃酮含量,其含量用每克樣品中的蘆丁毫克數表示。參照CHEN 等[12]的方法提取和測定木質素的含量,木質素的量用每克樣品在280 nm處的吸光度表示。
1.3.3 基因表達水平檢測 通過RT-PCR 檢測抗性相關基因(4CL、CCR、CHIB 和WRKY22)與受體蛋白FLS2 的表達水平。以J20 為試驗材料,采用Trizol 法提取總RNA;根據反轉錄試劑盒說明,將2 μg 總RNA 用Oligo(dT18)引物和反轉錄酶混合物轉錄合成cDNA;以cDNA 為模板,谷子Actin 基因作為內參,使用表2 中的基因特異性引物進行PCR擴增。

表2 RT-PCR 引物序列
1.4 數據分析
試驗取每組3 次重復的平均值作為該組的檢測值,使用IBM SPSS 24.0 軟件進行ANOVA 單因素方差分析,并采用Duncan's 新復極差法進行多重比較。
2 結果與分析
2.1 黑粉菌對谷子幼苗次生代謝的影響
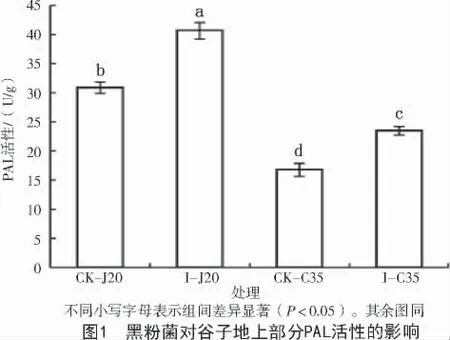
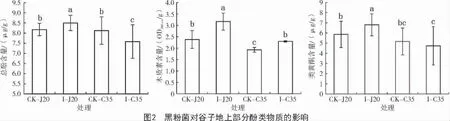
采用室內盆栽試驗,分析高抗品種J20 和高感品種C35 的抗病生理過程,發現谷種拌菌后2 個品種谷子植株地上部分PAL 活性均顯著提高,但是抗病品種J20 的PAL 活性水平顯著高于C35(圖1)。拌菌組與對照組相比,不同抗性品種的酚類物質含量變化趨勢不同,其中,I-J20 的酚類物質含量較CK-J20 顯著升高,而I-C35 總酚含量下降,類黃酮含量保持不變;I-J20 的總酚、類黃酮和木質素含量均顯著高于I-C35(圖2)。結果顯示,谷子在受到黑粉菌侵染后,品種抗性越強,PAL 酶活性增幅越大,酚類物質含量積累越多,由此表明,谷子對黑粉菌的抗性與植株次生代謝途徑激活和產物量積累有關。
2.2 黑粉菌對谷子幼苗PPO 活性的影響
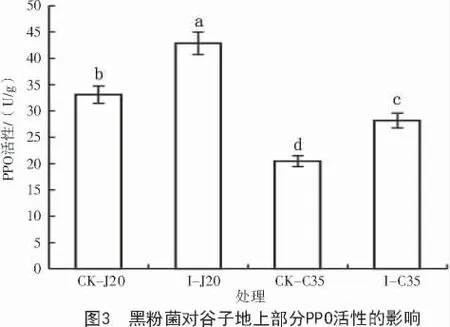
多酚氧化酶活性檢測結果顯示,谷種拌菌組2 個品種的酶活均顯著高于對照組,且I-J20 酶活性比I-C35 整體偏高(圖3),表明谷子幼苗PPO 活性的增加與品種的抗病性和黑粉菌的誘導都有關,谷子PPO 活性增加有利于增強谷子幼苗對黑粉菌的抵抗作用。
2.3 黑粉菌對谷子幼苗抗病相關酶活性的影響
2 個不同抗性品種的谷子,在谷種拌菌后幾丁質酶活性均顯著升高,但不同品種間酶活性無顯著差異;谷種拌菌組β-1,3-葡聚糖酶活性與未拌菌對照組間無顯著性差異,但I-J20 的β-1,3-葡聚糖酶活性顯著高于I-C35(圖4)。結果表明,谷子幼苗幾丁質酶活性與品種的不同抗性沒有直接對應關系,C35 的β-1,3-葡聚糖酶對黑粉菌不敏感,可能與植株對病菌的敏感性有一定關系。

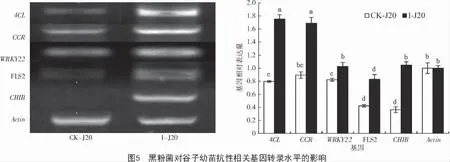
2.4 黑粉菌對谷子幼苗抗性相關基因轉錄水平的影響
基因轉錄分析結果表明,拌菌組中谷子的4 個抗性相關基因(4CL、CCR、WRKY22 和CHIB)和受體蛋白FLS2 都不同程度地轉錄上調(圖5),其中,CHIB 和4CL 分別上調188%和120%,FLS2、CCR和WRKY22 的上調幅度分別為97%,89%和25%。結果表明,以上基因及受體蛋白在谷子抗黑穗病的生理過程中發揮了重要作用。
3 討論
病原菌侵入植物后,受病原菌影響,植物體內多種酶類、氧化還原物質和抗病相關基因等都發生了相應的變化,在生理、生化和分子水平啟動對應的防御應答使植株獲得系統抗性,抗性強弱直接決定了植物是否發病以及發病程度[13]。本研究表明,谷種拌黑粉菌后,植株出現了基因轉錄、抗病相關酶活性、次生代謝途徑及產物量的改變,說明谷子對黑粉菌的響應是一個涉及基因轉錄調控、細胞代謝過程改變的系統性生物學過程。
本研究表明,拌菌后2 個品種比較,抗病品種J20 的PAL 活性、PPO 活性以及總酚、類黃酮、木質素含量均增加,而感病品種C35 酚類物質增量不大或保持不變,總酚含量甚至呈下降趨勢。苯丙烷代謝途徑是植物次生代謝產物合成的主要途徑,其中,酚類物質是一類重要的次生代謝產物,在植物抗病過程中同時兼有抗氧化性和抗病性[14]。在病原菌—植物互作過程中,次生代謝產物可作為保護屏障防御病原物侵染,其中有些物質還可作為信號分子參與植物的抗病防御反應[15]。由此推測,感病品種C35 總酚含量下降與其對黑粉菌的抗性較弱有著直接關系,即酚類物質的大量合成有助于增強谷子對黑粉菌的抗性。參與酚類物質代謝過程的PAL和PPO 在植物抗病生理中具有重要作用,其中,PAL 通過次生代謝途徑參與調控植物抗病性化合物的生物合成過程[16];PPO 能夠將植物體內的酚類物質氧化成對病原菌有毒性作用的醌類物質,從而直接抑制病原菌在植物內的生長與擴散[17]。本研究所檢不同抗性谷子品種間PAL 和PPO 活性的顯著差異可能與其對病原菌的敏感性不同有關。前人在糜子、玉米和甘蔗[18-20]等的研究中也發現,這些作物在受到外界病原真菌侵染后,作物體內PAL、PPO和POD 等活性上升,且與品種抗性存在正相關性,證明了與本研究類似的結論。
抗病相關酶β-1,3-葡聚糖酶和幾丁質酶可通過分解病原菌細胞壁、誘導抗病相關酶促反應,促使抗病物質的累積,增強植物抗病能力。本研究中,幾丁質酶活性在拌菌組和對照組間顯著不同,但是在2 個品種間無顯著差異,沒有體現出與谷子品種抗病能力的對應關系;β-1,3-葡聚糖酶活性在敏感品種C35 拌菌組中無明顯響應,不利于植物的抗病防御。本研究結果與文獻報道的β-1,3-葡聚糖酶和幾丁質酶活性與作物品種抗病性呈正相關[18]不一致,可能與谷子品種、發育階段以及環境因素影響有關。
基因轉錄應答是植物適應環境的基礎。本研究檢測了2 個谷子抗病生理相關基因的轉錄水平,證實這些基因在拌菌組上調表達。研究顯示,將幾丁質酶基因CHIB 導入一些作物中,可使轉基因作物株系抗病性顯著增強;基因4CL 編碼4-香豆素輔酶A 連接酶,是木質素合成途徑的限速酶;基因CCR 是肉桂酰coA 還原酶(一種木質素合成酶),該酶通過調控木質素等次生代謝產物的合成參與植物抗病。本研究中,谷子拌菌組中上述基因轉錄上調,與本研究檢測的相應酶活性提高、次生代謝產物量增加相一致,是植物獲得抗性的生物學基礎。FLS2 是一類植物模式識別受體,其通過感知和識別病原菌鞭毛蛋白并啟動免疫信號傳導,隨即觸發植物先天免疫反應,在植物抗病過程中發揮重要作用。轉錄因子WRKY22 能夠對多種非生物脅迫和稻瘟病菌快速響應[21]。本研究中高抗品種J20 拌菌組與對照組間相關基因的差異轉錄,提示植株受體蛋白FLS2 對病原菌進行識別,轉錄因子WRKY22由此激活,進而調節抗病相關基因(CHIB、4CL 和CCR)的表達,以增強植株對病原物的防御應答。
綜上所述,谷子對黑粉菌的抗性與品種的遺傳基礎有關,植株基因轉錄應答、細胞生理代謝改變提供了抗病生理的物質基礎,抗病相關酶、次生代謝途徑及其產物在谷子誘導抗性中發揮了積極作用。

