抗生素環丙沙星脅迫植物乳桿菌ZLC-18應激反應的研究
,*
(1.東北農業大學乳品科學教育部重點實驗室,黑龍江哈爾濱 150030;2.黑龍江省綠色食品科學研究院,黑龍江哈爾濱 150028)
氟喹諾酮類藥物主要有諾氟沙星、環丙沙星、培氟沙星、依諾沙星和氧氟沙星等。環丙沙星人類、牲畜使用最廣泛的第三代氟喹諾酮類藥物,抗菌譜廣,對革蘭氏陰性和陽性細菌作用極強[1],Machuca等[2]發現在1.0 μg/mL的環丙沙星脅迫下,大腸桿菌會受到中度DNA損傷。不適當的劑量、不良的依從性和低質量濃度抗生素的頻繁使用,導致在人類、牲畜體內和環境中均出現了抗生素殘留的問題[3-4]。當人體攝入有抗生素殘留的食物或長期不當地服用抗生素時,其腸道菌群微生態會遭到破壞。Carman等[5]研究表明當環丙沙星劑量水平低于1.5 mg/人/d的傳統閾值ADI(每日允許攝入量)時,都會改變體外模型系統中人腸道菌群的生態學。而益生菌能夠調節人體腸道微生物群的代謝活動,改善宿主的健康,因此可以開發一類具有抵御抗生素脅迫能力、保持腸道菌群微生態平衡的益生菌制劑。
植物乳桿菌(Lactobacillusplantarum)為革蘭氏陽性菌,與動物性乳酸菌相比,具有更強的耐酸和耐膽鹽能力,且能在缺乏營養的惡劣環境下生存,所以在人體腸道存活率更高,定植能力更強[6]。植物乳桿菌的潛在益處包括保持腸道菌群、平衡調節免疫系統等[7]。靳志敏等[8]通過動物模型試驗證實了植物乳桿菌對腸道內致病菌有一定的抑制作用,能在一定程度上調節腸道內菌群平衡。鑒于其自身的益生和生物學特性,植物乳桿菌被廣泛應用于酸奶等發酵食品中,是食品工業中最通用的菌種之一,同時也存在于人體胃腸道中。抗生素殘留、極端溫度、pH、滲透壓等外界環境的脅迫,均可能影響植物乳桿菌菌體細胞的生理狀態和性質[9-10]。
近年來,國內外學者主要致力于研究致病菌在環丙沙星作用下的生理特性、抑菌特性、耐藥機制等[11-14],而對于乳酸菌則主要圍繞其耐環丙沙星的機制及耐藥基因的水平轉移進行研究[15-16]。除了陳霞等[17]探究了環丙沙星對嗜熱鏈球菌生理特性的影響之外,國內外在環丙沙星對乳酸菌脅迫應激方面的研究未見報道。
本實驗選用一株來源于人體腸道的植物乳桿菌作為目的菌株,使用一種氟喹諾酮類藥物環丙沙星對其進行主動脅迫。實驗組環丙沙星濃度的設置參照其藥代動力學性質及我國規定的環丙沙星的ADI[18],設置實驗組環丙沙星質量濃度為0.1、0.5、2.0 μg/mL,以不含環丙沙星作為空白對照,探究植物乳桿菌在環丙沙星脅迫下的應激反應,并考慮在適當劑量的環丙沙星脅迫下是否具有誘導其產品主動響應不良脅迫的能力,為開發有效腸道益生菌的制劑產品提供技術手段。
1 材料與方法
1.1 材料與儀器
植物乳桿菌(Lactobacillusplantarum)ZLC-18 保藏于東北農業大學教育部乳品科學重點實驗室;MRS液體培養基 配制方法參照《乳品微生物學實驗技術》;環丙沙星化學對照品 含量≥88.5%,購自北京博奧拓達科技有限公司;嵌二萘 純度≥99%,廣州偉伯科技有限公司;LIVE/DEAD?BacLightTM細菌活性檢測試劑盒 美國賽默飛世爾科技公司;丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脫氫酶(LDH)試劑盒 北京索萊寶科技有限公司;無水乙醇及其他試劑 均為國產分析純。
SPX-150B Ⅲ生化培養箱 天津市泰斯特儀器有限公司;Smart SpecTM plus分光光度計 美國Bio-Rad公司;5804R低溫冷凍離心機 德國Eppendorf公司;LDZX-50KBS型立式壓力蒸汽滅菌器 上海申安醫療器械廠;XH-T型渦旋振蕩器 金壇市醫療儀器廠;JY98-IIIN超聲破碎儀 寧波新芝生物科技股份有限公司;EVOS FL Auto 2智能全自動熒光顯微成像系統 美國賽默飛世爾科技公司;RF-5301PC熒光分光光度計 日本島津公司;SU-8010場發射掃描電子顯微鏡 日本日立公司。
1.2 實驗方法
1.2.1 菌種的活化與培養 將保存于-20 ℃的植物乳桿菌甘油凍存管取出,在室溫中融化后按2%的接種量接入MRS液體培養基中,37 ℃培養12 h,傳代2~3次,保證菌液中活菌數達1×109CFU/mL。
1.2.2 環丙沙脅迫下植物乳桿菌的存活率測定 收集對數生長末期的植物乳桿菌菌體,細胞經無菌PBS(0.2 moL/L,pH7.2~7.4)洗滌兩次后,分別重懸于等體積且含不同質量濃度環丙沙星(0.1、0.5、2.0 μg/mL,以不含環丙沙星作對照)的MRS培養基中,脅迫處理0~4 h。脅迫后的菌懸液經生理鹽水洗滌兩次后重懸于等體積生理鹽水中,稀釋不同梯度后于MRS固體培養基上進行涂布。37 ℃培養48 h后計數。進行三次重復試驗,每次試驗三個平行樣品。存活率按以下公式計算[19]。
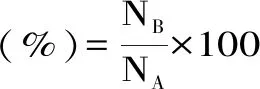
式中:NA為t小時未添加環丙沙星的活菌數;NB為環丙沙星脅迫處理t小時下的活菌數。
1.2.3 環丙沙星脅迫處理實驗 離心(4000 r/min,10 min)收集生長至對數末期的植物乳桿菌菌體,用PBS清洗兩次并重懸于等體積且含不同質量濃度環丙沙星(0.1、0.5、2.0 μg/mL,以不含環丙沙星作對照)的MRS液體培養基中,脅迫處理4 h,調至OD600=0.8,PBS清洗兩次后,重懸于等體積PBS溶液中,混勻后得到菌懸液,作為待測樣。
1.2.4 環丙沙星脅迫下植物乳桿菌細胞膜完整性的測定 使用The LIVE/DEAD BacLight Bacterial Viability Kits測定菌體細胞膜完整性。將一個A組份移液管(SYTO 9染料)和一個B組份移液管(PI染料)的內容物共同溶解于5 mL滅菌的去離子水中,即為LIVE/DEAD BacLight染色試劑混合物的2×儲備溶液。將2×儲備溶液的樣品與等體積1.2.3制備得到的待測樣混合。室溫下充分混合并在黑暗條件下孵育15 min。在載玻片和18 mm方蓋玻片之間滴加5 μL染色的細菌懸浮液,于熒光顯微鏡下觀察[20]。
1.2.5 環丙沙星脅迫下植物乳桿菌細胞膜流動性的測定 細胞膜側向擴散速率按照Aricha等[21]的方法進行,1.2.3制備得到的待測樣取20 mL,用0.25%(V/V)的甲醛在37 ℃下固定30 min,菌體用0.2 mol/L的磷酸緩沖液(pH7.4,含0.25%甲醛)離心洗滌兩次。菌體細胞于37 ℃下,用0.1~0.5 μmol/L嵌二萘標記40 min后,用熒光分光光度計測定其熒光強度。激發波長為335 nm,發射波長為373 nm(單體)和470 nm(二聚體),狹縫均為5 nm。根據熒光探針濃度和470 nm波長處熒光強度和373 nm波長處熒光強度的比值作圖,斜率即為側向擴散速率Ka。
1.2.6 環丙沙星脅迫對植物乳桿菌菌體形態的掃描電鏡觀察 將不同濃度環丙沙星脅迫處理4 h后的菌液,于4 ℃條件下、4000 r/min離心10 min,棄去上清液,收集菌體沉淀。將收集好的菌體沉淀置于4 ℃冰箱中并用2.5%的戊二醛(pH6.8)固定1.5 h以上,經0.1 moL/L磷酸鹽緩沖液(pH6.8)沖洗三次后,分別用濃度為50%、70%、90%的乙醇脫水處理10 min,再用100%乙醇和叔丁醇混合液(1∶1)、純叔丁醇分別置換15 min,然后將樣品放入-20 ℃冰箱冷凍30 min,接著放入ES-2030(HITACHI)型冷凍干燥儀干燥4 h。最后經粘樣、鍍膜后,將處理好的樣品放入樣品盒中待檢,在場發射掃描電鏡下,觀察環丙沙星脅迫前后菌體形態的變化[22]。
1.2.7 環丙沙星脅迫對丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脫氫酶(LDH)活性的影響研究
1.2.7.1 環丙沙星反復脅迫處理實驗 用0.5 μg/mL環丙沙星反復脅迫植物乳桿菌三次,脅迫方法同1.2.3。之后收集生長至對數末期的植物乳桿菌菌體,用PBS清洗兩次后,重懸于含0.5 μg/mL環丙沙星的MRS液體培養基中,脅迫處理4 h,調至OD600=0.8,PBS清洗兩次后重懸于等體積PBS溶液,混勻后得到菌懸液,作為待測樣。
1.2.7.2 相關酶活性的測定 將1.2.3及1.2.7.1制備得到的待測樣收集至離心管內,4 ℃、8000 r/min離心10 min后棄上清,調整細胞濃度為5×106CFU/mL,加入1 mL提取液,在冰浴條件下超聲波破碎細胞(功率20%,超聲3 s,間隔10 s,重復30次),4 ℃、8000 r/min離心10 min,取上清,置冰上用于相關酶活的測定,其中從1.2.3制備的待測樣中提取的上清液用于丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脫氫酶(LDH)的測定,從1.2.7.1制備的待測樣中提取的上清液僅用于乳酸脫氫酶(LDH)的測定。參照考馬斯亮藍染色法測定蛋白質濃度[23]。丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脫氫酶(LDH)的測定均使用北京索萊寶科技有限公司提供的相應試劑盒測定。
1.3 數據統計分析
采用Origin 8.0軟件作圖。所有試驗重復三次,在SPSS 21.0里用One Way ANOVA進行數據方差的顯著性差異分析,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果與分析
2.1 環丙沙星脅迫下植物乳桿菌的存活率
根據環丙沙星的藥代動力學性質及我國規定的環丙沙星的ADI,本文實驗組設置環丙沙星的質量濃度為0.1、0.5、2.0 μg/mL,這三個濃度涵蓋了我國規定的環丙沙星的ADI可能到達人體結腸的量[24],所以選擇上述濃度進行植物乳桿菌存活率測定實驗。結果如圖1所示,植物乳桿菌在不同濃度環丙沙星脅迫處理0~4 h期間,存活率整體呈下降趨勢。0.1 μg/mL環丙沙星脅迫下,在0~2 h期間,菌體存活率下降幅度較大,而2~4 h間菌體存活率下降趨勢逐漸趨于緩和,4 h時菌體存活率為62.14%;經0.5 μg/mL環丙沙星脅迫處理2 h時,與0.1 μg/mL環丙沙星脅迫相比,菌體存活率大幅度下降,2 h時其存活率下降了42.76%,2~4 h間菌體存活率下降幅度不大,4 h時菌體存活率為50.65%;經2.0 μg/mL環丙沙星脅迫1 h時,菌體存活率就下降了45.21%,表明高劑量組環丙沙星脅迫下,能迅速啟動菌體細胞死亡,菌體生長受到了明顯的抑制作用,在1~4 h間,菌體存活率小幅度下降后最終趨于平緩,4 h時菌體存活率僅為40.21%。同時可以看出,環丙沙星濃度增大,菌體存活率降低,即環丙沙星濃度越大,其對菌體的抑制作用越明顯。
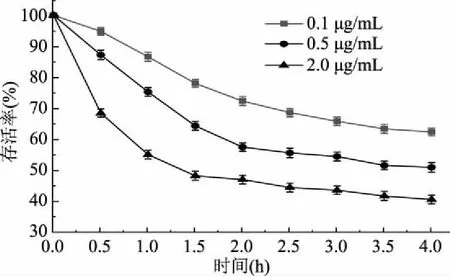
圖1 環丙沙星脅迫下植物乳桿菌的存活率Fig.1 Survival rate of Lactobacillus plantarumin the presence of ciprofloxacin
環丙沙星脅迫植物乳桿菌期間表現出對菌體高效的抑制作用。環丙沙星在細菌細胞中具有2種酶靶標—DNA促旋酶和拓撲異構酶IV,其通過細胞膜進入菌體細胞后,通過干擾促旋酶和拓撲異構酶,誘導雙鏈斷裂,抑制DNA的再連接,誘導DNA損傷,最終啟動了菌體細胞的死亡[25]。盡管環丙沙星是有效的殺菌抗生素,但它達不到完全滅菌作用。一部分植物乳桿菌因環丙沙星迅速死亡,但仍有一部分未死亡[26]。Smith等[27]研究了0~2.0 μg/mL環丙沙星對金黃色葡萄球菌的殺菌作用,發現隨著環丙沙星濃度增大,金黃色葡萄球菌活菌數下降。這與本文中植物乳桿菌在不同濃度環丙沙星脅迫下存活率的變化基本吻合。
2.2 環丙沙星脅迫對植物乳桿菌細胞膜完整性的影響
細胞膜在細胞生長、代謝、能量傳導和維持恒定的細胞內環境中發揮著重要作用。然而,它也是環境脅迫引起損害的主要目標。盡管脅迫條件導致膜脂質的組織、動態結構和功能發生變化,但是細胞質膜的完整性和有效性是維持細胞活力及其代謝活動的關鍵因素[28]。環丙沙星脅迫會改變菌體細胞壁結構中的脂質層和肽聚糖的含量,并破壞其結構,從而使環丙沙星進入細胞壁,進一步作用于菌體細胞膜[29]。
The LIVE/DEAD BacLight Bacterial Viability Kits可用于監測以細胞膜完整性為基礎的菌群活性。被認為已死或將死的、細胞膜受損的細胞會染成紅色,而細胞膜完好的細胞會染成綠色。環丙沙星脅迫處理對植物乳桿菌細胞膜完整性的影響結果如圖2所示。結果表明:對照組(圖2A)在觀察視野里幾乎全表現為綠色熒光,即對照組的細胞膜均保持完整,幾乎未受到破壞;經質量濃度為0.1 μg/mL的環丙沙星處理4 h后的植物乳桿菌(圖2B)在觀察視野里有少數表現為紅色熒光,大部分表現為綠色熒光,說明0.1 μg/mL的環丙沙星處理4 h時,對植物乳桿菌細胞膜有一定的破壞,但是破壞程度較小;經質量濃度為0.5 μg/mL的環丙沙星處理4 h后的植物乳桿菌(圖2C)在觀察視野里幾乎一半呈現紅色熒光,而另一半呈現綠色熒光,說明0.5 μg/mL的環丙沙星處理4 h時,對植物乳桿菌細胞膜的破壞程度較大;而經2.0 μg/mL的環丙沙星處理4 h后的植物乳桿菌(圖2D)在觀察視野里大部分表現為紅色熒光,而僅有少部分表現為綠色熒光,說明2.0 μg/mL的環丙沙星處理4 h時對菌體細胞膜的完整性影響程度較其它濃度而言更為嚴重,即菌體細胞膜在2.0 μg/mL的環丙沙星處理4 h時受到了程度比較大的破壞。這一結果與脅迫處理后菌體的存活率結果基本一致。環丙沙星的殺菌機理之一就是能夠破壞細菌細胞膜,使細胞內容物流失,因此,不論細菌處于增殖期還是靜止期,都能迅速降低細菌活力[30]。所以隨著環丙沙星濃度的增加,植物乳桿菌的細胞膜完整性受到的破壞程度隨之增大。

圖2 環丙沙星脅迫處理對植物乳桿菌細胞膜完整性的影響Fig.2 Effects of ciprofloxacin stress treatment on cell membrane integrity of Lactobacillus plantarum注:在EVOS FL Auto 2成像系統上使用彩色照相機和10×物鏡采集圖像;A表示未經環丙沙星處理;B表示經質量濃度為0.1 μg/mL的環丙沙星處理;C表示經質量濃度為0.5 μg/mL的環丙沙星處理;D表示經質量濃度為2.0 μg/mL的環丙沙星處理。
2.3 環丙沙星脅迫對植物乳桿菌細胞膜流動性的影響
不同濃度環丙沙星脅迫處理4 h時對植物乳桿菌細胞膜流動性的影響結果如圖3所示。膜蛋白的運動方式主要分為側向及旋轉運動,本試驗以嵌二萘為熒光探針,根據嵌二萘單體和激發態二聚體的熒光強度的比值來測定細胞膜的側向擴散速率。由圖3可以看出,當環丙沙星質量濃度為2.0 μg/mL時,菌體細胞側向擴散速率極顯著降低(P<0.01),與對照組相比降低了39.93%,細胞膜流動性極顯著性降低;而0.1、0.5 μg/mL兩組的細胞膜側向擴散速率與對照組相比,下降不顯著(P>0.05),表明細胞膜流動性下降不顯著。由于環丙沙星脅迫處理植物乳桿菌時,菌體會改變細菌細胞膜流動性來調節膜脂質的組成,從而控制膜的穩態[31-32]。Bessa等[33]研究發現,亞抑制濃度的抗生素的存在不會顯著改變金黃色葡萄球菌的膜流動性,但會略微影響大腸桿菌的膜流動性。實驗結果表明,環丙沙星能夠顯著降低植物乳桿菌細胞膜流動性,環丙沙星作為環境應激物,誘導膜流動性發生變化。細胞膜的流動性對于細胞膜功能的正常行使是至關重要的,膜流動性的改變將會引起細胞膜功能的改變,例如細胞的物質運輸、細胞識別、細胞免疫、細胞分化與信息轉導等。膜流動性下降會引起黏度增加,導致運輸功能下降,嚴重者可破壞膜結構,增大膜通透性,使內容物大量排出,引起細胞死亡。細胞膜上的酶活性與流動性也有很大關系,在一定范圍內,膜的流動性降低不利于酶分子側向擴散和旋轉運動,使酶活性降低[34]。所以,研究環丙沙星對植物乳桿菌細胞膜流動性的影響,有利于了解環丙沙星對乳桿菌細胞膜功能或細胞功能的影響。

圖3 環丙沙星脅迫處理對植物乳桿菌細胞膜流動性的影響Fig.3 Effects of ciprofloxacin stress treatment on cell membrane fluidity of Lactobacillus plantarum注:與對照組相比較,*表示差異顯著(P<0.05);**表示差異極顯著(P<0.01)。
2.4 環丙沙星脅迫下植物乳桿菌菌體形態的場發射掃描電鏡結果
將處理好的樣品放置于SU-8010場發射掃描電鏡下觀察(工作電壓10 kV),放大倍數為30000×,選取有代表性的視野,觀察結果如圖4所示。由圖4可以看出,不同濃度的環丙沙星脅迫下菌體形態差異明顯。未經環丙沙星處理過的植物乳桿菌外觀呈典型的桿狀直線型,兩端以圓弧形收尾,相互交替排列,菌體飽滿無缺陷。經質量濃度為0.1 μg/mL環丙沙星處理4 h后,菌體出現凹陷、干扁、塌縮的現象,排列雜亂,少數菌體細胞表面出現破裂,細胞內容物泄露。經0.5 μg/mL環丙沙星處理4 h后,菌體長度縮短,排列無序,細胞表面破裂的菌體數量增加。經2.0 μg/mL環丙沙星處理4 h后,植物乳桿菌細胞形態受損程度最大。菌體長度的縮短程度最大,大部分菌體表面破裂,菌體內容物外泄。試驗結果表明,環丙沙星脅迫明顯改變了植物乳桿菌的菌體形態,嚴重時可造成細胞質外泄,最終導致細胞死亡;且菌體改變和受損的程度與環丙沙星濃度呈正相關。

表1 環丙沙星脅迫對植物乳桿菌糖代謝關鍵酶活力的影響(U/mg prot)Table 1 Effect of ciprofloxacin stress on key enzyme activity of glucose metabolism of Lactobacillus plantarum(U/mg prot)
注:與對照組相比較,*表示差異顯著(P<0.05);**表示差異極顯著(P<0.01)。

圖4 環丙沙星脅迫處理下植物乳桿菌的掃描電鏡圖Fig.4 Scanning electron micrograph ofLactobacillus plantarum treated with ciprofloxacin stress注:放大倍數:30000×;圖A表示未經環丙沙星處理;圖B表示經質量濃度為0.1 μg/mL 環丙沙星處理4 h;圖C表示經質量濃度為0.5 μg/mL環丙沙星處理4 h;圖D表示經質量濃度為2.0 μg/mL環丙沙星處理4 h。
環丙沙星通過抑制細菌DNA的合成發揮其抑菌作用。環丙沙星作用下,菌體內形成旋轉酶-DNA-環丙沙星復合物,菌體復制系統受到抑制,此時細胞會觸發應激反應機制,也被稱為SOS反應[35]。Ysern等[36]已經指出,一些抗生素,例如氟喹諾酮類,可作為SOS反應的有效誘導劑,誘導細菌中的SOS反應增加菌體突變的頻率,而菌體發生突變將有利于其生存。另外,環丙沙星誘導的SOS反應可能造成細胞內物質的滲漏。有研究表明,即使環丙沙星作用的主要目標位于不影響細胞壁合成的位點,也會破壞細菌表面、改變菌體形態[37]。Elliott等[38]研究發現,大腸桿菌暴露于濃度為1~50 μg/mL的環丙沙星或諾氟沙星后,細胞壁在30 min內發生絲狀化,隨后細菌的細胞壁發生破裂。借助場發射掃描電鏡真實形象地表達植物乳桿菌在環丙沙星脅迫下菌體形態的變化,能夠為環丙沙星脅迫下植物乳桿菌的應激機理的研究提供一定的依據。
2.5 環丙沙星脅迫對植物乳桿菌糖代謝關鍵酶活性的影響
氟喹諾酮類抗生素脅迫會對微生物產生不利影響,了解菌體通過改變葡萄糖代謝酶活性對環丙沙星脅迫條件作出的應激反應是有必要的。由表1可以看出,就己糖激酶而言,2.0 μg/mL環丙沙星處理4 h后,酶活極顯著下降(P<0.01),為(3.29±0.63) U,而0.1、0.5 μg/mL兩組處理后,其酶活與對照組相比下降程度不顯著(P>0.05),這一結果表明己糖激酶不是環丙沙星脅迫引起菌體應激的主要代謝酶。
與對照組相比,植物乳桿菌在0.1、0.5、2.0 μg/mL的環丙沙星脅迫4 h后,丙酮酸激酶活力均極顯著下降P<0.01),表明環丙沙星脅迫4 h后對丙酮酸激酶活力影響效果極顯著(P<0.01),且酶活力下降程度與環丙沙星濃度呈正相關,活力分別下降了24.78%、36.56%、48.46%,這一結果說明丙酮酸激酶是環丙沙星脅迫下菌體產生應激的關鍵代謝酶。己糖激酶和丙酮酸激酶作為菌體糖酵解中催化不可逆反應的關鍵酶,其活性受細胞能荷調節。環丙沙星脅迫下會使菌體細胞內產生應激反應,可能使得胞內能荷升高,從而抑制己糖激酶和丙酮酸激酶的活性[39];環丙沙星脅迫可能造成的胞內丙酮酸激酶磷酸化也可能是丙酮酸激酶活性下降的另一種原因[40]。
對照組中乳酸脫氫酶酶活約為(0.069±0.002) U,在0.1 μg/mL環丙沙星處理4 h后,酶活下降不顯著(P>0.05),說明低劑量組環丙沙星對菌體乳酸脫氫酶影響不大,該酶在低劑量環丙沙星脅迫下處于穩定狀態;在2.0 μg/mL環丙沙星處理4 h后,酶活下降極顯著(P<0.01),降低了約53.62%,說明高劑量組環丙沙星對植物乳桿菌乳糖代謝具有抑制作用;而加入0.5 μg/mL環丙沙星脅迫4 h后,乳酸脫氫酶活力反而增加,酶活為(0.081±0.006) U/mg prot(P<0.01),說明中劑量組環丙沙星會對菌體產生相應的脅迫應激。進一步用0.5 μg/mL環丙沙星反復脅迫菌體,菌體乳酸脫氫酶的酶活為(0.126±0.004) U/mg prot(表2),影響極顯著(P<0.01)。在環丙沙星脅迫下,菌體可能通過調節自身中mRNA降解、基因表達、葡萄糖轉運和代謝水平來影響參與葡萄糖代謝的酶[41-42],誘導植物乳桿菌乳酸脫氫酶酶活力增大。

表2 0.5 μg/mL環丙沙星反復脅迫對植物乳桿菌乳酸脫氫酶活力的影響(U/mg prot)Table 2 Effects of repeated stress of 0.5 μg/mL ciprofloxacin on the activity of lactate dehydrogenase in Lactobacillus plantarum(U/mg prot)
注:與未經反復脅迫組相比較,*表示差異顯著(P<0.05);**表示差異極顯著(P<0.01)。
環丙沙星脅迫下菌體糖代謝關鍵酶活力下降,使得菌體對葡萄糖利用率降低,造成菌體有氧代謝受到抑制,進而改變糖代謝和能量通量,同時改變菌體的生長速率,使碳源代謝適應新環境[43];從另一個角度而言,環丙沙星脅迫造成細胞膜完整性受損,可能造成位于胞液中的己糖激酶、丙酮酸激酶及乳酸脫氫酶泄露,導致其酶活力發生變化[44]。上述結果為深入研究環丙沙星脅迫下菌體糖代謝關鍵酶的變化情況提供了重要參考,也為乳酸菌在環丙沙星脅迫下的代謝機制的研究提供了思路。
3 結論
氟喹諾酮類藥物環丙沙星會嚴重破壞菌體生長,隨著其質量濃度增大,菌體存活率依次降低,經質量濃度為2.0 μg/mL的環丙沙星脅迫后乳桿菌存活率僅為40.21%,活菌數量劇減將使菌體群體反應效應減弱,直接影響菌體定植以及發揮相應的益生功能;環丙沙星脅迫可改變植物乳桿菌細胞結構,破壞細胞膜完整性,降低細胞膜流動性,阻滯細胞代謝;通過測定不同質量濃度環丙沙星脅迫后菌體葡萄糖代謝關鍵酶活,發現菌體主能量代謝路徑中的己糖激酶、丙酮酸激酶均出現不同程度的下降,而只有乳酸脫氫酶在質量濃度為0.5 μg/mL的環丙沙星脅迫下酶活力升高,反復用質量濃度為0.5 μg/mL的環丙沙星脅迫植物乳桿菌后,發現菌體乳酸脫氫酶酶活不降反升,究其原因為植物乳桿菌經該濃度環丙沙星主動脅迫后,為增加能量代謝維持菌體存活,會產生應激,通過自身調節,誘導植物乳桿菌乳酸脫氫酶酶活力增大以保護菌體。本研究選取的氟喹諾酮類藥物環丙沙星濃度涵蓋了我國規定的環丙沙星的ADI可能到達人體結腸的量,同時實驗菌株為來源于人腸道的植物乳桿菌,因此,本文研究結果有助于腸道益生菌制劑的研發,在緩解抗生素脅迫引起的腸道應激方面具有實踐及應用價值。

