紫花苜蓿MsMBF1c基因在擬南芥中表達提高轉基因植株的耐熱性
李小冬,尚以順,武語迪 ,王學敏,熊先勤,陳光吉,孫方,張文,蔡一鳴
(1.貴州省農業科學院草業研究所, 貴州 貴陽 550006;2.貴州鼎芯農牧科技有限責任公司,貴州 貴陽 550006;3.中國農業科學院北京畜牧獸醫研究所,北京 100000)
熱害是影響植物生長發育的主要環境脅迫因素之一,這種危害對冷季型植物危害更大。植物耐熱性由復雜而精細的基因調控網絡控制,通過一系列基因表達變化,可以使植物應對一定范圍內的溫度升高而存活[1]。紫花苜蓿(Medicagosativa)是典型的冷季型牧草作物,也是草畜產業發展的核心牧草品種之一。南方季節性與區域性高溫等氣候因素限制了紫花苜蓿在長江以南的地區的推廣,研究紫花苜蓿耐熱調控關鍵基因功能對培育南方對適應性強的耐高溫紫花苜蓿品種有一定的指導意義。
前人也針對紫花苜蓿耐熱性從表型、生理等角度開展了相關研究。在溫控條件下,高溫脅迫使紫花苜蓿生長受到抑制,植株產量降低54%,葉片葉面積縮小至常溫的1/4,但葉片厚度增加了54%,高溫是生產中紫花苜蓿夏季減產的一個重要原因[2]。斯達等[3]研究高溫期非秋眠紫花苜蓿的生長狀態以及高溫期刈割對紫花苜蓿再生產量及品質的影響,發現刈割時期對紫花苜蓿品質的影響要大于品種間的差異。邵辰光等[4]與趙雁等[5]分別以高秋眠級耐熱型‘賽迪10’和低秋眠級熱敏型‘阿爾岡金’為對照,分析南方紫花苜蓿品種‘德欽’在高溫脅迫后葉片內植物激素和多胺等含量的變化,發現紫花苜蓿耐熱性與脫落酸、吲哚乙酸以及亞精胺等含量呈正相關,而與赤霉酸、腐胺和精胺含量呈負相關。
盡管對紫花苜蓿耐熱表型和生理已有較多研究,然而對其耐熱的分子基礎研究還比較少,主要集中在熱激轉錄因子(heat stress transcription factor, HSF)和熱激蛋白(heat stress protein, HSP)。如通過轉基因研究的方法,過量表達紫花苜蓿MsHSP23基因增強了匍匐剪股穎(Agrostisstolonifera)的耐熱性[6]。高通量分析的方法在紫花苜蓿中也被廣泛應用,將紫花苜蓿、大豆(Glycinemax)和百脈根(Lotusjaponicus)的已知基因組信息與擬南芥(Arabidopsisthaliana)比對分別發現了21、25和19個HSF基因,并且其中70%的HSF候選基因都與非生物脅迫相關[7]。在紫花苜蓿葉片中,通過差減雜交法篩選到10個受溫度(高溫/低溫)誘導表達的基因[8]。
在模式植物擬南芥中,已經對植物的耐熱機制進行了系統的研究,鑒定了許多耐熱調節的關鍵基因,并建立了一個以HSF為核心的耐熱調控模型[9]。HSF通過結合熱激元件(heat stress element,HSE)激活高溫應答基因的表達,是植物耐熱調節的主要途徑。在擬南芥中,HSFA1、HSFA2、HSFA3、HSFA7a和HSFB等熱激轉錄因子能調節植物的耐熱性,而且許多HSPs與其他抗熱相關基因受到這些基因調節。最近的研究發現除了HSF-HSP核心途徑外,植物的抗熱性還存在其他的調控樞紐,而MBF1s家族基因就是其中之一。在動物[10-11]、真菌[12-13]中,MBF家族基因廣泛參與多種生物和非生物脅迫反應。擬南芥MBF1c基因顯著受熱誘導,mbf1c突變體對高溫敏感[14],而且AtMBF1能夠互補酵母(Saccharomycescerevisiae)mbf1突變體熱敏感表型[15]。在小麥(Triticumaestivum)中,TaMBF1c的表達顯著受高溫誘導,過量表達TaMBF1c能顯著提高酵母和水稻(Oryzasativa)的耐熱性[16]。MBF家族基因在兩個不同葡萄(Vitisvinifera)品種中均受高溫與干旱脅迫誘導[17]。分析耐熱性存在顯著差異的兩個剪股穎草的轉錄組發現MBF1c基因顯著被熱誘導[18]。然而在紫花苜蓿中,MBF1c家族基因還沒有被深入研究。
本研究從紫花苜蓿“中苜1號”cDNA中克隆了MsMBF1c基因,其蛋白與擬南芥AtMBF1c蛋白同源相似性高達72%,參照動植物中MBF1家族基因已有研究成果,該基因可能是一個紫花苜蓿逆境脅迫調控的核心基因,需要進一步研究其功能和調控機理。本研究分析了MsMBF1c基因在紫花苜蓿不同組織,以及在高溫、干旱和高溫與干旱組合等逆境脅迫下的表達模式。通過平行比較擬南芥MsMBF1c過量表達株系、mbf1c突變體、互補株系、以及野生型植株在種子萌發和幼苗生長階段的耐熱性,考察MsMBF1c在植物抗熱反應過程中的功能,并從基因調控網絡等角度對其功能進行了初步鑒定與研究,為進一步剖析MsMBF1c基因在高溫脅迫下的分子作用機制提供有價值的參考,并為紫花苜蓿分子遺傳改良及轉基因新品種的培育提供重要的基因資源。
1 材料與方法
1.1 材料
紫花苜蓿品種“中苜1號”由中國農業科學院北京畜牧獸醫研究所高洪文研究室饋贈,擬南芥哥倫比亞型野生型(wild type Col-0, 以下簡稱WT)和Atmbf1cT-DNA突變體(編號:SALK_083813C,以下簡稱MUT)從擬南芥生物資源中心(Arabidopsisbiological resource center, ABRC)購買。在人工氣候室中種植擬南芥與紫花苜蓿,其生長條件參考Li等[19]的方法,具體參數如下:溫度為22 ℃,濕度為60%,光照強度為230~300 μE·m-2·s-1,光周期為16 h光照/ 8 h黑暗,試驗時間為2014-2017年。
1.2 方法
1.2.1RNA提取與反轉錄 植物總RNA采用TRIZOLTMKit RNA提取試劑(Invitrogen,USA)進行提取[20],擬南芥取7 d的幼苗(包括根),紫花苜蓿參照說明的時間和部位進行取樣,每份樣品100 mg,具體提取方法如下:用液氮研磨,加入到1 mL Trizol試劑中,上下顛倒,室溫(20~25 ℃,下同)放置10 min,加入200 μL氯仿,在渦旋振蕩儀(VORTEX -GENIE 2T,上海)上劇烈振蕩30 s,室溫放置5 min,12000 r·min-1,4 ℃,離心10 min,取500 μL上清至新離心管中,加入1 mL無水乙醇,混勻后-20 ℃放置20 min,12000 r·min-1,4 ℃,離心10 min,倒掉上清,加入1 mL預冷的 75%乙醇(用0.05% DEPC H2O按照體積比稀釋),10000 r·min-1,4 ℃,離心10 min,倒掉上清,空氣干燥15 min,加20~30 μL RNase-free H2O 50~60 ℃溶解5 min。反轉錄采用MBI公司的RevertAid H Minus First Strand cDNA Synthesis Kit (Fermentas),具體試驗流程參照試劑盒說明書。
1.2.2紫花苜蓿MsMBF1c基因的克隆、序列分析與表達載體構建 以紫花苜蓿葉片cDNA為模板,MsMBF1cF與MsMBF1cR引物組合,采用phusion DNA聚合酶擴增試劑盒(Thermo,上海)進行擴增,引物序列為,MsMBF1cF:5′-ACTCCCGGGATGTCAGGTCTAGGCCATATTTCTC-3′(SmaⅠ接頭);MsMBF1cR:5′-CTAGAGCTCTCATTTCTTGCCACGCAGTTTAG-3′(SacⅠ接頭)。反應體系為:5×high-fidelity 緩沖液,4 μL;dNTP mix,0.5 μL;MgCl2,1.5 μL;MsMBF1cF,1 μL;MsMBF1cR,1 μL;DNA模板,2 μL;DNA Polymerase,0.2 μL;dd H2O,10 μL。擴增程序為:94 ℃ 3 min,94 ℃ 30 s,72 ℃ 30 s,28個循環,72 ℃ 10 min,25 ℃ 5 min,反應結束。采用凝膠回收試劑盒(SK8131,上海生工)將擴增產物連接到pEASY-Blunt克隆載體(pEASY-Blunt Cloning Kit,Transgene),進行測序分析。MsMBF1c蛋白序列比對采用Clustal X 1.83軟件分析,并利用BioEdit軟件對比對序列進行編輯。
提取pEASY-MsMBF1c(gene)載體質粒,與pBI121載體一起,分別利用SmaⅠ與SacⅠ雙酶切,回收線性化的pBI121載體片段和MsMBF1c(gene)片段,用T4連接酶(Fermentas)連接構建pBI21-35S:MsMBF1c過量表達載體,并將該載體通過CaCl2轉化法轉化到農桿菌GV3101菌株備用。
1.2.3紫花苜蓿MsMBF1c基因的組織特異性表達與誘導表達 組織特異表達的取樣時期與部位為:根、莖、葉分別取播種后20 d的紫花苜蓿幼苗,花選取盛花期開放的花朵,果實選取開花后5~7 d的幼嫩角果。對于誘導表達材料的準備,將播種后28 d的紫花苜蓿幼苗,分成4組,第1組為對照,正常澆水,正常生長溫度;第2組為干旱處理組,在正常溫度下,持續干旱處理7 d;第3組為高溫處理組,正常的澆水條件,在40 ℃持續高溫條件下處理1 h;第4組為高溫與干旱組合處理組,持續干旱7 d,每天溫度變化,9:00 am-5:00 pm為38 ℃,5:00 pm-次日9:00 am為22 ℃,取相應處理后的葉片組織進行表達分析。RNA提取與反轉錄參考材料與方法1.2.1。MsMBF1c基因的表達采用real-time PCR的方法,采用GoTaq Real-Time PCR Systems(Promega,A6001)試劑盒,操作方法按照說明書。引物為qMsMBF1cF:5′-CAATGAGAAGCCTCAAGTGATCCA-3′,與qMsMBF1cR:5′-TGCCACGCAGTTTAGCTCCAAG-3′。內參基因為紫花苜蓿3-磷酸甘油脫氫酶(Glycerol-3 phosphate dehydrogenase,GPDH)基因,qMsGPDHF: 5′-CAAACATGGGAGCATCCTTACTAG-3′,qMsGPDHR: 5′-GTTTTTACCGACAAGGACAAAGCT-3′。SYBR熒光信號用Eppendorf replax 2儀器進行檢測,反應程序為94 ℃ 2 min,94 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,讀取熒光信號,45個循環,72 ℃ 5 min,25 ℃ 5 min。采用2-ΔΔct方法分析MsMBF1c的表達變化,每個樣品設3個生物學重復,每個生物學重復設3個技術重復。
1.2.4MsMBF1c過表達擬南芥株系以及mbf1cT-DNA突變體互補系的獲得 擬南芥的轉化采用浸花法[21],將攜帶pBI121-35S:MsMBF1c轉化基因的農桿菌用誘導培養基懸浮[5%蔗糖溶液,加0.02%的 Silwet L-77(上海生工)],將WT擬南芥的花蕾在懸浮菌液中浸泡30 s,收取T0代轉基因種子。將T0代種子用75%乙醇表面消毒1 min,用50% 84消毒液消毒3 min,用無菌水清洗3~4次,將其均勻鋪布于1/2 MS+300 mg·L-1特美汀+50 mg·L-1卡那霉素的培養基中,在人工氣候室中培養15~30 d,挑選綠色健壯的抗性植株移栽到營養土中進行繁殖,直到T3代獲得卡那抗性不分離的MsMBF1c過表達株系,即為MsMBF1c過表達擬南芥株系(ArabidopsisMsMBF1coverexpression lines,以下簡稱OE)。Atmbf1cT-DNA突變體互補系(complementary lines,以下簡稱COM)通過OE與MUT進行有性雜交的方法獲得,后代中篩選mbf1c位點純合且含有MsMBF1c過表達插入位點的株系用于表型與表達分析。
1.2.5DNA提取與轉基因擬南芥分子鑒定以及表達分析鑒定 擬南芥DNA提取采用Edwards DNA快速提取方法[21],具體如下:取100 mg新鮮葉片組織放入無菌的1.5 mL離心管中,加入400 μL抽提緩沖液[200 mmol·L-1Tris-HCl pH 7.5,250 mmol·L-1NaCl,25 mmol·L-1乙二胺四乙酸二鈉(ethylene diamine tetraacetic acid disodium salt,EDTA-2Na),0.5%十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)],室溫迅速研磨,上下顛倒離心管混勻后,靜置10 min。12000 r·min-1,室溫離心10 min,將上清轉移到800 μL預冷的無水乙醇中,-20 ℃沉淀1~2 h。12000 r·min-1,室溫離心15 min,倒掉上清,瀝干DNA。加100 μL無菌水充分溶解DNA備用。轉基因材料檢測采用新霉素磷酸轉移酶基因(neomycin phosphor transferase,NPT),引物組合為NPTF+NPTR和35S+MsMBF1cR,引物序列為NPTF:5′-GAGGCTATTCGGCTATGACTG-3′,NPTR:5′-ATCGGGAGCGGCGATACCGTA-3′,35S:5′-TCCCACTATCCTTCGCAAG-3′。mbf1cT-DNA插入檢測引物為LBp1.3:5′-ATTTTGCCGATTTCGGAAC-3′,mbf1cF:5′-ATCCAATGATAATAAGGCGGC-3′,mbf1cR:5′-TAAAACCATTGAGCCAAATCG-3′。PCR采用2×Taq PCR反應試劑盒(上海生工),并參照試劑盒說明書配制反應體系。PCR擴增程序如下:94 ℃ 3 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30個循環,72 ℃ 5 min,25 ℃ 5 min。分別取8 μL PCR產物電泳檢測。OE篩選轉基因檢測呈陽性的植株,加代收種至T3代,參照1.2.4中T0代抗性篩選的方法,選取抗性不分離的株系用于表型考察與表達分析。COM篩選MsMBF1c轉基因為陽性,同時mbf1c插入位點純合的植株用于后續分析。分析MsMBF1c與AtMBF1c在WT、MUT、3個獨立的OE株系(#1,#7,#23)與COM中表達變化,取7 d的幼苗提取RNA,反轉錄后采用熒光定量方法檢測,引物組合分別為qMsMBF1cF+qMsMBF1cR與qAtMBF1cF+qAtMBF1cR(表1),程序與方法參照1.2.1與1.2.3。
1.2.6高溫脅迫處理 參考Yu等[20]的方法,采用1.2.4表面消毒方法將WT、3個獨立的OE、MUT以及COM株系分別播種到1/2 MS培養基上,4 ℃春化3 d。高溫脅迫發芽率試驗采用浸入法:將培養皿置于45 ℃水浴鍋中熱處理4.5 h后,在人工氣候室中生長7 d后統計發芽率,對照組一直在人工氣候室中生長。每平皿每材料處理30粒種子,設置3個生物學重復。高溫處理幼苗試驗:將春化后材料置于人工氣候室中生長3 d,采用浸入法將培養皿在42 ℃水浴中處理25 min,將處理后的材料轉移到正常條件下生長7 d后統計存活率。
1.2.7基因表達分析 在OE、MUT以及WT擬南芥材料中檢測耐熱相關基因的表達變化,取樣部位,熱處理方法,RNA提取、反轉錄以及熒光定量PCR檢測參照1.2.1與1.2.3。利用Integrated DNA Technologies網站提供的引物設計軟件設計表達檢測的引物,檢測的基因及其引物序列見表1,其中Actin7為內參基因。基因相對表達量采用2-ΔΔCt方法進行計算。
1.3 數據分析
采用t檢驗分析表達差異顯著性,采用Excel 2010與PowerPoint 2010作圖。
2 結果與分析
2.1 紫花苜蓿MsMBF1c基因的克隆與序列比對分析
以紫花苜蓿葉片cDNA為模板克隆獲得一個長度為429 bp的DNA序列(基因注冊號:MK091391),編碼一個143個氨基酸的蛋白,將該蛋白序列與擬南芥AtMBF1c蛋白序列比對發現,兩者同源相似性高達72%。
2.2 MsMBF1c組織特異表達與誘導表達分析
參照材料與方法中的取樣時期與部位,分析MsMBF1c在不同組織中的表達差異,結果顯示MsMBF1c在不同組織中都有表達,其表達強度依次為:花>根>葉>莖>幼嫩角果,花中的表達量最高,是果實表達量的3.15倍(圖1A)。在誘導表達中,高溫及干旱都能誘導MsMBF1c的表達,與正常條件相比,MsMBF1c的表達被高溫誘導了4.21倍,被干旱誘導了2.15倍,被高溫與干旱組合處理誘導了4.59倍(圖1B)。

表1 熒光定量用到的引物序列Table 1 Primer used in the real time PCR assay
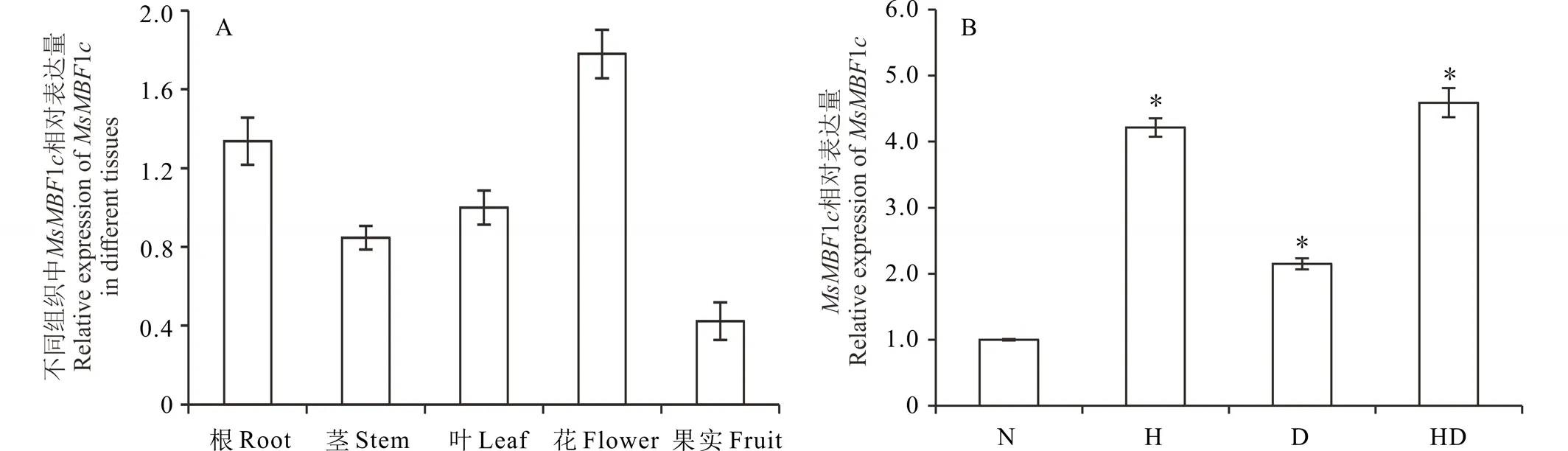
圖1 MsMBF1c組織特異表達以及高溫和干旱誘導表達分析Fig.1 Tissue specific expression and high temperature and drought inductive expression of MsMBF1c A,MsMBF1c組織特異性表達分析。檢測MsMBF1c在紫花苜蓿根、莖、葉、花、果樣品基因的表達變化,以葉片中MsMBF1c表達量均一化為1進行數據分析;B,MsMBF1c受高溫和干旱脅迫的誘導表達。N:正常生長條件,H:高溫條件,D:干旱條件,HD:高溫與干旱組合處理。以正常條件下葉片中MsMBF1c表達量均一化為1進行分析。*表示脅迫處理與正常條件差異在P<0.05水平差異顯著(t檢驗)。表達檢測采用real-time PCR的方法,每個材料設置3個生物學重復,每個生物學重復包括3次技術重復。A, Tissue specific expression pattern of MsMBF1c. The expression level of MsMBF1c in root, stem, leaf, flower and fruit samples from individual alfalfa plants were tested and the level of MsMBF1c in leaf was normalized to 1 when we analyzed the data. B, High temperature and drought inductive expression pattern of MsMBF1c. N stands for normal condition, H stands for high temperature stress, D stands for drought stress, HD stands for high temperature and drought combined stresses. * indicates a significant difference between stress condition and normal condition at P<0.05 level (t test). The expression of MsMBF1c in leaf under normal condition was normalized to 1 when we analyzed the data. The expression changes of MsMBF1c were both examined by real-time PCR, each with 3 biologic repeats and 3 technic repeats.
2.3 MsMBF1c過量表達載體構建與轉基因植株篩選
從誘導表達分析發現MsMBF1c在高溫條件下強烈誘導表達,為進一步探究MsMBF1c在調節植物耐熱性中的功能,采用了過表達轉基因植株和突變體表型聯合分析的方法。首先,通過將pBI121-35S:MsMBF1c過量表達載體(圖2A)對野生型擬南芥植株進行遺傳轉化獲得MsMBF1c過表達OE材料。采用PCR分析的方法分析NPT與MsMBF1c兩個基因的擴增效果,22株抗生素篩選呈陽性的植株中,NPT顯著擴增的有20株,MsMBF1c顯著擴增的有18株(圖2B)。選擇抗性不分離的T3代過表達轉基因植株和mbf1cT-DNA突變體雜交,在 F3代中采用分子檢測的方法篩選mbf1c位點,其中LBp1.3與MsMBF1 R引物組合有明顯擴增條帶,表示有插入片段;因為插入片段過長,而且插入位點為純合體,導致MsMBF1F與MsMBF1 R引物組合沒有顯著擴增(圖2C),并且含有MsMBF1c過表達插入片段的植株(MsMBF1cOE/mbf1c)(圖2D),即為互補系COM材料,或者為突變體背景的過表達材料。
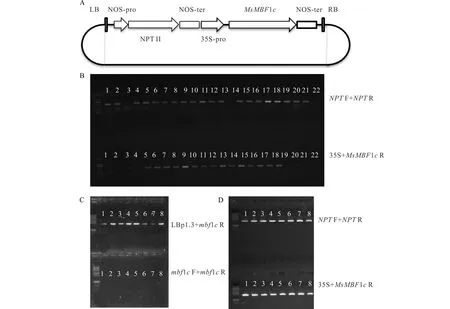
圖2 MsMBF1c過表達載體構建及擬南芥過量表達株系和互補系分子鑒定Fig.2 Construction of MsMBF1c over expression vector and molecular screening of over expression lines and complementary lines in Arabidopsis plants A,pBI121-35S:MsMBF1c過量表達載體示意圖;B,MsMBF1c過量表達擬南芥分子檢測電泳圖(數字對應的為檢測泳道,非植株標號);C和D,mbf1c突變體互補系分子檢測電泳圖。利用LBp1.3+mbf1c R和 mbf1c F+mbf1c R引物組合,以及NPT F+NPT R 和35S+MsMBF1c R引物組合分別檢測T-DNA插入位點(C)和過量表達插入片段(D)。A, A diagram showing pBI121-35S:MsMBF1c over expression vector. B, Results of molecular detections of MsMBF1c over expression lines in Arabidopsis (numbers indicate the loading lanes instead of plant lines). C and D, Results of molecular detections of mbf1c mutant complementary lines in Arabidopsis, the T-DNA insertion site was examined by LBp1.3+mbf1c R and mbf1c F+mbf1c R combinations (C), while the MsMBF1 transgene fragment was examined by NPT F+NPT R and 35S+MsMBF1c R combinations.
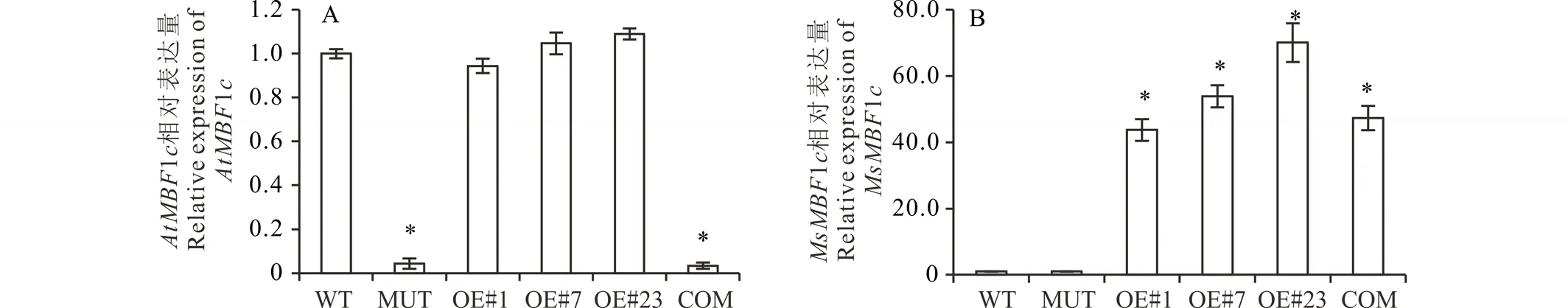
圖3 AtMBF1c(A)和MsMBF1c(B)在WT、MUT、OE#1、OE#7、OE#23以及COM等不同植物株系中的相對表達分析Fig.3 Relative expression of AtMBF1c (A) and MsMBF1c (B) in the WT, MUT, OE#1, OE#7, OE#23 and COM plant 以WT中的AtMBF1c或者MsMBF1c的表達量均一化為1進行統計分析,每個材料3個生物學重復,每個生物學重復有3個技術重復,Actin7 被用為內參,*表示差異在P<0.05水平差異顯著。The expression of AtMBF1c and MsMBF1c in the WT was normalized into 1, each plant line was examined with 3 biological repeats and 3 technique repeats, Actin7 was used as internal control, * stands for a significant difference at P<0.05 level.
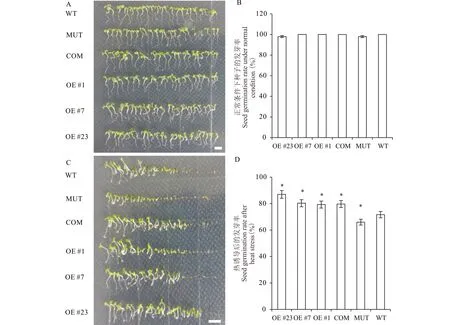
圖4 擬南芥WT、MUT、COM以及OE株系高溫萌發比較實驗Fig.4 Seed germination test among WT, MUT, COM and OE lines of Arabidopsis after heat stress A和B,圖片顯示WT、MUT、COM以及3個獨立的OE株系(#1、#7 和 #23)在正常條件下的發芽情況(A)和統計結果(B)。C和D,WT、MUT、COM以及3個獨立的OE株系在高溫脅迫條件下的發芽情況(C)和統計結果(D)。WT:野生型,MUT:mbf1c T-DNA 插入突變體,COM:mbf1c突變體互補系,OE #1,#7,#23:3個獨立的MsMBF1c過量表達株系。*表示WT和其他株系在P<0.05水平差異顯著(t檢驗),標尺=1 cm。A and B, Seed germination (A) and the statistical analysis (B) of WT, MUT, COM and 3 individual OE (#1, #7 and #23) lines of Arabidopsis under normal condition. C and D, Seed germination (C) and the statistical analysis (D) of seed germination rates of the Arabidopsis lines mentioned in (A-B) under high temperature (D) condition. WT: wild type, MUT: mbf1c T-DNA insertion line, COM: mbf1c complementary line, OE #1, #7, #23: 3 individual MsMBF1c over expression lines. * indicates a significant difference at P<0.05 level (t test), bars=1 cm.
分析AtMBF1c與MsMBF1c在WT、3個獨立OE株系(#1、#7和#23)、MUT以及COM中的表達變化,其中AtMBF1c在MUT和COM中沒有表達,在WT、3個獨立OE株系正常表達,但他們之間沒有顯著的差異。MsMBF1c在3個獨立OE與COM株系中高豐度表達,而在WT與MUT中沒有檢測到表達。
2.4 MsMBF1c轉基因擬南芥耐熱性分析
為了明確MsMBF1c對植物耐熱性的調節作用,利用擬南芥野生型(WT)、mbf1c突變體(MUT)以及上述篩選的MsMBF1cOE和COM材料進行高溫處理后的種子萌芽和幼苗耐熱性試驗。在正常條件下,4種材料之間的種子發芽率沒有顯著的差異(圖4A,B),而在高溫處理后,MUT的發芽率顯著比WT低,COM種子的發芽率和發芽勢與3個獨立OE株系(#1、#7和#23)均顯著高于WT,而COM與3個OE株系之間差異均不顯著(圖4C,D)。
不同材料的幼苗耐熱存活率也存在顯著差異。采用密植法播種待分析的材料,在正常條件下,WT、MUT、COM以及OE株系之間的幼苗存活率沒有顯著差異(圖5A,B),而在高溫處理之后,所有株系的存活率與正常條件相比均有不同程度下降,其中WT存活率下降到16.7%,而 MUT的存活率下降到10.0%,顯著低于WT水平。COM和3個OE株系的的存活率均顯著高于WT水平,達40.0%~76.7%(圖5C,D)。
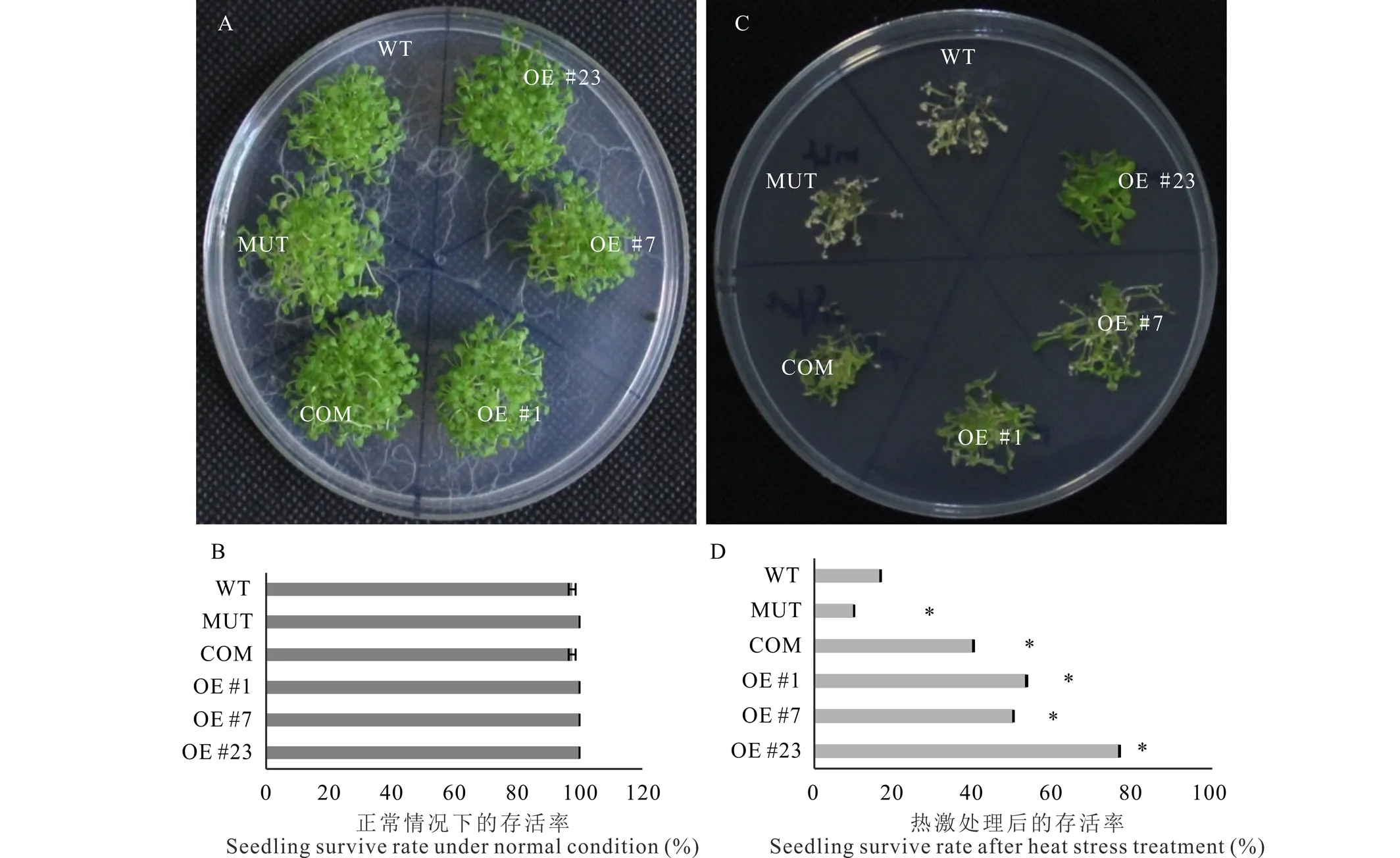
圖5 擬南芥WT、MUT、COM以及OE株系高溫脅迫后幼苗成活率比較實驗Fig.5 Seedling surviving test among WT, MUT, COM and OE lines of Arabidopsis after heat stress A和B,圖片顯示WT、MUT、COM以及3個獨立的OE株系在正常(A)和高溫脅迫條件下(B)的幼苗存活率表觀圖。C和D,WT、MUT、COM以及3個獨立的OE株系在正常(C)和高溫脅迫條件下(D)幼苗存活率的統計分析。WT:野生型,MUT:mbf1c T-DNA 插入突變體,COM:mbf1c突變體互補系,OE #1,#7,#23:3個獨立的MsMBF1c過量表達株系。*表示與野生型相比差異在P<0.05水平差異顯著(t檢驗),標尺=1 cm。A and B, Seedling surviving of WT, MUT, COM and 3 individual OE lines of Arabidopsis under normal (A) and high temperature (B) conditions. C and D, Statistical analysis of seedling surviving rates of the Arabidopsis lines mentioned in (A and B) under normal (C) and high temperature (D) conditions. WT: wild type, MUT: mbf1c T-DNA insertion line, COM: mbf1c complementary line, OE #1, #7, #23: 3 individual MsMBF1c over expression lines. * indicates a significant difference was detected between WT and other lines at P<0.05 level (t test),bars=1 cm.
2.5 耐熱相關基因表達分析
為進一步探究MsMBF1c對植物耐熱性調節的分子機制,分析了擬南芥中已知的耐熱調節關鍵基因在正常生長條件和高溫處理后的WT、COM以及OE #23等株系中的表達變化,共挑選了HSFA1a、HSFA2、HSFA3、HSFB1、WRKY25、WRKY18、DREB2a等7個基因。在正常條件下,HSFA2、WRKY18與DREB2a在MUT中的表達顯著低于在WT中的表達水平,而HSFA1a、HSFA3、HSFB1、WRKY25等基因的表達與在WT中的表達量差異不顯著。在OE株系中,除HSFA1a外,HSFA2、HSFA3、HSFB1、WRKY25、WRKY18、DREB2a的表達相對WT中都有不同程度上調,表達量為在WT的1.74~3.80倍范圍。
高溫處理后,所有檢測基因在WT、COM以及OE #23等株系中的表達都比在正常條件下升高,但在不同材料中差異較大(2.54~7.26)。與WT相比,高溫處理后HSFA2、HSFA3、HSFB1、WRKY18與DREB2a在MUT中的表達仍被顯著下調,而HSFA1a與WRKY18的表達與WT不顯著。在OE株系中,除WRKY18顯著高于在WT的表達水平外,其余基因的表達在OE與WT兩個材料間差異不顯著。
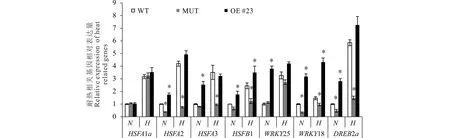
圖6 抗熱性相關基因在正常以及高溫脅迫下擬南芥WT、MUT以及OE株系中的表達變化Fig.6 The expression assay of a set of thermotolerance-related genes in WT, MUT and OE lines of Arabidopsis under normal and high temperature stressed conditions N,表示正常生長條件;H,高溫脅迫后的生長條件。以正常條件下葉片中對應基因的表達量均一化為1進行分析。WT: 野生型,MUT:mbf1c T-DNA 插入突變體,OE#23:MsMBF1c過量表達株系-23。*表示在P<0.05水平其他株系與野生型差異顯著(t檢驗)。設3個生物學重復,每個生物學重復包含3個技術重復。N stands for normal condition, H stands for high temperature stress. WT: wild type, MUT: mbf1c T-DNA insertion line, OE #23: MsMBF1c over expression line-23.* indicates a significant difference was detected between WT and other lines at P<0.05 level (t test). The expressions of the selected genes in leaf under normal condition are normalized to 1. The expression changes of those genes were examined by qRT-PCR, 3 biologic repeats, each with 3 technic repeats.
3 討論
MBF1在原核生物和真核生物中十分保守,通過連接不同的DNA結合蛋白和TATA-box結合蛋白(TATA-binding protein,TBP)增強目標基因的轉錄[22],從紫花苜蓿中獲得的MsMBF1c蛋白與擬南芥MBF1c蛋白同源相似性高達72%,表明其可能也具有保守的參與調控植物耐熱性的功能。
在植物中MBF家族基因可能通過與多種激素或其他信號分子互作參與非生物逆境脅迫應答。辣椒(Capsicumannuum)CaMBF1的表達顯著被水楊酸、高鹽、滲透壓以及重金屬脅迫抑制,而過量表達CaMBF1能降低植株對冷害脅迫的耐受能力[23]。過量表達玉米MBF1a基因能增強擬南芥的耐鹽能力,可能與乙烯與葡萄糖信號通路相關[24]。在西紅柿(Lycopersiconesculentum)中過量表達MBF1基因能顯著誘導水楊酸(salicylic acid, SA)信號途徑標志基因PR1與PR6等的表達,并增強植物的抗病性[25]。最近的研究發現過量表達南極洲苔蘚(Polytrichastrumalpinum)的MBF1c能夠增強擬南芥的耐鹽性[26]。大量的報道也表明植物MBF1基因是一個重要的抗熱(或干旱)調節基因。在高溫和干旱處理后的擬南芥轉錄組中檢測到AtMBF1c顯著被誘導[27]。擬南芥AtMBF1能夠互補酵母mbf1突變體熱敏感表型[15]。擬南芥mbf1c突變體對高溫敏感,這種表型能夠被MBF1c恢復[14]。過量表達小麥TaMBF1c能顯著提高酵母和水稻的耐熱性[16]。在葡萄[17]和剪股穎[18]也有MBF1家族基因參與耐熱調節的報道。在本研究中MsMBF1c的表達能夠顯著被高溫和干旱誘導,而且MsMBF1c能夠互補擬南芥mbf1c突變體在種子萌發以及幼苗生長階段耐熱能力的缺失,并且顯著增強野生型擬南芥的耐熱性。說明MBF1c基因在植物耐熱調節中是一個十分重要的功能保守基因。
為分析MsMBF1c在植物耐熱調節反應中的地位,本研究分別檢測了野生型、mbf1c突變體以及MsMBF1c過量表達株系在正常和熱誘導后的HSF家族與WRKY家族部分基因和DREB2a的表達變化,在不同材料中這些基因都能受高溫顯著誘導,但是誘導表達的程度差異較大,原因在于這些基因在調節植物耐熱反應中所處的途徑和地位不同。HSFA1a的表達變化在3種材料中差異不大,說明HSFA1a可能位于MBF1c的上游(或不處于同一條調控途徑),這與在擬南芥中MBF1c的表達受HSFA1的調節,在hsfa1四突變體中被顯著抑制[28]的報道相吻合。在正常條件下,HSFA2、WRKY18與DREB2a的表達在mbf1c突變體中被顯著抑制,在MsMBF1c過量表達植株中被上調,高溫脅迫后這種趨勢更加明顯;而HSFA3、HSFB1與WRKY25也具有類似的變化趨勢,說明這些基因表達可能受MsMBF1c基因的調控。這與在擬南芥中,HSFB2a,HSFB2b和HSFA3的上游基因DREB2a依賴于MBF1c[29]中的報道是一致的。另外,在擬南芥中MBF1c參與WRKY轉錄因子介導的耐熱調節,MBF1c的表達受WRKY25、WRKY26與WRKY33的調控[30-31],而同時,WRKY18在MBF1c過表達株中上調表達[32]。因此,MBF1c與WRKY家族基因可能存在反饋調節的機制。在本研究中,WRKY18與WRKY25的表達均受MsMBF1c的調節,可能的原因為MBF1c能夠通過激素信號途徑調節植物耐熱性,MBF1c位于水楊酸和乙烯信號通路介導的耐熱調節途徑的上游[14,33],而WRKY25與WRKY33等能夠與乙烯信號途徑相互作用調節植物耐熱性[30];另外一種可能是紫花苜蓿MsMBF1c在部分調控途徑上與擬南芥存在差異,準確的結果還有待深入研究。
4 結論
紫花苜蓿MsMBF1c能夠應答高溫、干旱等非生物脅迫,并具有調節植物抗熱性的作用。在分子水平上,MsMBF1c能夠調節HSF、WRKY以及DREB2a等家族某些主要的抗熱相關基因的表達,參與植物對耐熱脅迫的應答反應。

