纖維素酶-超聲聯合提取菠菜中總黃酮及其成分分析
穆易君,陳 洋,孫 晶,吳 杰,馬 云,劉 崑
(錦州醫科大學食品科學與工程學院,遼寧省肉類加工與質量安全控制工程中心技術研究中心,遼寧錦州 121001)
菠菜(Spinaciaoleracea)是莧科菠菜屬植物中的一種典型的綠葉蔬菜,原產地位于波斯,深受當地阿拉伯人的喜愛,還獲得了“蔬菜之王”的稱號,于唐朝期間由尼泊爾人傳入我國,現已在國內被廣泛種植[1]。菠菜對周圍環境的適應性強,耐寒、耐儲藏,并且供應期長、產量高,還富含大量的維生素、脂肪酸和多種礦物質元素以及一些色素成分,這些營養成分可以維持人體正常生理代謝水平[2]。除食用價值外,菠菜中的黃酮類化合物在生理上也具有抗菌、抗炎、抗氧化、抗細胞增殖和抗變態反應等功效[3]。
黃酮類化合物是一種天然的多酚類物質,也是藥食兩用植物中的重要成分[4],具有生物活性、低毒性、易獲得的特點[5-6]。黃酮類化合物的生物活性作用取決于各取代基的存在和位置,這些取代基同時會影響每種化合物的代謝[7]。
而近幾年,對于黃酮資源的研究開發正在蓬勃開展,有許多關于黃酮類化合物提取的研究,大多數研究都涉及到了提取方法的優化和更新,但提取方法比較單一,例如:超聲輔助提取、微波輔助提取、酶解提取等,趙娟娟用乙醇提取出菠菜總黃酮,并對提取條件進行了優化[8],2015年許福泉等采用有機溶劑乙醇提取菠菜中的黃酮類化合物[9]。而在關于對植物活性物質提取的研究課題中,有少數研究將兩種方法結合使用,如:王如意等利用超聲波協同酶解法提取啤酒花中的黃酮類化合物[10],楊海濤等利用酶-超聲輔助法提取苦蕎稈中總黃酮[11],但將兩種提取方法結合提取菠菜中的黃酮類化合物還未有報道。
天然植物提取物通常是含有多種生物活性成分的復雜混合物。將具有生物活性的化合物進行快速準確地檢測和評價是植物化學研究的關鍵。用于黃酮類化合物成分測定的常用方法有:薄層色譜法、高效液相色譜法、氣相色譜法等。薄層層析法和氣相色譜法及其他一些分析方法,由于工作原理具有局限性、操作復雜、成本高等因素,不適用于分析黃酮類化合物成分或在大規模生產中使用[12-13]。而高效液相色譜法由于具有極快的分析速度、寬泛的流動相選擇以及使用條件溫和等優點,常被用于天然產物活性成分的分析。本研究采用纖維素酶結合超聲提取法提取菠菜黃酮,為菠菜中黃酮的提取提供節能高效的新方法。建立可以同時檢測菠菜黃酮中7種黃酮類化合物成分的分析方法,可以使菠菜中的主要黃酮類化合物成分在基線上得以分離,且分離度較好,是檢測分析菠菜中黃酮類化合物組成成分及其含量的高效準確的方法。
1 材料與方法
1.1 材料與儀器
菠菜 錦州市售新鮮無蟲害菠菜;蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素,純度均≥98% 北京索萊寶科技有限公司;纖維素酶(活力>200 U/mg) Sigma公司;甲醇(色譜級) 天津市康科德科技有限公司;蒸餾水 實驗室自制;AB-8大孔吸附樹脂 陜西樂博生化科技有限公司;95%乙醇 天津永晟精細化工有限公司;濃鹽酸、甲醇、甲酸、氫氧化鈉、石油醚(60~90 ℃) 天津市風船化學試劑科技有限公司;鄰苯二甲酸氫鉀、混合磷酸鹽、四硼酸鈉 上海雷磁·創益儀器儀表有限公司。
DHG-9140型電熱恒溫鼓風干燥箱 上海恒科技有限公司;FW-400A型萬能粉碎機 北京中興偉業儀器有限公司;SHA-B型水浴恒溫振蕩器 金壇市科析儀器有限公司;0501094S型高速臺式離心機 上海安亭科學儀器廠;JA1003N型電子天平 上海精密科學儀器有限公司;UV-5100型紫外可見分光光度計 上海元析儀器有限公司;RE-5298型旋轉蒸發器 上海亞榮生化儀器廠;SHZ-Ⅱ型循環水真空泵 上海亞榮生化儀器廠;FD-1A-50型真空冷凍干燥機 北京博醫康實驗儀器有限公司;PHS-3E型pH計 上海佑科儀器儀表有限公司;KQ-500DE型超聲波清洗器 昆山市超聲儀器有限公司;CTO-15C型高效液相色譜儀 日本島津公司。
1.2 實驗方法
1.2.1 原料預處理 將新鮮菠菜用水洗凈表面泥沙及雜質,去根、去黃葉;用電熱鼓風干燥機于60 ℃、物料厚度1 cm,干燥24 h;干燥磨粉,過80 目篩;用石油醚60 ℃水浴恒溫振蕩24 h脫色處理,脫色時每隔6 h更換一次石油醚,用高速離心機4000 r/min離心10 min取上清液,再用石油醚反復萃取至石油醚無色,晾干備用。
1.2.2 菠菜黃酮化合物樣品的制備 纖維酶-超聲提取:準確稱取2.0 g菠菜粉末于具塞三角瓶中,與70%甲醇溶液按料液比1∶30 g/mL混合,加檸檬酸-檸檬酸鈉緩沖溶液和纖維素酶,置于超聲波清洗器中,在一定溫度和時間下進行超聲處理。將提取液用旋轉蒸發儀50 ℃旋蒸濃縮1 h后,用真空冷凍干燥機于-80 ℃干燥4 h直至變成粉末狀,密封于4 ℃下冷藏保存備用。
純化粗提物:將粗提物配成一定濃度(3.0 mg/mL),用4倍柱體積60%的乙醇溶液通過AB-8大孔樹脂進行洗脫,將純化后的提取液用旋轉蒸發儀50 ℃下旋蒸濃縮1 h后,用真空冷凍干燥機于零下80 ℃干燥4 h直至變成粉末狀,密封于4 ℃下冷藏保存備用[14]。
1.2.3 單因素實驗 選取影響纖維素酶-超聲提取菠菜中總黃酮得率的6個因素:甲醇濃度、酶添加量、料液比、提取溫度、提取時間、酶解pH,考察各因素對菠菜中總黃酮得率的影響。考察單因素對總黃酮的提取的影響時,固定超聲功率為500 W,料液比1∶30 g/mL、甲醇濃度60%、提取時間45 min、提取溫度40 ℃、pH4.6、纖維素酶的添加量0.3%,分別改變所對應的設定因素,纖維素酶的添加量0.3%、0.6%、0.9%、1.2%、1.5%;酶解pH4.2、4.6、5.0、5.4、5.8;料液比1∶20、1∶30、1∶40、1∶50、1∶60 g/mL;甲醇濃度50%、60%、70%、80%、90%;提取溫度30、40、50、60、70 ℃;提取時間15、30、45、60、75 min,進行單因素實驗。
1.2.4 正交試驗 根據單因素實驗結果優選四個對菠菜總黃酮得率影響較大的主要因素:酶添加量、料液比、提取溫度、酶解pH,進行四因素三水平的正交試驗,試驗因素水平見表1。
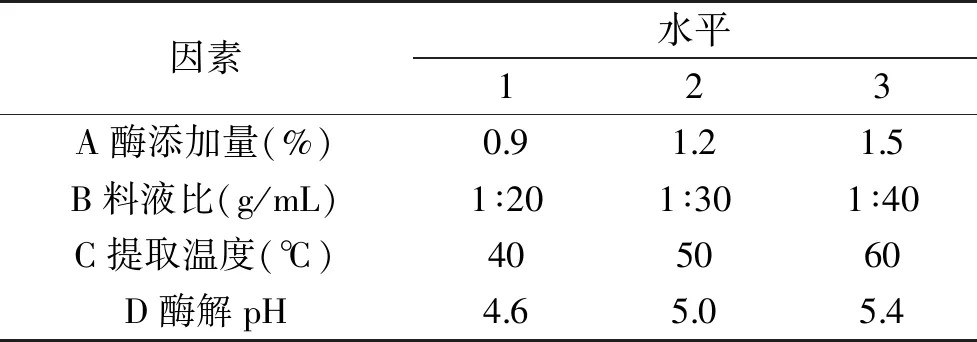
表1 正交試驗因素水平Table 1 The factors and levels of orthogonal experiment
1.2.5 樣品得率測定 蘆丁標準曲線的繪制:稱取蘆丁20.5 mg置于100 mL容量瓶中,加60%甲醇溶液溶解,稀釋至刻度,精確量取25 mL置于50 mL容量瓶中,蒸餾水稀釋至刻度搖勻,即得1.0 mL含蘆丁0.103 mg的標準溶液。按照李秀信等[15]的NaNO2-Al(NO3)3法繪制蘆丁標準曲線,以第一管為空白于510 nm波長下測定吸光度,以吸光度(Y)為縱坐標,蘆丁質量濃度(X)為橫坐標,繪制標準曲線,得到回歸方程為:Y=7.3953X+0.00052,R2=0.9991。
按照1.2.2操作取2.0 mL經纖維素酶聯合超聲提取法提取得到的菠菜總黃酮溶液,置于10 mL具塞試管中,按1.2.2.1操作,在510 nm測定吸光度,計算菠菜總黃酮得率。
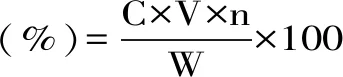
式中:C:稀釋液中總黃酮濃度(mg/mL);V:提取液總體積(mL);W:菠菜粉質量(g);n:稀釋倍數。
1.2.6 菠菜中黃酮類化合物的成分鑒定 精密稱取7種黃酮類化合物標準品:蘆丁5.9 mg、兒茶素6.8 mg、芹菜素6.0 mg、綠原酸6.0 mg、槲皮素5.7 mg、沒食子酸4.2 mg、山奈酚5.0 mg,用甲醇定容至25 mL容量瓶中,超聲使其充分混勻,即得蘆丁、兒茶素、芹菜素、綠原酸、槲皮素、沒食子酸、山奈酚濃度分別為:0.236、0.272、0.240、0.240、0.228、0.168、0.200 mg/mL的混合標準品儲備液。
色譜分析條件:采用島津CTO-15C型高效液相色譜儀,單次進樣量10 μL,以甲醇(A)-0.1%甲酸(B)為流動相,在紫外檢測波長280 nm,柱溫35 ℃,流速1 mL/min條件下進行梯度洗脫,單次分析時長40 min。
1.2.7 方法學考察
1.2.7.1 線性關系 采用外標五點法進行測定。向5支10 mL容量瓶中分別加入混合標準品溶液0.2、0.5、1、2、4、8 mL,用甲醇定容。按“1.2.6”項的色譜條件進行測定,獲得各標準品對應濃度的峰面積。以各個標準品濃度為自變量,該濃度下的峰面積為因變量,記錄數據,得到各標準品對應的回歸方程。
1.2.7.2 精密度考察 取線性標準品其中一個濃度,連續進樣5次,在“1.2.6”的色譜條件下進行測定,分別記錄蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素的峰面積并計算含量和RSD值。
1.2.7.3 重復性考察 取供試品6份,每份約20 mg,分別按“1.2.6”項的供試品處理方法制備,在“1.2.6”的色譜條件下進行測定,分別記錄蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素峰面積并計算含量,同時計算RSD值。
1.2.7.4 穩定性考察 取供試品一份,分別在0、2、4、8、10、12、24 h時,在“1.2.6”的色譜條件下進行測定,分別記錄每個時間供試品溶液的蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素峰面積并計算含量和RSD值。
1.2.7.5 加樣回收率考察 稱取“1.2.1”方法下提取得到的供試品6份,每份約20 mg,分別加入標準品儲備液2.5 mL,定容至10 mL,依照“1.2.6”項下的色譜條件方法進樣測定,分別記錄蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素峰面積并計算菠菜黃酮的加樣回收率及RSD值。
1.2.8 菠菜黃酮中7種黃酮類化合物成分的含量測定 取3批菠菜黃酮,在“1.2.6”的制備供試品溶液方法以及色譜條件下分別進樣20 μL,并采用外標法計算菠菜黃酮中各成分的含量。
1.3 數據處理
2 結果與分析
2.1 單因素實驗結果
2.1.1 酶添加量對總黃酮得率的影響 關于酶添加量對菠菜黃酮得率的影響,由圖1可以看出,酶添加量在0.3%~1.2%時,總黃酮得率隨著酶添加量的增加而增加,在酶添加量為1.2%時,得率達到最高值(12.66%),隨著酶添加量超過1.2%后,得率開始下降。由于隨著酶含量的增加,其對細胞壁的破壞程度隨之增大,總黃酮得率增加,在添加量為1.2%時達到最大值,隨著酶添加量進一步,酶解部分纖維素和過多的酶附著在顆粒表面,影響黃酮的溶出,使得得率下降[16],故選擇適宜的酶添加量為1.2%。

圖1 酶添加量對菠菜黃酮得率的影響Fig.1 The effect of enzyme addition on flavonoids extraction rate in spinach
2.1.2 酶解pH對總黃酮得率的影響 關于酶解pH對菠菜黃酮得率的影響,由圖2可以看出,當pH在4.2~6.0范圍內時,菠菜黃酮得率隨著酶解pH的增加先升高后下降,分析原因:隨pH增加纖維素酶活性升高,酶對細胞壁的破壞程度增加,降低傳質阻力從而使黃酮類化合物更快地溶出至提取劑,提取率升高[17],在酶解pH5.0時得率達到最大值(13.31%±0.21%),當酶解pH超過5.0時,得率開始下降,故選擇5.0為最適酶解pH。
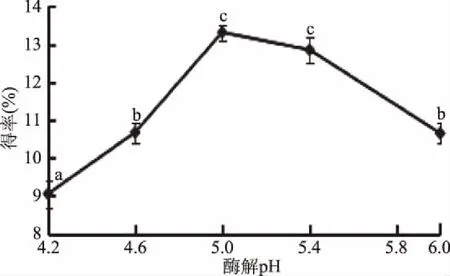
圖2 酶解pH對菠菜黃酮得率的影響Fig.2 The effect of enzymatic hydrolysis of pH on flavonoids extraction rate in spinach
2.1.3 料液比對總黃酮得率的影響 關于料液比對菠菜黃酮得率的影響,由圖3可以看出,當料液比在1∶20~1∶60 g/mL范圍內時,菠菜黃酮得率隨著料液比的增加先升高后下降,因為反應開始時隨反應溶劑量的增加,在超聲破壁作用和酶解雙重作用下,有機溶劑與物料的接觸面積增大,反應效率隨之增加[18],料液比在1∶30 g/mL時得率達到最大值13.07%±0.28%,超過1∶30 g/mL時,相對酶解作用減弱,得率降低。故選擇料液比1∶30 g/mL。
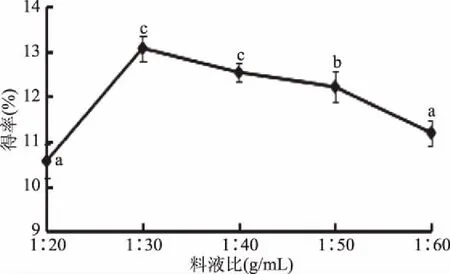
圖3 料液比對菠菜黃酮得率的影響Fig.3 The effect of material ratio on flavonoid extraction rate in spinach
2.1.4 提取溫度對總黃酮得率的影響 關于提取溫度對菠菜黃酮得率的影響,由圖4可以看出,當提取溫度在30~70 ℃范圍內時,菠菜黃酮得率隨著溫度的升高先升高后下降。溫度的升高有利于底物在甲醇溶液中的浸提,也有利于纖維素酶在底物中的溶解擴散,在50 ℃時得率達到最大值為12.64%±0.22%,而過高的溫度則會破壞纖維素酶的活性使得率降低[19]。故選擇提取溫度50 ℃。
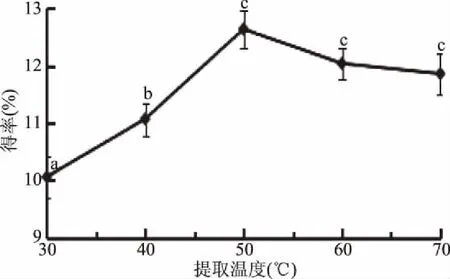
圖4 提取溫度對菠菜黃酮得率的影響Fig.4 The effect of extraction temperature on flavonoid extraction rate in spinach
2.1.5 提取時間對總黃酮得率的影響 關于提取時間對菠菜黃酮得率的影響,由圖5可以看出,提取時間在15~75 min范圍內時,菠菜黃酮得率隨著時間的增加先升高后下降,因為酶與底物的結合需要一定時間,時間過短酶與底物結合效率降低,得率低;隨著時間增加,酶與底物充分結合,得率增加,45 min時到達最大值13.18%±0.12%;超過45 min酶解反應速率下降,溶出黃酮類化合物增加加速了逆反應進行[20],得率緩慢下降。故選擇提取時間45 min。
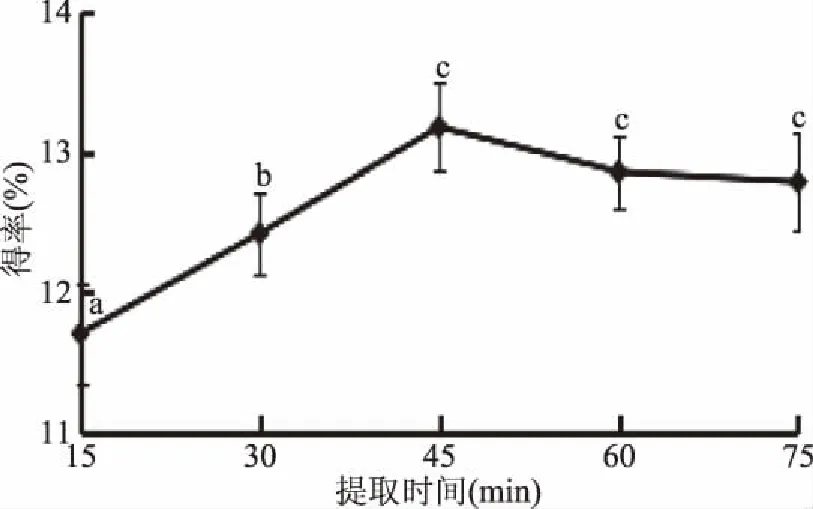
圖5 提取時間對菠菜黃酮得率的影響Fig.5 The effect of extraction time on flavonoid extraction rate in spinach
2.1.6 甲醇濃度對總黃酮得率的影響 關于甲醇濃度對菠菜黃酮得率的影響,由圖6可以看出,當甲醇濃度在50%~90%范圍內時,總黃酮得率隨著甲醇濃度的增加而增加,當甲醇濃度超過70%時,得率無明顯變化趨勢,由于濃度過大會消耗大量的有機試劑,容易造成資源浪費和環境污染,且高濃度的醇會提取出菠菜中的其他活性成分對實驗造成干擾[21]。從節約資源保護環境又同時能保證提取效果的角度綜合考慮,選擇適宜的甲醇濃度為70%。
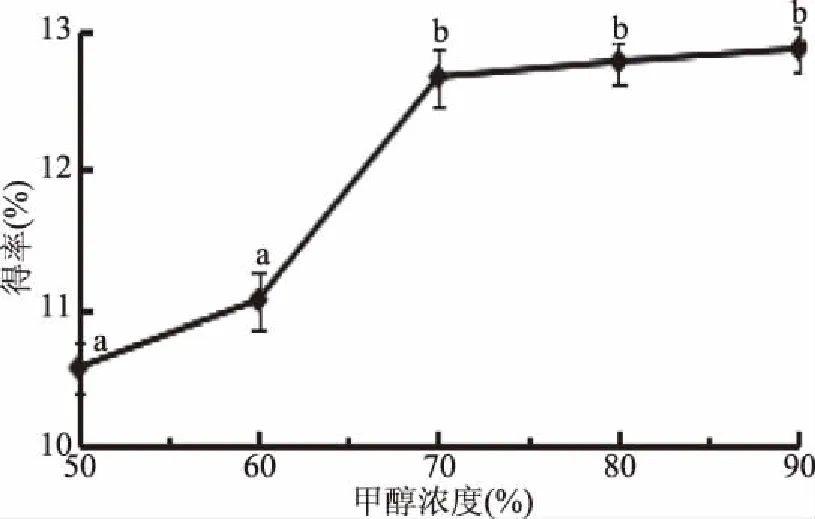
圖6 甲醇濃度對菠菜黃酮得率的影響Fig.6 The effect of methanol concentration on flavonoids extraction rate in spinach
2.2 正交試驗結果
對單因素實驗的6個因素進行綜合分析,選取酶添加量、料液比、提取溫度和酶解pH因素,以菠菜中總黃酮得率為指標,進行四因素三水平正交試驗,試驗結果見表2。

表2 L9(34)正交試驗結果Table 2 Results of L9(34)orthogonal experiment
從表2中的的極差結果可看出,四個因素對菠菜總黃酮得率的影響大小順序為:添加量>料液比>酶解pH>提取溫度,最佳組合為A2B2C3D2,即酶添加量1.2%,料液比1∶30 g/mL,提取溫度60 ℃,酶解pH5.0。在此條件下重復三次,得到的總黃酮得率為15.56%±0.04%。
2.3 樣品得率測定結果
將菠菜粉末利用纖維素酶聯合超聲提取法,在甲醇濃度70%、酶添加量1.2%、料液比1∶30 g/mL、提取溫度60 ℃、酶解pH5.0條件下超聲提取45 min,提取得到的菠菜總黃酮得率為15.56%。趙娟娟用乙醇熱浸提法提取得到的菠菜黃酮,最終得到的總黃酮得率為6.8%[8],經對比,本研究所使用的纖維素酶聯合超聲提取菠菜黃酮的方法得到的菠菜黃酮得率均高于前人的研究結果,故該方法在菠菜黃酮的提取上具有可行性。
2.4 菠菜中黃酮類化合物的成分鑒定
根據混合標準品色譜圖(圖7)可以得出,沒食子酸、綠原酸、兒茶素、蘆丁、芹菜素、山奈酚、槲皮素的混合標準品在“1.2.6”色譜條件下檢測出的保留時間分別為8.407、17.926、18.874、27.125、32.148、35.069、35.553 min。
根據菠菜黃酮色譜圖(圖8)可以看出,從樣品中檢測得到7種黃酮類物質,保留時間分別為8.390、17.890、18.826、27.068、32.128、35.048、35.531 min,與混合標準品色譜圖上的保留時間基本一致,基本可以認為是同一種成分。
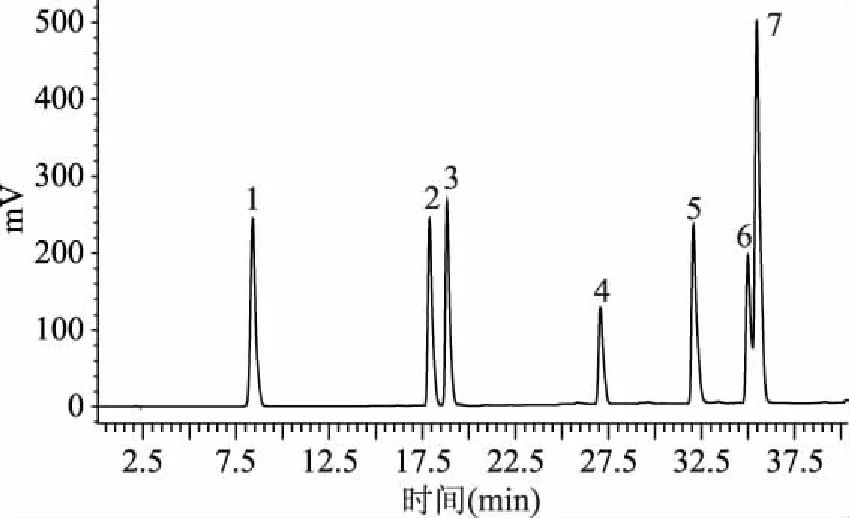
圖7 混合標準品色譜圖Fig.7 Mixed standard chromatography注:1.沒食子酸;2.綠原酸;3.兒茶素;4.蘆丁;5.槲皮素;6.山奈酚;7.芹菜素。
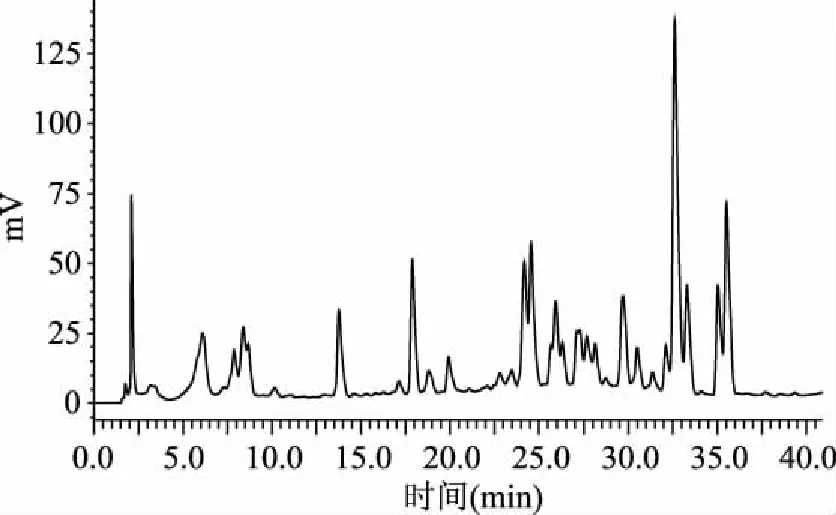
圖8 菠菜黃酮色譜圖Fig.8 Spinach flavonoids chromatography
2.5 方法學考察
2.5.1 線性關系考察 由表3可以看出,七種單體在線性濃度范圍內均與峰面積呈良好的線性關系,決定系數均大于0.999。

表3 線性關系考察結果Table 3 Results of linear relationship investigation
2.5.2 儀器精密度考察結果 由精密度實驗結果可以得出,蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素的RSD值在0.24%~2.63%范圍內,結果表明該儀器精密度良好。
2.5.3 重復性考察結果 由重復性實驗結果可以得出,蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素的RSD值在0.32%~2.06%范圍內,結果表明該方法具有良好的重復性。
2.5.4 穩定性考察結果 由穩定性實驗結果可以得出,蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素的RSD值在0.43%~2.06%范圍內,表明供試品溶液在0~48 h內基本穩定。
2.5.5 加樣回收率考察結果 蘆丁、槲皮素、山奈酚、綠原酸、沒食子酸、芹菜素、兒茶素的平均加樣回收率在98.13%~101.00%,RSD值在 2.74%~3.98%,表明該方法具有良好的準確性。
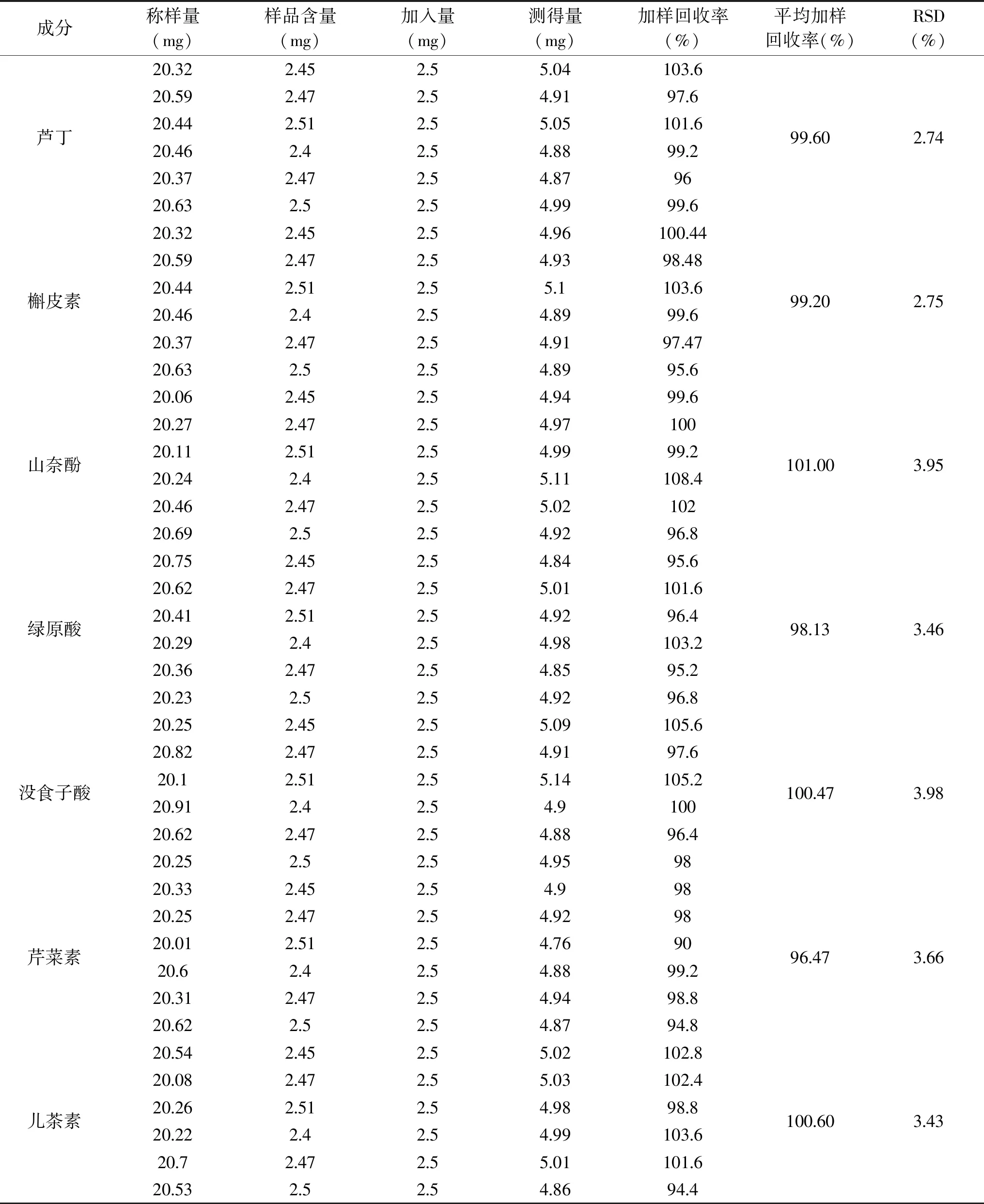
表4 加樣回收率考察結果Table 4 Sample recovery rate inspection results
2.6 菠菜黃酮中7種黃酮類化合物成分的含量測定
由表5可以看出,蘆丁、兒茶素、芹菜素、綠原酸、槲皮素、沒食子酸、山奈酚7種黃酮類化合物成分的含量分別為:0.83、1.37、0.64、1.46、2.12、1.25、1.87 mg/g。
3 結論
本實驗以菠菜為原料,通過纖維素酶聯合超聲提取的方法提取菠菜總黃酮,通過單因素實驗和正交分析,得到提取的最佳提取條件為:甲醇濃度70%、酶添加量1.2%,料液比1∶30 g/mL,提取溫度60 ℃,提取時間45 min、酶解pH5.0,在此條件下進行三次平行實驗得到的菠菜黃酮得率為15.56%±0.04%。得率的平均值比超聲提取和纖維素酶提取分別高出2.51%和1.27%。菠菜黃酮中含有沒食子酸、綠原酸、兒茶素、蘆丁、芹菜素、山奈酚、槲皮素七種黃酮類化合物成分,含量分別為:0.83、1.37、0.64、1.46、2.12、1.25、1.87 mg/g。將混合標準品在特定條件下以不同濃度進樣,得出的圖譜峰面積與進樣濃度之間存在良好的線性關系。經方法學實驗結果表明:儀器的精密度、供試樣品的穩定性、樣品檢測的重復性以及實驗的準確性均表現良好。
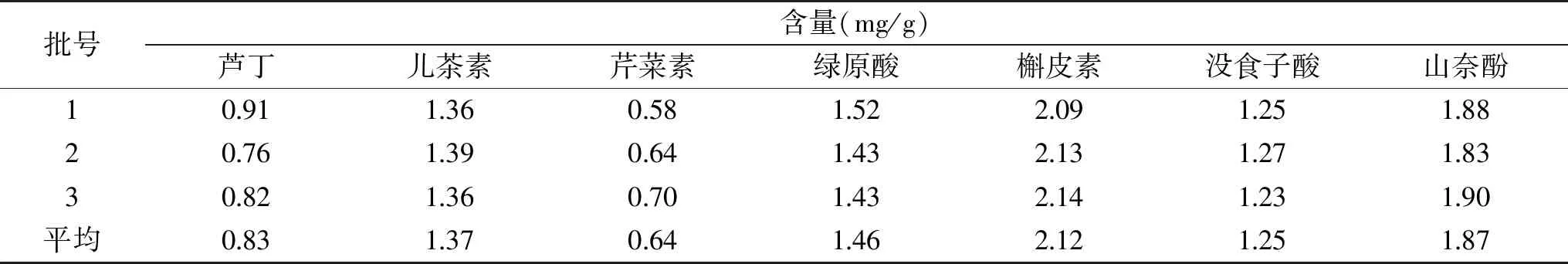
表5 菠菜黃酮中7種黃酮類化合物含量Table 5 Contents of 7 flavonoids in spinach flavonoids

