響應面法優化超聲輔助提取龍眼殼、核中總黃酮工藝
謝勇武 譚屬瓊

摘要:將常被丟棄的龍眼殼和龍眼核高效合理地利用起來,不僅不浪費資源,還能夠提高龍眼的整體利用價值,提供了獲得黃酮的另一途徑,降低提取黃酮的經濟成本。研究了超聲波輔助乙醇浸提法從龍眼殼、核中提取黃酮,其量的測定是采取紫外分光光度法測定的。利用響應面法在單因素試驗結果之上再做優化試驗,最后得到最佳提取工藝:超聲溫度61 ℃、原料目數41目、乙醇濃度63%、料液比1 g ∶ 20 mL、超聲時間30 min,實際黃酮提取量可達 39.1 mg/g。
關鍵詞:龍眼;黃酮;超聲波;響應面;提取工藝
中圖分類號: R284.2 ?文獻標志碼: A ?文章編號:1002-1302(2019)13-0239-06
龍眼(Dimocarpus longan L.)是無患子科果樹的果實[1],其殼和核都能用來當作藥物成分,但兩者經常被當作垃圾扔掉,其核質量約占其鮮質量的1/5[2]。黃酮類化合物又屬于多酚類化合物,其具有的多種生物活性能消去體內的自由基團,有抗衰老、降低膽固醇、抗腫瘤、消除疲勞、改善血液循環、抗菌、抗突變和降血壓等作用[3],也可抵御心腦血管疾病、抑制脂肪酶、防癌、防輻射等[4]。其若可以利用一種低成本且高效的方法從龍眼殼、核中得到,不僅節約資源、保護環境,同時也提高了龍眼果實的利用率和獲取黃酮的另一途徑。
賢景春等在超聲波提取龍眼核總黃酮量的工藝研究中,先通過單因素試驗再進行正交試驗分析,得到最佳工藝:乙醇濃度60%,超聲時間30 min,超聲溫度70 ℃,料液比 1 g ∶ 13 mL[5]。關愷珍等在對響應面法超聲提取龍眼核黃酮工藝的優化試驗研究中通過3因素3水平的響應面分析法得到最佳提取工藝:提取溶劑丙酮的濃度為59%,超聲時間為 2.3 h,超聲溫度為71 ℃[6]。周孟清等在用微波輔助法提取龍眼殼中黃酮類化合物的研究中先進行單因素試驗,再進行3因素3水平正交試驗,得到最佳提取工藝:微波處理時間30 s,微波處理功率為160 W,料液比1 g ∶ 4 mL[7]。龍眼在國外除了直接食用和簡單加工成飲料外,更多的是研究龍眼核的提取成分。龍眼核提取物有一定的抗菌活性,且一種水溶性的龍眼核多糖對人肺腺癌的細胞增殖呈劑量依賴性的抑制,在體內外均可發揮抗癌作用[8-9]。龍眼核活性炭具有高比表面積和多孔結構,更有利于吸附[10]。龍眼核是一個豐富的抗氧化劑茶多酚的天然來源,其提取物又是大腸癌細胞侵襲和明膠酶活性的強效抑制劑,21%水解度的龍眼提取物含有很高的可溶性膳食纖維和較強的活性益生元[11]。
本次試驗以福建泉州廢棄的龍眼殼、核為原材料,采取以乙醇為溶劑,超聲波輔助提取其殼、核中黃酮類化合物的提取方法,紫外分光光度法來測定試驗所得的黃酮量。在單因素試驗基礎上,選用響應面法優化龍眼殼與核中黃酮提取的最佳工藝。
1 材料與方法
1.1 試驗材料
龍眼是泉州本地龍眼,蕓香苷標準品(蕓香苷含量≥98%,北京索萊寶科技有限公司),亞硝酸鈉、硝酸鋁、氫氧化鈉均為分析純,無水乙醇(乙醇含量≥99.7%)等。
1.2 試驗方法
1.2.1 工藝流程 廢棄的龍眼殼、核→挑揀、干燥→粉碎→過篩→稱質量→按一定料液比加溶劑→超聲波提取→抽濾(布氏漏斗)→定容→黃酮提取量的測定
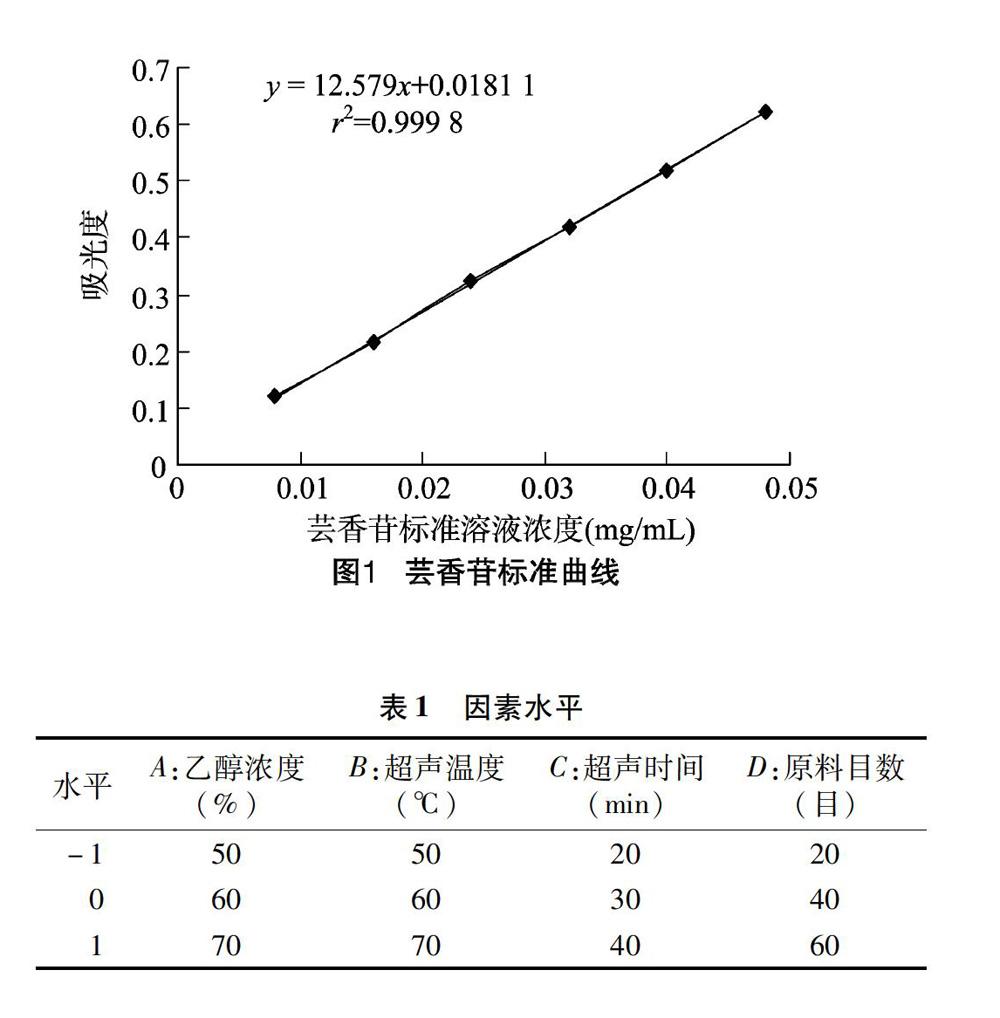
1.2.2 主要工藝操作要點 (1)原料處理。從廢棄的龍眼殼、核中挑揀出明顯的雜質,在50 ℃下鼓風干燥箱中烘干到質量不再改變,將干燥的龍眼殼、核磨粉,過篩,再倒入加蓋廣口玻璃瓶中,干燥保存備用。(2)蕓香苷標準溶液的配制。正確稱取在105 ℃干燥至恒質量的蕓香苷標準品20 mg,加一定量的體積分數為60%的乙醇溶液溶解,全部移入100 mL容量瓶中,再用60%乙醇溶液定容至刻度,搖勻,制得濃度為 0.200 mg/mL 的蕓香苷標準溶液,冷藏待用。(3)蕓香苷標準曲線的制作。分別移取上述蕓香苷標準溶液0.0、0.4、0.8、1.2、1.6、2.0、2.4 mL各置于10 mL容量瓶中,各加入 50 mg/mL 亞硝酸鈉溶液0.2 mL,搖勻后靜置6 min,加 100 mg/mL 硝酸鋁溶液0.2 mL,搖勻后靜置6 min,加 40 mg/mL 氫氧化鈉溶液2.0 mL,再加60%乙醇溶液定容至刻度,搖勻,靜置 15 min。空白對照為不加蕓香苷標準溶液,將測吸光度的儀器的波長調至510 nm處測吸光度,取3次平行試驗平均值。以吸光度D為縱坐標,以蕓香苷含量(mg/mL)為橫坐標繪制出標準曲線(圖1)。(4)樣品溶液的制備。拿干燥的、過一定目數目篩的龍眼殼、核粉末1.000 g,準確稱量,在確定料液比下加已知濃度的乙醇溶液作為提取溶劑,在設置好的溫度、超聲頻率下超聲水浴提取一定時間,趁熱抽濾,再移至50 mL容量瓶中并用60%乙醇定容,制成樣品溶液。(5)黃酮提取量的測定。分別取0.5 mL的待測提取液,置于25 mL容量瓶中,各加入50 mg/mL亞硝酸鈉溶液0.2 mL,搖勻后靜置6 min,加100 mg/mL硝酸鋁溶液 0.2 mL,搖勻后靜置6 min,加 40 mg/mL 氫氧化鈉溶液 2.0 mL,再加60%乙醇溶液定容至刻度,搖勻,靜置15 min。以不加提取液組為對照組,于 510 nm 波長處測吸光度,根據吸光度和蕓香苷標準曲線計算總黃酮提取量,并按下式計算:
W=(X/m)(V1/V2)。
式中:W為樣品中黃酮提取量;X為測得樣品液的吸光度;m為樣品質量;V1/V2為測定用樣液體積(mL)/試樣處理液總體積(mL)。
1.3 試驗設計方案
1.3.1 單因素試驗設計 把乙醇溶液作為提取溶劑,在一定超聲波頻率下利用超聲波輔助法提取龍眼殼、核粉末中的黃酮類化合物,分別設計以原料目數(10、20、40、60、80、100目)、超聲溫度(30、40、50、60、70、80 ℃)、料液比(1 g ∶ 10 mL、1 g ∶ 15 mL、1 g ∶ 20 mL、1 g ∶ 25 mL、1 g ∶ 30 mL、1 g ∶ 35 mL)、乙醇濃度(40%、50%、60%、70%、80%、90%)、超聲時間(20、30、40、50、60、70 min)為單一因素對黃酮提取量影響的試驗。
1.3.2 龍眼殼、核黃酮提取的響應面試驗設計 根據RSM中Box-Behnke Design(BBD)的中心組合試驗設計原理,在單因素試驗基礎上,建立以對龍眼殼、核中黃酮提取量影響顯著的4個因素為自變量A、B、C、D的4因素3水平的響應面分析(表1)。用Design Expert version 8軟件進行響應面試驗設計,各因素的響應值為黃酮的提取量,最終分析獲得從龍眼殼、核中提取黃酮類化合物的最佳提取工藝。
2 結果與分析
2.1 單因素試驗結果分析
2.1.1 乙醇濃度對龍眼殼、核黃酮提取量的影響 由圖2可知,龍眼殼、核中黃酮的提取量隨乙醇濃度的增大先升高后降低,乙醇濃度為60%時,黃酮提取量最大。乙醇濃度過低不利于黃酮類物質的溶解提取,過大可導致蛋白質、糖類等大分子發生凝聚,梗阻內部組織的孔道,致黃酮類化合物擴散的阻力增進,乙醇濃度的增長也會減弱顆粒細胞的溶脹[12],因此乙醇溶液的濃度以60%左右為宜。
2.1.2 超聲溫度對龍眼殼、核中黃酮提取量的影響 由圖3可知,黃酮提取量跟隨超聲溫度的升高先明顯增加后又逐漸減少,當超聲溫度為60 ℃時,其提取量最大。可能原因是溫度過低使黃酮類物質不易溶解出來,而溫度過高引起黃酮類物質被氧化毀壞,還可能導致其他可溶性物質的溶出,從而降低黃酮提取量[13-15]。當超聲溫度為80 ℃時,其稍有平緩增加趨勢,但考慮到試驗的成本與操作的簡易性而選擇60 ℃左右作為適宜的超聲溫度。
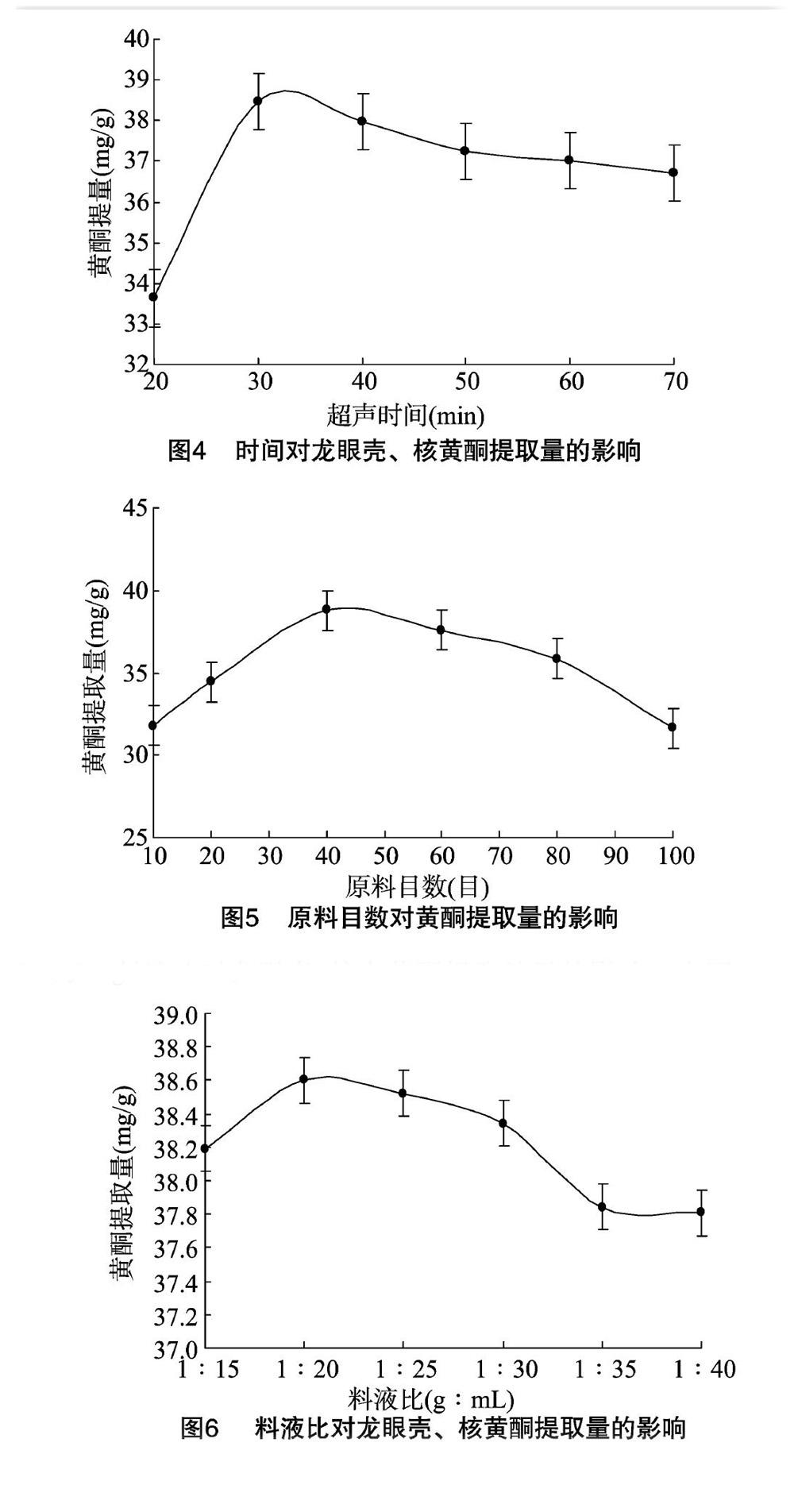
2.1.3 超聲時間對龍眼殼、核黃酮提取量的影響 由圖4可知,黃酮提取量跟隨超聲時間的延長先升高后遲緩下降,超聲時間為 30 min 時黃酮提取量最高。可能是由于時間較短,黃酮類物質溶解不充分,而一定范圍內的延長超聲時間可增加原料與提取液的接觸時間,從而溶解度有所提高,進而增加提取量。當超聲時間過長,黃酮類物質可部分被熱分解,同時原料中的其他醇溶性物質也會被溶解出來,使獲取的黃酮純度下降[16]。因此,超聲時間以30 min左右為宜。
2.1.4 原料目數對龍眼殼、核中黃酮提取量的影響 由圖5可知,隨龍眼殼、核粉碎程度的增大,從龍眼殼、核中能夠提取出的黃酮量先升高后降低,目數為40目時最高。原因可能是目數太小,黃酮類物質不能很好地從原料中溶解出來,一定粒度范圍內,隨粒度的增加,黃酮的溶解性增強,提取量升高。若原料的粒度太小,黃酮物質會更多地在樣品顆粒的表面吸附,能溶解在溶劑中的則變少。因此,原料目數取40目左右較適宜。
2.1.5 料液比對龍眼殼、核中黃酮提取效果的影響 由圖6可知,龍眼殼、核中黃酮提取量隨溶劑用量的增加而升高,在料液比為1 g ∶ 20 mL時,其提取量最大,之后,黃酮提取量逐漸降低。溶劑用量過大時,黃酮提取量降低,導致其他雜質在溶劑中過多溶出的同時影響到黃酮在溶劑中的溶解,由于料液比對黃酮提取量的影響相對較小,因此,料液比固定為 1 g ∶ 20 mL。
2.2 響應面試驗結果與分析
2.2.1 響應面試驗設計與結果 通過以上單因素試驗,利用Box-Behnken中心組合試驗的設計原理,設計了乙醇濃度、超聲溫度、超聲時間、原料目數4因素3水平29個試驗點的響應分析試驗,結果見表2。
2.2.2 回歸模型的建立與分析 利用Design-Expert 8.0軟件進行乙醇濃度、超聲溫度、超聲時間、原料目數4個因素對龍眼殼、核中黃酮提取量的回歸分析,建立四元二次回歸方程:
運用Design Expert軟件對試驗點的響應值進行方差分析,結果見表3。由表3可知,回歸模型是極顯著的(P<0.01),一次項的A及B、C、D 4個因素的二次項和各因素之間的交互作用(BD、CD)對龍眼殼、核中黃酮提取量的影響均達顯著水平(P<0.05)。且此試驗模型的失擬項(P=0.092 9>0.05)為不顯著,顯示此模型的相對誤差較小、擬合度好,因此試驗結果的預測和分析能用該回歸方程來替代真實試驗點分析。由4因素A、B、C、D得出的F值判斷,各因素對龍眼殼、核中黃酮提取量的影響順序為乙醇濃度>超聲溫度>原料目 數> 超聲時間。
2.2.3 多種因素交互作用的響應面圖分析 通過Design-Expert分析獲得龍眼殼、核的黃酮提取量的響應面分析圖,圖7至圖12為交互因素對響應面值的響應曲面及等高線圖。
由圖7-a知,乙醇濃度的響應面曲面較陡,超聲溫度的曲面稍平緩,則顯示出前者對龍眼殼、核中黃酮提取量的影響較大,而后者對其影響稍小;隨乙醇濃度和超聲溫度增大,黃酮提取量增加,當兩者到達某一程度時,其最大,隨后呈下降趨向。圖7-b中等高線圖呈圓形,則乙醇濃度與超聲溫度的交互作用較弱;沿乙醇濃度軸向的等高線較超聲溫度軸向聚集較多,則乙醇濃度比超聲溫度對黃酮提取量的影響相對明顯。
由圖8-a知,乙醇濃度的響應面曲面較陡,超聲時間的響應面曲面較平緩,則顯示出前者對龍眼殼、核中黃酮提取量的影響較大,而后者對其影響稍小;隨超聲時間和乙醇濃度的增長,黃酮提取量增加,當兩者到達某一程度時,其最大,隨后呈下降趨向。圖8-b中等高線圖呈圓形,則超聲時間與乙醇濃度的交互作用較弱;沿乙醇濃度軸向等高線較超聲時間軸向聚集較多,則乙醇濃度比超聲時間對黃酮提取量的影響相對明顯。
由圖9-a知,原料目數的響應面曲面較平緩,乙醇濃度的響應面曲面較陡,則顯示出前者對龍眼殼、核中黃酮提取量的影響小,后者對其影響較大;隨原料目數和乙醇濃度的增長,黃酮提取量增加,當兩者到達某一程度時,其最大,隨后呈下降趨向。圖9-b中等高線圖呈圓形,則原料目數與乙醇濃度的交互作用較弱;沿乙醇濃度軸向的等高線較原料目數軸向聚集較多,則乙醇濃度比原料目數對黃酮提取量的影響相對明顯。
由圖10-a知,超聲時間的響應面曲面稍平緩,超聲溫度的響應面曲面較陡,則顯示出前者對龍眼殼、核中黃酮提取量的影響較小,而后者對其影響較大;隨超聲時間和超聲溫度的增長,黃酮提取量增加,當兩者達到某一程度時,其最大,隨后呈下降趨向。圖10-b中等高線圖呈圓形,則顯示出超聲時間和超聲溫度的交互作用較弱;沿超聲溫度軸向的等高線較超聲時間軸向聚集較多,則超聲溫度比超聲時間對黃酮提取量的影響相對明顯。
由圖11-a知,原料目數與超聲溫度的響應面曲面都較平緩,則顯示出兩者對龍眼殼、核中黃酮提取量的影響都較小;隨兩者的增長,提取量增加,當兩者達到某一程度時,其最大,隨后呈下降趨向。圖11-b中等高線圖呈橢圓形,則原料目數與超聲溫度的交互作用較強;沿超聲溫度軸向的等高線較原料目數軸向聚集較多,則超聲溫度比原料目數對黃酮提取量的影響相對明顯。
由圖12-a知,原料目數與超聲時間的響應面曲面均較平緩,則顯示出兩者對龍眼殼、核黃酮提取量的影響都較小;隨著兩者的增長,提取量增加,當兩者達到某一程度時,其最大,隨后呈下降趨向。圖12-b中等高線為橢圓形,則顯示出原料目數與超聲時間的交互作用較強;沿原料目數軸向的等高線較超聲時間軸向聚集較多,則原料目數比超聲時間對黃酮提取量的影響相對明顯。
綜上所述,對龍眼殼、核中黃酮提取量影響較為明顯得是乙醇濃度和超聲溫度,而超聲時間和原料目數對其影響較小。根據等高線圖中等高線的密集程度及等高線的形狀最終判斷出對龍眼殼、核的黃酮提取量的影響順序為乙醇濃度>超聲溫度>原料目數>超聲時間。
2.3 工藝條件的優化及驗證試驗
通過單因素試驗確定料液比為1 g ∶ 20 mL的條件下,利用回歸模型進行分析得出的龍眼殼、核中黃酮提取最佳工藝為:乙醇濃度63.06%、超聲溫度61.20 ℃、超聲時間 29.69 min、原料目數41.13目,黃酮提取量的理論值為 39.44 mg/g。鑒于試驗操作的實際需要,修訂黃酮提取的最佳工藝為:乙醇濃度63%、超聲溫度61 ℃、超聲時間30 min、原料目數41目。在這個前提做3次平行試驗,得出黃酮提取量的平均實測值為39.10 mg/g,與理論值39.44 mg/g比較接近,表示此試驗得到的回歸方程與真實情況偏差較小,充分證明了該方程的可靠性。
3 結論
本試驗是在進行了5個單因素試驗的基礎上應用響應面分析法設計了4因素3水平試驗,并通過Design-Expert 8.0 軟件進行回歸分析獲得龍眼殼、核的黃酮提取量的最佳提取工藝。在試驗可行性的前提下,確定龍眼殼、核中黃酮提取的最佳提取工藝為:料液比1 g ∶ 20 mL、乙醇濃度63%、超聲溫度61 ℃、超聲時間30 min、原料目數41目,實際黃酮提取量為39.10 mg/g。
參考文獻:
[1]梁 志,黃銀嬌,譚映珊,等. 龍眼殼總黃酮提取工藝研究[J]. 云南化工,2008,35(3):30-32,35.
[2]肖更生,黃儒強,曾慶孝,等. 龍眼核的營養成分[J]. 食品科技,2004,24(1):93-94.
[3]熊 俐,周 健,曹新志,等. 桂圓殼總黃酮的超聲波提取工藝優化及其抑菌效果的研究[J]. 食品與發酵科技,2011,57(4):30-33.
[4]姜莉莉. 淺談黃酮類化合物的提取研究進展[J]. 科教文匯,2011,22(22):105-106.
[5]賢景春,陳美贏. 超聲提取龍眼核總黃酮量的工藝[J]. 食品研究與開發,2010,31(4):5-7.
[6]關愷珍,程軒軒,張旭紅,等. 響應面法優化龍眼核中總黃酮的提取工藝[J]. 今日藥學,2014,8(1):18-22.
[7]周孟清,陳 輝. 微波輔助法提取龍眼殼中黃酮類化合物的研究[J]. 江西飼料,2010,9(5):13-15.
[8]Panyathep A,Chewonarin T,Taneyhill K A,et al. Inhibitory effects of dried longan (Euphoria longana Lam.) seed extract on invasion and matrix metalloproteinases of colon cancer cells[J]. Journal of Agricultural and Food Chemistry,2013,61(15):3631-3641.
[9]Wang H M,Zhang X H,Li Y X,et al. Antitumor activity of a polysaccharide from longan seed on lung cancer cell line A549 in vitro and in vivo[J]. Tumor Biology,2014,35(7):7259-7266.
[10]Yang J B,Yu M Q,Chen W T. Adsorption of hexavalent chromium from aqueous solution by activated carbon prepared from longan seed:kinetics,equilibrium and thermodynamics[J]. Journal of Industrial and Engineering Chemistry,2015,21(8):414-422.
[11]Thitiratsakul B,Anprung P. Prebiotic activity score and bioactive compounds in longan (Dimocarpus longan Lour.):influence of pectinase in enzyme-assisted extraction[J]. Food Science and Technology,2014,51(9):1947-1955.
[12]王 倩,常麗新,賈長虹,等. 超聲波法提取狗棗獼猴桃葉黃酮的工藝[J]. 食品研究與開發,2012,27(2):43-47.
[13]古麗巴哈爾·卡吾力,高曉黎,常占瑛,等. 黑果枸杞總黃酮提取工藝優化及抗氧化活性[J]. 江蘇農業科學,2017,45(22):213-217.
[14]余先純,王向軍. 柚皮黃酮的提取工藝及紅外光譜分析[J]. 江蘇農業科學,2017,45(4):137-139.
[15]常麗新,賈長虹,郁春樂. 響應面優化玉米芯黃酮的提取工藝研究[J]. 食品工業科技,2014,32(2):259-263,290.
[16]夏海濤,劉玉芬,董超男,等. 響應曲面法優化野生馬蘭頭總黃酮的提取工藝[J]. 食品科學,2011,21(24):191-195.

