1株微生物絮凝劑產(chǎn)生菌的分離、鑒定與絮凝劑的成分分析
李娜 范祎立 李雪


摘要:從活性污泥中篩選分離得到產(chǎn)微生物絮凝劑的菌株G1-3。經(jīng)形態(tài)觀察、生理生化特性分析以及基于16S rDNA系統(tǒng)進(jìn)化分析,該菌株鑒定為交替單胞菌屬(Alteromonas)。該菌株能在特定培養(yǎng)基中產(chǎn)生一種白色絮狀沉淀,其產(chǎn)率為2.4 g/L,且該絮狀胞外產(chǎn)物對高嶺土懸液的絮凝率可達(dá)93.06%。經(jīng)呈色反應(yīng)分析,該產(chǎn)物主要成分為多糖和蛋白質(zhì),其中多糖含量為31.38%,蛋白質(zhì)含量為16.52%。通過高效液相色譜分析,該胞外產(chǎn)物主要由天冬氨酸、亮氨酸、谷氨酸等17種氨基酸,以及葡萄糖、核糖、半乳糖等10種單糖組成。
關(guān)鍵詞:微生物絮凝劑;產(chǎn)絮菌;分離;鑒定;成分分析
中圖分類號: X172 ?文獻(xiàn)標(biāo)志碼: A ?文章編號:1002-1302(2019)13-0288-05
絮凝技術(shù)是污水處理中效率高、應(yīng)用廣泛且成本低廉的常用方法之一。在含有懸浮顆粒(>1.0 μm)和膠體物質(zhì)(1.0~1.0 μm)水體的處理過程中,絮凝劑能與這些顆粒物質(zhì)及色素、重金屬離子等污染物結(jié)合,形成較大絮凝體沉降至水底,以凈化水體[1]。而微生物絮凝劑是利用生物技術(shù),通過微生物發(fā)酵、分離提取而得到一種新型、高效、價廉的新型水處理絮凝劑[2]。與傳統(tǒng)絮凝劑相比,微生物絮凝劑的二次污染小、安全性高、易被微生物降解、對環(huán)境友好,應(yīng)用領(lǐng)域比其他絮凝劑寬泛[3],使得其成為當(dāng)下開發(fā)研究的重點。
本研究從活性污泥中篩選出1株生物絮凝劑產(chǎn)生菌 G1-3,該菌在肉湯培養(yǎng)基中產(chǎn)生一種特殊的胞外產(chǎn)物,呈白色絮狀,該產(chǎn)物具有優(yōu)良的絮凝特性。本研究通過形態(tài)特征、生理生化特性及基于16S rDNA系統(tǒng)進(jìn)化分析,對該菌進(jìn)行菌株鑒定,并對白色絮狀沉淀物進(jìn)行成分分析,旨在為微生物絮凝劑提供一種新材料,擴(kuò)大應(yīng)用范圍。
1 材料與方法
1.1 材料
1.1.1 菌株 絮凝劑產(chǎn)生菌G1-3,由筆者所在實驗室從活性污泥中分離、篩選所得,由中國微生物菌種保藏管理委員會普通微生物中心(CGMCC)保藏,編號為CGMCC No:14457。
1.1.2 培養(yǎng)基 肉湯培養(yǎng)基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,固體培養(yǎng)基瓊脂添加量為20.0 g,H2O 1 000 mL,pH值為7.2~7.4,121 ℃滅菌20 min。
PDA固體培養(yǎng)基:去皮馬鈴薯200.0 g,葡萄糖20.0 g,瓊脂20.0 g,H2O 1 000 mL,pH值自然,121 ℃條件下滅菌 20 min。
1.2 方法
1.2.1 微生物絮凝劑產(chǎn)生菌的篩選 取天津市某污水處理廠的活性污泥,取合適濃度的經(jīng)無菌水稀釋的稀釋液分別在肉湯固體培養(yǎng)基和PDA固體培養(yǎng)基平板上涂布,于37 ℃培養(yǎng)24 h。挑選其中形態(tài)各異的單菌落進(jìn)行分離純化,將純化后的菌株接種于100 mL肉湯培養(yǎng)基中,于37 ℃、200 r/min搖床培養(yǎng)20 h,備用。
在100 mL量筒內(nèi)加入0.4 g高嶺土、4 mL 1%的CaCl2溶液、2 mL菌株發(fā)酵液,在200 r/min轉(zhuǎn)速快速攪拌5 min,然后80 r/min,慢速攪拌10 min,靜置一段時間,測上清液在 550 nm 處的吸光度,根據(jù)吸光度計算絮凝率。計算公式為
μ=(A-B)/A×100%。
其中,μ表示絮凝率,A表示參照上清液的濁度,B表示加入發(fā)酵液絮凝之后上清液的濁度[4]。
1.2.2 菌株形態(tài)觀察 將菌株接種于肉湯固體培養(yǎng)基上,通過3區(qū)劃線得單菌落,觀察其形態(tài)。
掃描電鏡下觀察菌株G1-3的微觀形態(tài):2.5%戊二醛固定,0.1 mol/L PBS清洗3~4次,1% OsO4固定,0.1 mol/L PBS清洗3~4次,分別用50%、70%、80%、90%、100%乙醇,體積比為2 ∶ 1的乙醇與醋酸戊酯、體積比為1 ∶ 1的乙醇與醋酸戊酯依次脫水,純戊酯脫水30 min,臨界點干燥,噴金,于掃描電鏡下觀察[5]。
1.2.3 胞外絮狀產(chǎn)物成分分析 樣品的多糖定性采用莫氏試驗、斐林試驗,蛋白質(zhì)定性采用茚三酮試驗、雙縮脲反應(yīng),糖的定量測定采用苯酚-硫酸法,蛋白質(zhì)定量測定采用考馬斯亮藍(lán)法,具體操作參見文獻(xiàn)[6]。
1.2.4 高效液相色譜分析氨基酸與單糖 發(fā)酵液中的白色絮狀物5 000 r/min離心經(jīng)3次無菌水離心、洗滌,用真空冷凍干燥器干燥,取固體,經(jīng)水解預(yù)處理后,采用高效液相色譜法分析其中的氨基酸與單糖組成。
1.2.4.1 單糖組成測定 稱取凍干的樣品2 mg,加入 2 mol/L 三氟乙酸溶液0.5 mL,在120 ℃條件下水解 120 min,氮吹儀吹干。向水解干燥后得到的單糖樣品中加入溶于無水甲醇、0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)試劑和0.3 mol/L NaOH溶液各0.5 mL,充分混勻后,水浴70 ℃反應(yīng)30 min。冷卻至室溫,加入0.3 mol/L HCl 0.5 mL,充分混勻,加入0.5 mL氯仿,充分震蕩萃取,離心后用0.22 μm濾膜過濾后上機(jī)。
1.2.4.2 氨基酸組成測定 取一定質(zhì)量樣品于20 mL水解管中,加入16 mL 6 mol/L的鹽酸溶液,真空脫氣30 min,充氮封管,110 ℃下水解22~24 h,冷卻后定容至50 mL。取1 mL水解液于小瓶中,真空脫酸抽干,加入1 mL 0.02 mol/L 鹽酸溶液,充分溶解。精密量取上述溶液 500 μL,置于5 mL塑料離心管中,加入1 mol/L三乙胺乙腈溶液250 μL,混勻,加入0.1 mol/L異硫氰酸苯酯乙腈溶液 25 μL,混勻,室溫放置1 h后,加2 mL正己烷,劇烈振搖,放置10 min,取下層溶液用0.22 μm的水相膜濾膜過濾后上機(jī)分析。
2 結(jié)果與分析
2.1 菌株的分離
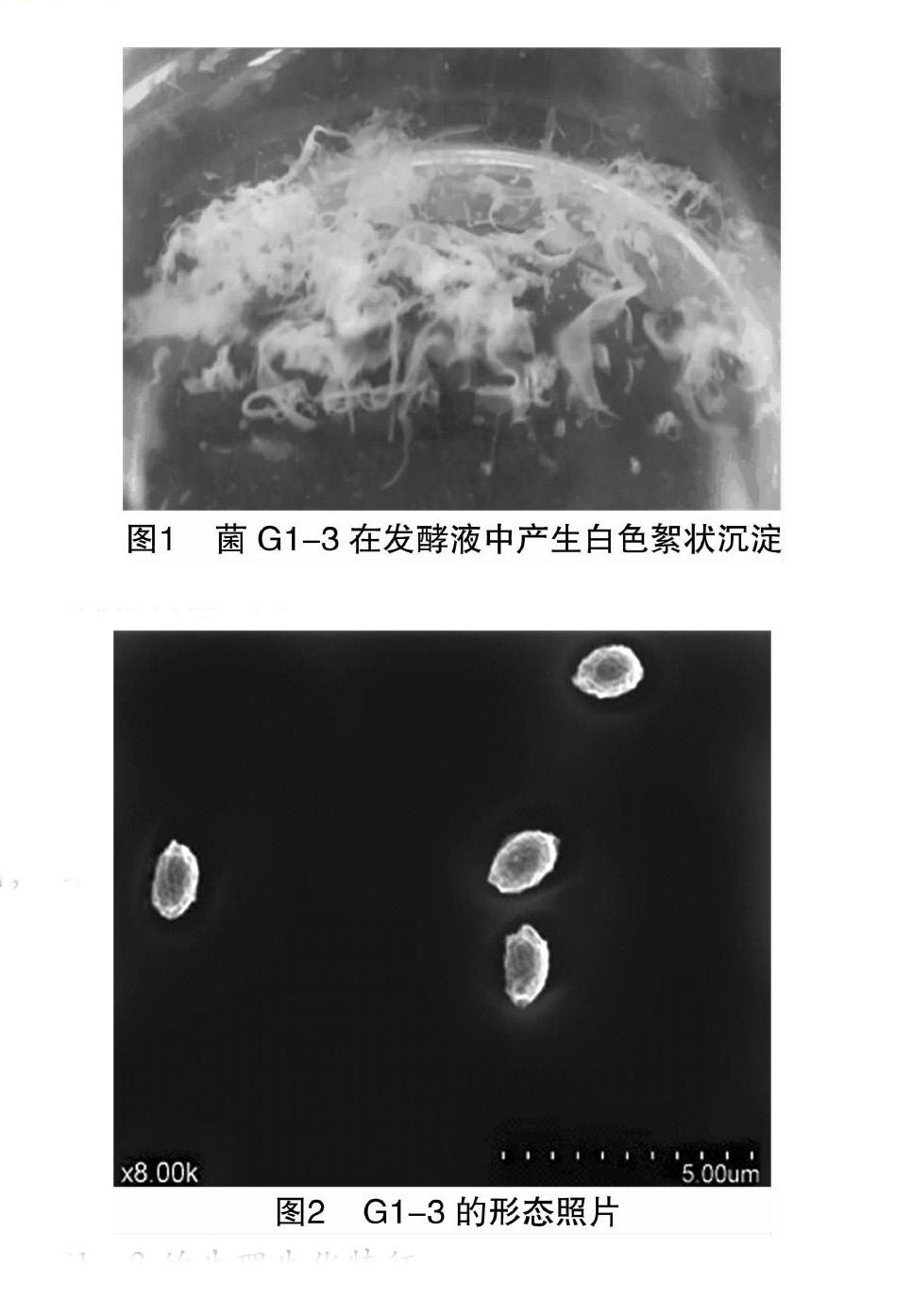
經(jīng)固體平板劃線分離,從活性污泥中得到5株菌株,經(jīng)純化、培養(yǎng)后,發(fā)現(xiàn)其中1株菌能在液體培養(yǎng)基中產(chǎn)生一種白色絮狀沉淀(圖1)。以對高嶺土懸濁液的絮凝活性為指標(biāo),該絮狀沉淀的絮凝率可達(dá)93.2%,且該菌絮凝特性穩(wěn)定,將該菌命名為G1-3。
2.2 形態(tài)觀察
G1-3菌株在肉湯固體培養(yǎng)基上呈白色圓形不透明菌落,其表面光滑、有黏性、邊緣整齊,菌落大小為1~2 d/mm。通過掃描電鏡觀察菌株G1-3表面形態(tài)呈橢圓狀,一端較圓,一端較尖(圖2)。
2.3 G1-3的生理生化特征
對菌株G1-3進(jìn)行生理生化分析,根據(jù)VITEK全自動微生物檢測系統(tǒng)的分析,菌株G1-3的生理生化特征見表1。菌G1-3可利用葡萄糖為唯一碳源生長,但不能利用麥芽糖、蔗糖、甘露糖、阿拉伯糖等作為唯一碳源生長;在生長過程中,能產(chǎn)生H2S,且L-脯氨酸芳胺酶、L-蘋果酸鹽同化為陽性。鑒定結(jié)果表明,G1-3菌株的形態(tài)和生理生化特性與交替單胞菌屬較為一致。
2.4 16S rDNA序列測序
對菌株G1-3測序,經(jīng)過提取DNA、PCR擴(kuò)增、連接轉(zhuǎn)化等操作,應(yīng)用BLAST程序、NCBI數(shù)據(jù)庫里的信息進(jìn)行同源性搜索,進(jìn)行分子生物學(xué)鑒定,繪制出系統(tǒng)進(jìn)化樹見圖3。根據(jù)Blast結(jié)果,G1-3屬于γ-變形菌綱(Gammaproteo bacteria)交替單胞菌屬(Alteromonadales),與Alteromonadales bacterium DN3-1親源關(guān)系最近。
2.5 G1-3菌株的生長特性
將菌株G1-3接種至100 mL肉湯培養(yǎng)基中,于 200 r/min 3 ℃條件培養(yǎng),測定菌株G1-3菌體在2、4、6、8、10、12、24 h的生長情況。根據(jù)發(fā)酵液在波長600 nm處的吸光度,制得該菌株生長曲線,由圖4可知,G1-3僅培養(yǎng) 6 h就呈現(xiàn)指數(shù)生長,培養(yǎng)至18 h達(dá)到穩(wěn)定期。
采用干重法,測定菌株G1-3菌體在肉湯培養(yǎng)基中生長2、4、6、8、10、12、24 h時菌株胞外絮狀產(chǎn)物的產(chǎn)量。胞外產(chǎn)物較菌株生長晚2 h,培養(yǎng)至8 h時開始快速生成,而至22 h就基本停止,產(chǎn)量在此時達(dá)最高,為2.4 g/L。且當(dāng)培養(yǎng)超過 48 h 時,發(fā)酵液中無該白色絮狀物,該胞外產(chǎn)物被分解。
2.6 絮凝率測定
根據(jù)來源不同,生物絮凝劑可分為3類[7]:微生物細(xì)胞,如某些細(xì)菌、酵母;微生物細(xì)胞提取物,如酵母細(xì)胞壁的葡聚糖;微生物細(xì)胞代謝產(chǎn)物。為探究該菌株絮凝活性成分的分布情況,對比發(fā)酵液、胞外絮狀產(chǎn)物、菌細(xì)胞懸液、去菌體上清液對高嶺土懸濁液的絮凝效果。由圖6可知, 胞外產(chǎn)物對高
嶺土的絮凝效率高達(dá)93.06%,而發(fā)酵液原液只有 65.48%,菌細(xì)胞懸液以及去菌體上清液的絮凝率僅為10%左右,這充分說明G1-3菌株的絮凝特性與菌體細(xì)胞無關(guān),主要由其細(xì)胞代謝產(chǎn)物產(chǎn)生。
該絮凝菌產(chǎn)生的生物絮凝劑為白色絮狀物,存在于菌體外的培養(yǎng)液中,由微生物分泌到胞外。根據(jù)絮凝機(jī)理,這些胞外產(chǎn)物可能與水中的雜質(zhì)通過吸附架橋作用、電中和作用、卷掃作用等[8-10]對水中雜質(zhì)進(jìn)行絮凝沉降,以達(dá)到水質(zhì)澄清目的。
2.7 成分分析
2.7.1 外形觀察 G1-3菌株的白色絮狀物在培養(yǎng)過程中,沉淀聚集在一起,肉眼觀察為半透明膜狀(圖7)。經(jīng)真空冷凍干燥后,呈乳白色疏松層疊狀,在電子顯微鏡下進(jìn)行掃描觀察,可以觀察到絮凝物質(zhì)呈現(xiàn)折疊膜狀結(jié)構(gòu)(圖8)。
2.7.2 蛋白質(zhì)與糖定性定量分析 根據(jù)文獻(xiàn)報道,當(dāng)下生物絮凝劑的化學(xué)組成可分為以下幾類[11]:糖類物質(zhì),多肽、蛋白質(zhì)和DNA,脂類物質(zhì),目前已發(fā)現(xiàn)的以多糖類物質(zhì)為主,脂類最少。為探究G1-3菌株胞外絮狀產(chǎn)物的成分,對其進(jìn)行分析。蛋白質(zhì)定性試驗時,樣品在茚三酮試驗中出現(xiàn)藍(lán)紫色,結(jié)果呈陽性;且在雙縮脲試驗中,出現(xiàn)紫玫瑰色,呈陽性,確定G1-3胞外絮狀物中含有蛋白質(zhì)。糖定性試驗時,樣品在莫氏試驗中出現(xiàn)紫紅色環(huán),為陽性,在斐林試驗中,無紅色或黃色的氧化亞銅沉淀生成,可認(rèn)定該G1-3胞外絮狀產(chǎn)物中含有多糖,但還原糖含量微弱。
根據(jù)考馬斯亮藍(lán)試驗結(jié)果,測定樣品中蛋白質(zhì)含量為16.52%;根據(jù)苯酚-硫酸試驗,測定其總糖含量為31.38%。上述結(jié)果表明,該產(chǎn)物以糖類物質(zhì)為主。
2.7.3 氨基酸與單糖的分析 樣品經(jīng)水解預(yù)處理后,通過高效液相色譜分析其氨基酸含量(表2)。經(jīng)水解后,發(fā)現(xiàn)該胞外產(chǎn)物含有17種氨基酸,其中天冬氨酸含量最高,達(dá) 1.993 g/kg,而亮氨酸和谷氨酸分別為1.908、1.760 g/kg,精氨酸、丙氨酸、脯氨酸、甘氨酸和苯丙氨酸的含量均達(dá) 1.000 g/kg 以上。
采用高效液相色譜分析單糖含量,由表3可知,經(jīng)水解后,發(fā)現(xiàn)該胞外產(chǎn)物含有10種單糖,以葡萄糖、核糖、半乳糖為主,其含量明顯高于其他糖類,葡萄糖含量高達(dá) 428.37 mg/kg,而核糖與半乳糖含量分別為 270.59、224.95 mg/kg。
3 結(jié)論
從活性污泥中分離得到1株生物絮凝劑產(chǎn)生菌 G1-3,經(jīng)形態(tài)特征、生理生化特性和16S rDNA基因序列鑒定,其屬于交替單胞菌屬(Alteromonadales)。
關(guān)于G1-3菌株絮凝活性成分的分布,以高嶺土絮凝率為指標(biāo),其胞外產(chǎn)物絮凝率為93.06%,其發(fā)酵液原液絮凝率較低,且菌細(xì)胞懸液以及去菌體上清液無絮凝特性。
生物絮凝劑的化學(xué)性質(zhì):茚三酮顯色試驗呈藍(lán)色,雙縮脲反應(yīng)呈陽性;莫氏反應(yīng)中濃硫酸與樣品試劑混合液分界面有清晰的紫環(huán)出現(xiàn)。表明G1-3菌株的胞外絮狀產(chǎn)物中含有多糖和蛋白質(zhì),根據(jù)試驗,多糖含量明顯高于蛋白質(zhì)含量,糖與蛋白質(zhì)比為1.9 ∶ 1。
G1-3菌株的白色絮狀產(chǎn)物經(jīng)分離、真空冷凍干燥后,呈乳白色疏松層疊狀,經(jīng)高效液相色譜分析,該白色絮狀沉淀中含17種氨基酸,以天冬氨酸、亮氨酸、谷氨酸、精氨酸為主,含10種單糖,以葡萄糖、核糖、半乳糖為主。
參考文獻(xiàn):
[1]封 培,王世梅,周立祥. 生物絮凝劑產(chǎn)生菌的分離鑒定及其在飲用水除濁上的作用[J]. 環(huán)境科學(xué)學(xué)報,2009,29(8):1666-1671.
[2]趙 鳳,張蔚萍,胡慶華. 微生物絮凝劑的絮凝機(jī)理及應(yīng)用研究[J]. 環(huán)境與可持續(xù)發(fā)展,2009(2):6-8.
[3]孫鵬軒. 微生物絮凝劑的研究進(jìn)展及應(yīng)用現(xiàn)狀[J]. 環(huán)境保護(hù)與循環(huán)經(jīng)濟(jì),2013(1):53-55.
[4]王 雪. 生物絮凝劑混菌發(fā)酵條件優(yōu)化及動力學(xué)分析[D]. 哈爾濱:哈爾濱工業(yè)大學(xué),2009.
[5]孫鎮(zhèn)平,李 佳,劉洪紅,等. 不同處理技術(shù)對環(huán)境掃描電鏡下細(xì)菌原始形態(tài)的影響[J]. 揚(yáng)州大學(xué)學(xué)報(農(nóng)業(yè)與生命科學(xué)版),2013(1):41-43.
[6]王 薇. 產(chǎn)絮菌合成生物絮凝劑特性及絮凝成分解析[D]. 哈爾濱:哈爾濱工業(yè)大學(xué),2009.
[7]馬 放,段姝悅,孔祥震,等. 微生物絮凝劑的研究現(xiàn)狀及其發(fā)展趨勢[J]. 中國給水排水,2012,28(2):14-17.
[8]董曉斌. 新型生物絮凝劑的研究與應(yīng)用[J]. 甘肅聯(lián)合大學(xué)學(xué)報(自然科學(xué)版),2006,20(1):52-54.
[9]Li Y M,Li Q,Hao D K,et al. Characterization and flocculation mechanism of an alkali-activated polysaccharide flocculant from Arthrobacter sp. B4[J]. Bioresource Technology,2014,170:574-577.
[10]Kumar C G,Joo H S,Choi J W,et al. Purification and characterization of an extracellular polysaccharide from haloalkalophilic Bacillus sp. I-450[J]. World Journal of Microbiology and Biotechnology,2004,34:673-681.
[11]王 蘭,唐 靜,趙 璇. 微生物絮凝劑絮凝機(jī)理的研究方法[J]. 環(huán)境工程學(xué)報,2011,5(3):481-488.

