p53蛋白O-乙酰氨基葡萄糖修飾介導宮頸癌細胞的順鉑耐藥
王漪 陳必良
空軍軍醫大學第一附屬醫院西京醫院婦產科(西安710032)
癌細胞營養消耗增高導致細胞代謝失調是腫瘤的重要特征。在腫瘤細胞中,氨基己糖合成途徑代謝異常活躍,利用葡萄糖、谷氨酰胺、乙酰輔酶A 和尿苷三磷酸最終生成尿苷二磷酸乙酰氨基葡萄糖(UDP-GlcNAc)[1]。進一步的,在β-N-乙酰葡萄糖胺糖基轉移酶(O-GlcNActransferase,OGT)作用下,將O-乙酰氨基葡萄糖(O-linked-β-Nacetylglucosomaine,O-GlcNAc)從UDP-GlcNAc 轉移至蛋白質的絲氨酸或蘇氨酸殘基,導致一種蛋白翻譯后修飾,稱為O-GlcNAc 糖基化修飾[2]。另一方面,β-N-乙酰葡萄糖胺糖苷水解酶(O-GlcNAcase,OGA)負責將蛋白質O-GlcNAc 糖基化移除。O-GlcNAc 糖基化修飾在腫瘤發生、發展中的作用越來越多的被報道。近來研究[3]發現,在乳腺癌、結直腸癌、胰腺癌、肝癌和肺癌中,O-GlcNAc 糖基化水平均明顯升高。O-GlcNAc 糖基化可以促進胰腺癌細胞增殖,并能夠增強乳腺癌細胞的侵襲和轉移[4-5]。除此之外,在肺癌中,O-GlcNAc 糖基化水平升高能夠促進腫瘤的生長[6]。有報道[7]顯示,原癌基因和抑癌基因的O-GlcNAc 糖基化修飾在促進腫瘤生長中也發揮了重要作用,如p53。已有研究[8]顯示,在宮頸癌細胞中高表達OGT 可導致癌基因蛋白E6 和E7 表達增加,而干擾OGT 表達則可抑制宮頸癌細胞增殖、侵襲和轉移。近來,有研究[9]顯示NF-κB 蛋白的O-GlcNAc 糖基化可以促進宮頸癌細胞的肺轉移,而抑制AMPK 的O-GlcNAc 糖基化則可導致宮頸癌細胞死亡[10-12]。因此,O-GlcNAc 糖基化在宮頸癌細胞的增殖、侵襲和轉移,以及臨床耐藥性中可能發揮重要作用。盡管如此,作為一種重要的抑癌基因蛋白,p53 的O-GlcNAc 糖基化修飾與宮頸癌進展的關系,及其對宮頸癌細胞的增殖、凋亡和耐藥性的影響尚未有研究。因此,本研究旨在研究揭示p53 O-GlcNAc 糖基化水平與宮頸癌進展的關系,以及p53 O-GlcNAc 糖基化在宮頸癌細胞增殖和凋亡,特別是順鉑抗性中的作用。
1 材料和方法
1.1 臨床樣本收集本院宮頸癌I 期(CA I)臨床標本8 例,宮頸癌Ⅱ期(CAⅡ)標本8 例,宮頸上皮內瘤樣病變Ⅲ級(CINⅢ)標本8 例,宮頸癌旁組織(CON)標本8 例,-80 ℃保存,用于后續免疫組化和Western Blot 檢測。在患者知情同意下獲取臨床樣本,實驗獲得本單位倫理委員會審批支持(批件號KY20163089-1)。
1.2 細胞培養和處理人宮頸癌C-33A 細胞購于中國科學院上海生命科學研究院細胞資源中心,采用MEM-EBSS 培養基(Gibco,美國)培養,加入10%胎牛血清(Hyclone,美國)和1%青鏈霉素,37 ℃培養于5% CO2培養箱。細胞分為對照組(CON)、順鉑(DDP)處理組,順鉑和OGA 抑制劑TMG 處理組(DDP+TMG)、順鉑和OGT siRNA 干擾組(DDP+si-OGT)。順鉑(Biovision,美國)處理濃度50 μmol∕L,TMG(MCE,美國)濃度10 μmol∕L,均處理24 h。
1.3 siRNA 轉染人OGT 特異性siRNA 購買于Santa Cruz 公司(美國)。將C-33A 細胞接種于6 孔板,待細胞生長至60%~80%融合時進行siRNA 轉染。5 μL 的siRNA 加入100 μL 轉染培養基(Santa Cruz)混勻;另5 μL 的轉染試劑(Santa Cruz)加入100 μL 的轉染培養基混勻,將2 種液體混勻,室溫孵育45 min。用轉染培養基洗滌細胞,加入0.8 mL∕孔的轉染培養基,加入上述siRNA 混合液,37 ℃培養6 h 后換正常培養基,繼續培養24 h 后進行后續實驗。
1.4 免疫組化宮頸組織冰凍切片,厚度6 μm,室溫固定,蒸餾水漂洗后3% H2O2室溫孵育30 s。羊血清(中杉金橋,中國)室溫封閉1 h,滴加glycosylated p53 抗體(Detroit R&D,美國)(1∶100),4 ℃孵育過夜。PBS 沖洗后,滴加生物素標記山羊抗小鼠二抗(1∶1000,碧云天,中國),37 ℃孵育1 h。PBS 沖洗后,DAB 顯色后封片。
1.5 Western Blot凍存的宮頸組織和細胞加入RIPA 裂解液(碧云天)裂解,20 000 g,4 ℃離心,收取上清蛋白。SDS-PAGE 凝膠電泳后,250 mA、100 min 轉至PVDF 膜。glycosylated p53 一抗(1∶1 000)、p53 一抗(1∶1 000,碧云天)、OGT 一抗(1∶1 000,Abcom,美國)和Cleaved Capase-3 一抗(1∶1 000,Abcom)4 ℃孵育過夜。辣根過氧化物酶標記羊抗兔二抗(1∶1 000,碧云天)室溫孵育1 h。加入化學發光試劑,凝膠成像系統(Bio-Rad,美國)中曝光檢測。
1.6 細胞增殖采用CCK-8 試劑盒(同仁化學,日本)檢測細胞增殖。在細胞處理24 h 后,按照說明書進行細胞增殖檢測。
1.7 統計學方法數據表示為均數± 標準差。使用GraphPad Prism 5.0 軟件進行統計分析,多組間比較采用單因素方差分析,跟以Newman-Keuls分析檢測兩兩組間差異。以P值小于0.05 為差異具有統計學意義。
2 結果
2.1 宮頸癌組織中OGT 表達和p53 糖基化水平升高采用免疫組化檢測不同宮頸組織中p53 糖基化水平。由圖1A 可見,與癌旁組織相比,宮頸上皮內瘤樣病變Ⅲ級(CINⅢ)組織內已可見p53糖基化水平的明顯升高。宮頸癌組織內(CAⅠ,CAⅡ)p53 糖基化水平呈進一步增高趨勢,并隨著宮頸癌分期進展,p53 糖基化水平呈進行性增高。進一步地,western blot 結果顯示,與對照組相比,CINⅢ組織內OGT 表達已有顯著增加,而宮頸癌組織OGT 蛋白表達隨病理分期進展進行性升高(P<0.05)(圖1B)。此結果表明,在癌前病變的CINⅢ級組織內,OGT 表達增加和p53 糖基化水平升高已經出現,宮頸癌組織內p53 糖基化水平與癌癥進展呈正相關,并可能源于OGT 表達增加導致的O-GlcNAc 糖基化。見圖1。

圖1 不同宮頸組織中p53 糖基化水平和OGT 表達變化Fig.1 The levels of p53 O-GlcNAcylation and OGT expression in different cervical tissues
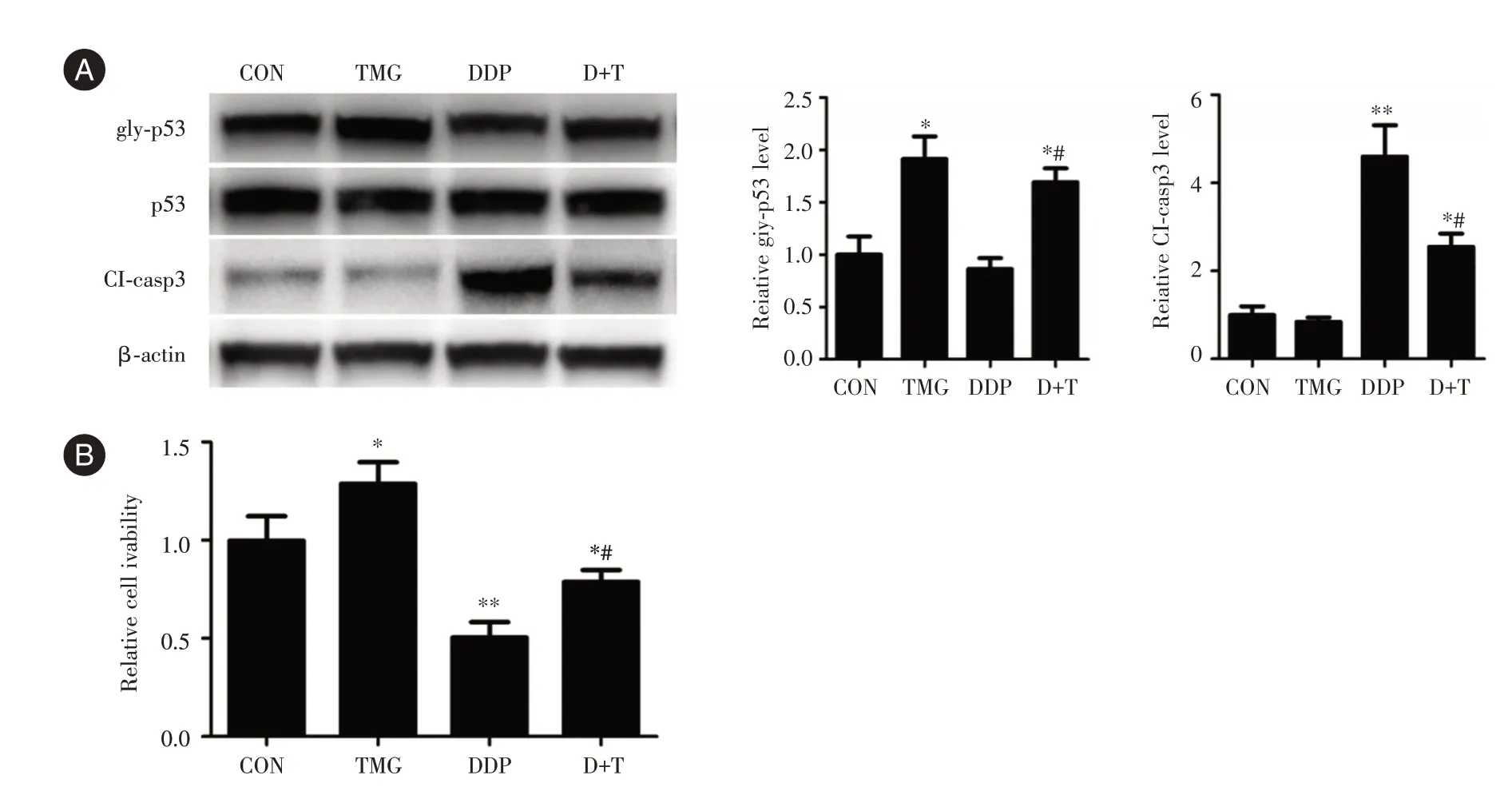
圖2 TMG 所致p53 O-GlcNAc 糖基化介導宮頸癌細胞順鉑抗性Fig.2 p53 O-GlcNAcylation induced by TMG increased the resistance of cervical cancer cells to cisplatin
2.2 p53 蛋白O-GlcNAc 糖基化引起宮頸癌細胞順鉑抗性增強采用OGA 特異抑制劑TMG 處理C-33A 細胞,抑制O-GlcNAc 糖基化去除活性,引起p53 O-GlcNAc 糖基化(gly-p53)水平升高(圖2A)。同樣,TMG 復合順鉑處理組(D+T)p53 糖基化水平較DDP 單獨處理組增高(圖2A)。DDP 處理引起C-33A 細胞caspase-3 剪切形式(Cl-Casp3)增加,而TMG 干預則降低了DDP 引起的caspase-3 剪切活化(圖2A)。此結果表明,p53 的O-GlcNAc 糖基化可拮抗DDP 導致的宮頸癌細胞凋亡。CCK-8 細胞活力檢測結果顯示,DDP 處理導致了宮頸癌細胞活力降低,TMG 復合處理則可逆轉順鉑引起的宮頸癌細胞活力降低(圖2B)。見圖2。
2.3 抑制p53 蛋白O-GlcNAc 糖基化增強宮頸癌細胞順鉑敏感性為進一步明確O-GlcNAc 糖基化p53 在順鉑所致宮頸癌細胞凋亡中的作用,采用siRNA 對C-33A 細胞OGT 表達進行干擾。結果顯示,siRNA 干擾OGT(si-OGT)顯著降低了對照組和實驗組細胞p53 的O-GlcNAc 糖基化水平(圖3A)。DDP 處理顯著增加了宮頸癌細胞caspase-3 剪切體表達,而si-OGT 則進一步增強了DDP 所致的C-33A 細胞caspase-3 剪切活化(圖3A)。細胞活力檢測發現,si-OGT 引起了DDP 所致的細胞活力下降進一步降低(圖3B)。這些結果表明,p53 的O-GlcNAc 糖基化水平降低可增強DDP 對宮頸癌細胞的致凋亡作用。見圖3。
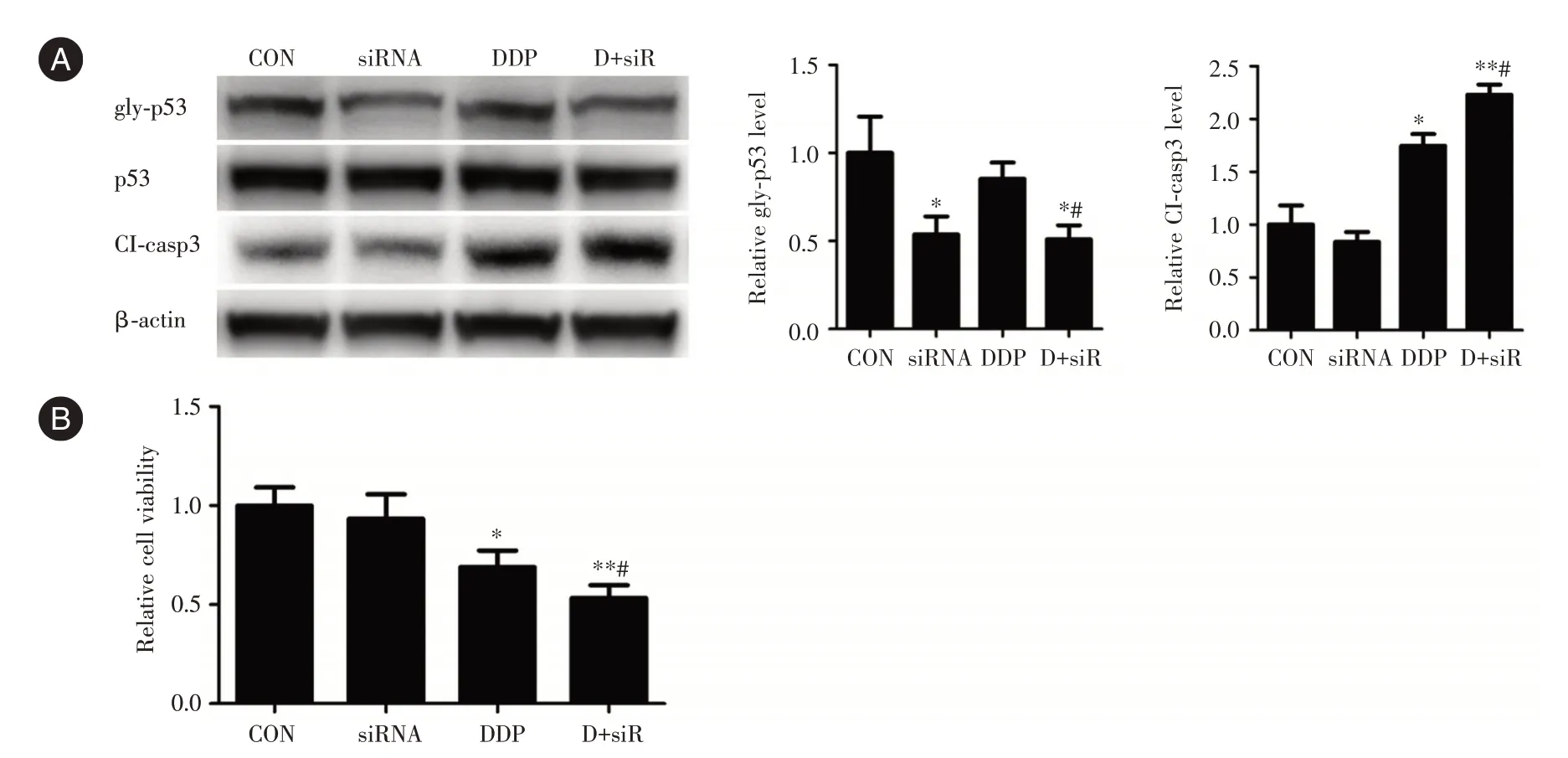
圖3 OGT 表達抑制降低p53 O-GlcNAc 糖基化并增強順鉑對宮頸癌細胞作用Fig.3 Inhibition of OGT decrease p53 O-GlcNAcylation and enhance effects of cisplatin on cervical cancer cells
3 討論
宮頸癌是女性生殖系統最常見惡性腫瘤,位于女性最常見癌癥死因的第4 位[13]。手術清除輔助同步放化療是目前宮頸癌的標準治療方法,晚期宮頸癌的傳統治療策略是放療聯合順鉑化療[14]。順鉑是宮頸癌常用一線化療藥物,然而宮頸癌細胞容易對順鉑產生耐藥性,最終導致腫瘤復發,化療失敗[15]。因此,更深入理解化療時宮頸癌細胞凋亡抵抗的分子機制,有助于鑒別宮頸癌新的潛在治療靶點,改善治療效果。
近來,在多種腫瘤中均發現了O-GlcNAc 糖基化水平升高(hyper-O-GlcNAcylation),如乳腺癌、結直腸癌、胰腺癌、肝癌和肺癌,并在腫瘤發生和進展中發揮作用[3,16]。研究[9]顯示,多個分子的O-GlcNAc糖基化參與了腫瘤進展,如NF-κB 的O-GlcNAc 糖基化可促進宮頸癌細胞的肺轉移。此外,熱休克蛋白27(Hsp27)的O-GlcNAc 糖基化修飾可促使MCF-7 細胞的惡性轉化[17]作為重要的抑癌蛋白,p53 已被證實在卵巢細胞中可被O-GlcNAc 糖基化修飾調控,并參與卵巢癌細胞生長和周期調節[18]。然而,p53 在宮頸癌的表達,及其在宮頸癌發生發展中的作用尚未見報道。本研究發現,在宮頸癌組織中,p53 糖基化水平升高,并與宮頸癌病理分級呈正相關。OGT 表達的同步升高表明p53 O-GlcNAc 糖基化在宮頸癌病情發展中可能發揮了重要作用。本研究結果提示了p53 O-GlcNAc糖基化和OGT 抑制作為宮頸癌臨床輔助治療的潛在可能。
O-GlcNAc 糖基化與腫瘤細胞的凋亡密切相關。在胰腺癌細胞中,高O-GlcNAc 糖基化顯示出抗凋亡特性,并使NF-κB持續保持高活性。另一個研究[19]顯示,在乳腺癌細胞中抑制OGT 活性,則可促進乳腺癌細胞的凋亡,表明高O-GlcNAc 糖基化阻止了乳腺癌細胞的凋亡。另一方面,O-GlcNAc糖基化還被證實可促進癌細胞增殖。腫瘤抑制因子FOXO3 的O-GlcNAc 糖基化引起了人胰腺癌細胞的異常增殖,這種促增殖作用源于FOXO3的O-GlcNAc 糖基化阻斷了p53 的調控作用[20]。在肝癌細胞中,β-連環蛋白(beta-catenin)發生O-GlcNAc 糖基化導致了肝癌細胞的增殖、克隆形成,并抑制了肝癌細胞凋亡[21]。p53 在細胞中發揮多種重要調控作用,如細胞周期進程、DNA 損傷反應、細胞衰老和誘導凋亡。本研究發現,p53 蛋白O-GlcNAc 糖基化導致了宮頸癌細胞凋亡減少和增殖能力升高,并可阻斷順鉑引起的宮頸癌細胞凋亡和增殖降低。與本研究結果一致,在肺癌細胞的研究也證實,肺癌細胞的順鉑抗性與O-GlcNAc糖基化p53 有關[2]。這些結果表明,p53 O-GlcNAc糖基化可能是宮頸癌細胞發生順鉑化療耐藥的重要原因,為改善宮頸癌化療耐藥提供了一個可能靶標。
通常情況下,p53 在E3 泛素連接酶MDM-2 作用下發生泛素化,經蛋白酶體催化降解。有研究顯示,在細胞中過表達OGT 可導致MDM-2 表達和磷酸化水平的升高[18]。此結果表明,p53 的O-GlcNAc 糖基化可能通過促進p53 的泛素蛋白酶體降解,進而促進了宮頸癌細胞的增殖并降低凋亡發生。肺癌細胞中p53 的O-GlcNAc 糖基化可促進p53 蛋白的泛素化和蛋白酶體水解[2]。然而,在乳腺癌細胞中的研究顯示,p53 在Ser 149 位點的O-GlcNAc 糖基化促進了p53 蛋白的穩定[21]。并且,另一研究顯示O-GlcNAc 糖基化可穩定并激活p53 途徑,促進卵巢癌細胞增殖[18]。這種差異可能源于不同位點O-GlcNAc 糖基化的作用不同,因為p53 含有多個O-GlcNAc 糖基化位點[20]。并且上述O-GlcNAc 糖基化對p53 的穩定作用主要通過降低Thr155 的磷酸化而實現,但順鉑的主要作用位點為Ser15[2]。盡管如此,p53 O-GlcNAc 糖基化在宮頸癌發生發展中的作用,特別是其發生位點和機制應被進一步研究探索,為解決宮頸癌化療耐藥性提供更準確的目標[22]。

