基于可視化環介導等溫擴增技術快速檢測金黃色葡萄球菌
郭建平,萬佳佳,陸兆新,呂鳳霞,張 充,趙海珍,別小妹*
(南京農業大學食品科技學院,江蘇 南京 210095)
金黃色葡萄球菌(Staphylococcus aureus)是一種主要的食源性致病菌[1],可產生多種腸毒素,引起食物中毒。消毒雖然可以殺滅金黃色葡萄球菌,卻并不能完全破壞其分泌的毒素。金黃色葡萄球菌易污染肉、奶及其制品等食品[2-3],人們如果誤食這些污染過的食品,會出現腹瀉、嘔吐等食物中毒反應,嚴重者可能會導致死亡。金黃色葡萄球菌引起的食品安全事件[4-6]時有發生,給人們的生命安全帶來嚴重的威脅,對經濟生產造成嚴重的損害,因此做好致病菌的檢測顯得尤為重要。
GB 4789.10—2016《食品微生物學檢驗 金黃色葡萄球菌檢驗》中規定的金黃色葡萄球菌檢測方法[7]周期較長,不利于食品中金黃色葡萄球菌的快速檢測,且較長的檢測周期會對經濟生產活動造成一定的影響。聚合酶鏈式反應(polymerase chain reaction,PCR)分子檢測技術的發展[8]使得金黃色葡萄球菌的檢測周期大大縮短,但是PCR檢測需要昂貴的儀器,所以PCR技術在條件和技術相對落后的地區,仍不能滿足基層對金黃色葡萄球菌檢測的需求。
環介導等溫擴增(loop-mediated isothermal amplification,LAMP)技術是由日本科學家Notomi等[9]率先建立的新型體外擴增DNA技術,得益于它特殊的擴增原理,使其具備耗時短、高特異性、高靈敏度、不依賴精密儀器、便捷準確等顯著優勢。LAMP反應結果主要是通過凝膠電泳法、沉淀法、顯色法等方法進行檢測[10]。Tomita等[11]通過將鈣黃綠素加入到LAMP反應體系中,建立了一種可以不開蓋檢測LAMP反應結果的技術。Goto等[12]建立了另外一種可視化LAMP檢測方法,通過向LAMP反應體系中添加羥基萘酚藍(hydroxynaphthol blue,HNB)達到可視化檢測LAMP反應結果,且添加HNB的LAMP反應體系的反應靈敏度較添加鈣黃綠素的LAMP反應體系高出10 倍,主要是由于鈣黃綠素對LAMP反應有一定的抑制作用,而HNB對LAMP反應沒有抑制作用。
現常用來檢測金黃色葡萄球菌的目的基因為耐熱核酸酶基因,即nuc基因[13],但有研究發現其他少數葡萄球菌也具有耐熱核酸酶基因[14],導致檢測結果出現假陽性。本研究中利用實驗室篩選出的金黃色葡萄球菌特異性靶點基因SAR0395[15]建立一種可視化LAMP檢測方法,該可視化LAMP不需要昂貴的設備且操作簡單,可以在設備較落后的地區進行金黃色葡萄球菌的快速檢測,同時該可視化LAMP可以結合酶標儀進行金黃色葡萄球菌的高通量檢測。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
本研究所涉及到菌株包括46 株金黃色葡萄球菌和24 株非金黃色葡萄球菌。其中標準菌株分別購買于中國工業微生物菌種保藏中心(CICC)、廣東省微生物菌種保藏中心(GIMCC)、美國菌種保藏中心(ATCC)、中國醫學細菌菌種保藏管理中心(CMCC)(表1),其他菌株為南京農業大學食品科技學院酶工程實驗室保藏。

表1 實驗所用菌株Table 1 Strains used in this study
1.1.2 培養基與試劑
培養基 北京陸橋技術股份有限公司;Bst2.0 WarmStart? DNA聚合酶、MgSO4NEB(北京)有限公司;甜菜堿 上海源葉生物科技有限公司;HNB上海麥克林生化科技有限公司;基因組提取試劑盒美國OMEGA Bio-Tek公司;100 bp Marker 廣州東盛生物科技有限公司;dNTP Mixture 生工生物工程(上海)股份有限公司。
1.2 儀器與設備
T1300II級生物安全柜 賽默飛世爾科技公司;PTC-100TMPCR擴增儀 美國MJ Research公司;A10干式恒溫器 杭州龍揚科學儀器有限公司;PowerPac?HC高電流電泳儀 美國Bio-Rad公司;JS-380c全自動數碼凝膠成像分析儀 上海培清科技有限公司;Nanodrop2000核酸濃度測定儀 賽默飛世爾科技公司。
1.3 方法
1.3.1 引物設計
以實驗室篩選的金黃色葡萄球菌高特異性序列SAR0395為靶基因[15],通過在線引物設計軟件Primer Explorer V5(http://primerexplorer.jp/lampv5e/index.html)設計LAMP引物,引物序列見表2,引物由金斯瑞生物科技有限公司負責合成。
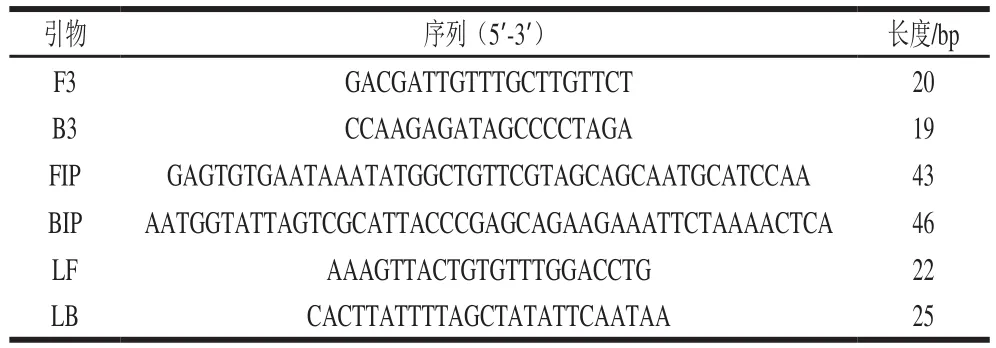
表2 LAMP反應引物Table 2 LAMP reaction primers
1.3.2 基因組提取方法
革蘭氏陽性細菌基因組提取方法:使用商品化的OMEGA基因組提取試劑盒并按其說明提取制備模板DNA。
革蘭氏陰性細菌基因組提取方法:取2 mL菌液放入1.5 mL離心管中,12 000 r/min離心2 min,保留沉淀;加入無菌水1 mL吹打混勻,12 000 r/min離心2 min,棄上清液;然后加TE緩沖液(pH 8.0)100 μL混勻,置100 ℃煮沸10 min,冰上冷卻10 min,12 000 r/min離心2 min,取上清液為DNA模板,-20 ℃備用。
1.3.3 初始LAMP反應方法
參照一般LAMP反應體系[16],本研究原始LAMP反應體系如下:外側引物(F3和B3)各0.2 μmol/L,內側引物(FIP和BIP)各1.6 μmol/L,dNTPs終濃度1.5 mmol/L,Mg2+終濃度6.0 mmol/L,1×ThermoPol buffer(20 mmol/L Tris-HCl,50 mmol/L KCl,10 mmol/L (NH4)2SO4,2 mmol/L MgSO4,0.1% TritonX-20,pH 8.8,25 ℃),Bst2.0 WarmStart? DNA聚合酶終濃度0.32 U/μL,1 μL DNA模板,加水補足20 μL。20 μL滅菌石蠟油進行液封。
反應條件:60 ℃,保溫1 h。檢測方法:取10 μL反應產物和上樣緩沖液混合后,2%凝膠電泳檢測。
1.3.4 LAMP反應的建立及優化
以金黃色葡萄球菌GIM1.771的基因組為模板進行LAMP體系的優化。分別設置不同溫度、Mg2+濃度、內引物濃度、酶添加量、dNTPs濃度、甜菜堿濃度[17]進行LAMP反應體系的優化,反應結果通過2%凝膠電泳進行檢測,選擇最佳的反應體系。
1.3.5 LAMP反應可視化方法的建立
HNB是一種Mg2+指示劑,可以添加到LAMP體系中作為顯色劑,LAMP反應前后顏色由紫色變為天藍色。按照文獻中的LAMP添加體系[18],本研究中向優化的LAMP體系中添加120 μmol/L HNB。實驗設置空白對照和陽性組,觀察顏色變化,同時對反應液進行凝膠電泳檢測。
1.3.6 不同引物添加體系的分析
不同引物添加體系對LAMP分析速度有很明顯的影響,本研究中設置I(B3+FIP+BIP)、II(B3+F3+FIP+BIP)、III(B3+FIP+BIP+LF)、IV(B3+F3+FIP+BIP+LB+LF)、V(B3+F3+FIP+BIP+LF)、VI(B3+FIP+BIP+LB+LF)6 個不同引物添加體系[19],分別進行LAMP反應20、30、40、50、60 min,LAMP反應結果通過觀察顏色變化判定。通過實驗選擇出反應時間較短的LAMP引物添加體系。
1.3.7 可視化LAMP的靈敏度測定
實驗采用兩種方法從不同方面對可視化LAMP的檢測靈敏度進行評價,包括基因組梯度稀釋法和菌落梯度稀釋法。
1.3.7.1 基因組靈敏度測定
測定得到金黃色葡萄球菌基因組質量濃度為103 ng/μL,按照10 倍稀釋梯度進行稀釋,取不同質量濃度基因組進行可視化LAMP檢測,反應時間分別為30 min和60 min,實驗結果通過觀察顏色變化判斷。
1.3.7.2 菌落靈敏度測定
將過夜培養的金黃色葡萄球菌GIM1.771用生理鹽水進行10 倍系列稀釋。用稀釋平板法,測定純培養物活菌數;同時從每稀釋濃度菌液中取1 mL菌液提取基因組,取不同菌落梯度的基因組進行可視化LAMP檢測,LAMP反應時間為30 min和60 min,實驗結果通過觀察顏色變化判斷。
1.3.8 可視化LAMP的特異性測定
將46 株金黃色葡萄球菌和24 株非金黃色葡萄球菌接種到新鮮培養基中過夜培養提取基因組,取提取的基因組進行可視化LAMP檢測,LAMP反應時間為60 min,實驗結果通過觀察顏色變化判斷。以上實驗均設置3 次重復。
2 結果與分析
2.1 LAMP反應的建立與優化
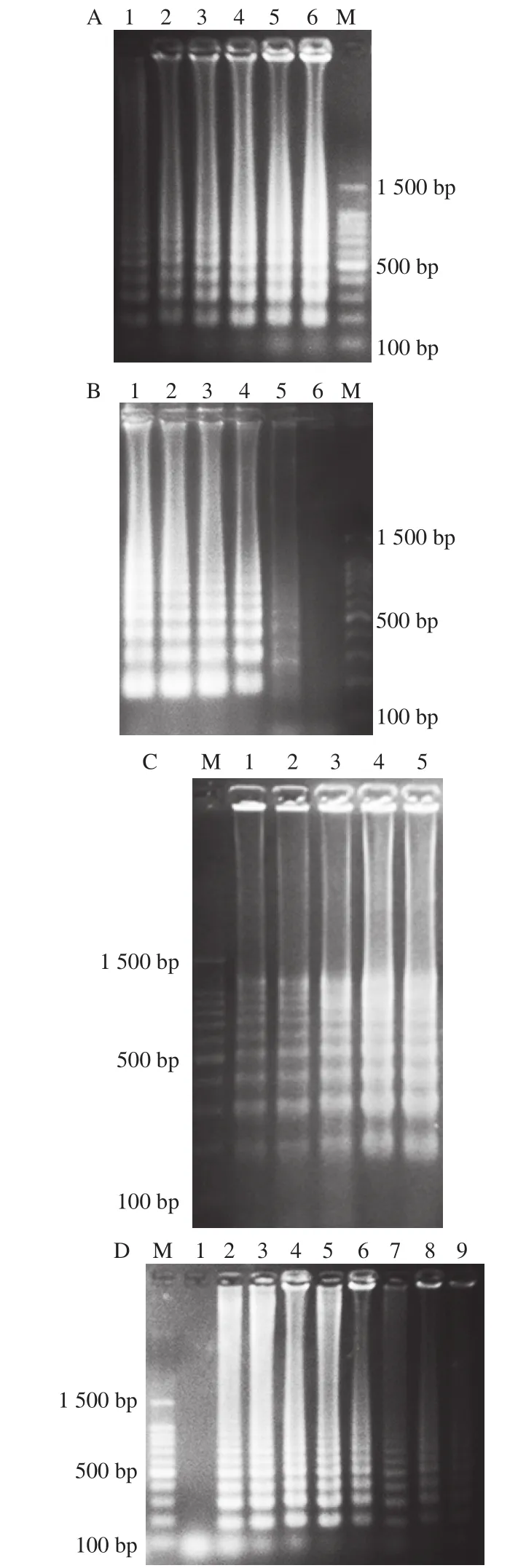

圖1 LAMP體系的優化Fig. 1 Optimization of LAMP reaction conditions
根據初始LAMP體系建立金黃色葡萄球菌的LAMP檢測方法,對溫度、Mg2+濃度、內引物濃度、酶添加量、dNTPs濃度、甜菜堿濃度進行優化。從圖1A可以發現,60、61、62 ℃條件下的梯形條帶較其他溫度亮,且60、61、62 ℃條件下的梯形條帶亮度沒有顯著性差異,考慮到簡易加熱裝置的加熱時間,選擇LAMP反應溫度為60 ℃。從圖1B可以看出,dNTPs濃度為1、1.5、2、2.5 mmol/L時,LAMP反應結果優于dNTPs濃度為0.5 mmol/L時的LAMP反應結果,且它們之間沒有顯著差異,因此選擇LAMP反應的dNTPs濃度為1 mmol/L。從圖1C可以看出,酶添加量為0.4 U/μL和0.48 U/μL時,LAMP反應結果較好且它們之間無顯著差異,同時從經濟的角度出發,選擇LAMP反應的酶含量為0.4 U/μL。從圖1D可以看出,Mg2+含量過低或過高都會影響LAMP反應,Mg2+濃度為1、2、3、4 mmol/L時,LAMP反應結果無顯著差異,綜合考慮,選擇LAMP反應的Mg2+濃度4 mmol/L。從圖1E可以看出,不同內外引物比對LAMP反應結果的影響不顯著,綜合考慮選擇LAMP反應的內外引物比為8∶1。從圖1F可以看出,甜菜堿濃度為0 mol/L時,凝膠電泳中條帶最亮,添加不同含量甜菜堿以后,電泳條帶反而變暗,這一結果與文獻中報道的甜菜堿可以提高LAMP反應效率的結果相反,在本研究中添加甜菜堿反而不利于LAMP反應的進行,因此在本研究中不添加甜菜堿。
通過LAMP反應的優化,可以得到最優的LAMP添加體系為:外側引物(F3和B3)各0.2 μmol/L,內側引物(FIP和BIP)各1.6 μmol/L,dNTPs終濃度1 mmol/L,Mg2+終濃度4.0 mmol/L,1×ThermoPol buffer(20 mmol/L Tris-HCl,50 mmol/L KCl,10 mmol/L (NH4)2SO4,2 mmol/L MgSO4,0.1% TritonX-20,pH 8.8,25 ℃),Bst2.0 WarmStart? DNA聚合酶終濃度0.4 U/μL,1 μL DNA模板,加水補足20 μL。20 μL滅菌石蠟油進行液封。反應條件:60 ℃、保溫1 h。
2.2 可視化LAMP檢測方法的建立
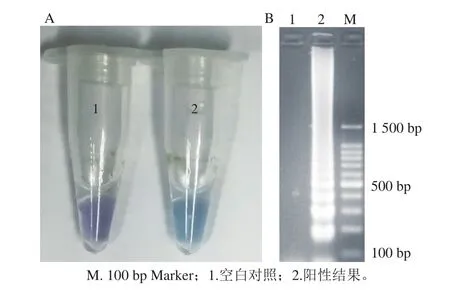
圖2 可視化LAMP顯色結果(A)及其凝膠電泳圖(B)Fig. 2 Visual color of blank control and positive LAMP reaction (A)and corresponding gel electropherograms (B)
在優化過的LAMP反應體系中添加120 μmol/L的HNB,60 ℃反應1 h,可以觀察到LAMP顯色圖(圖2A)的顏色變化,陽性反應管中的液體由紫色變為天藍色,空白對照反應管中的液體保持為紫色;取空白對照反應液和陽性反應液進行凝膠電泳檢測,可以得到電泳圖(圖2B),陽性反應管出現典型的LAMP梯形條帶,空白對照沒有出現電泳條帶;實驗結果說明在LAMP反應體系中添加120 μmol/L的HNB,可以建立一種可視化LAMP;可視化LAMP在60 ℃反應1 h,空白對照的顏色和陽性反應的顏色可以用肉眼清楚辨別。
2.3 不同引物添加體系分析

表3 不同引物組合優化Table 3 Optimization of different primer combinations
通過對不同引物添加體系進行實驗,從表3發現LAMP反應20 min后,引物添加體系IV(B3+F3+FIP+BIP+LB+LF)會發生顏色變化,反應管變為天藍色;V(B3+F3+FIP+BIP+LF)、VI(B3+FIP+BIP+LB+LF)的顏色會在LAMP反應30 min后變為天藍色;I(B3+FIP+BIP)、III(B3+FIP+BIP+LF)的顏色會在LAMP反應40 min后變為天藍色;II(B3+F3+FIP+BIP)的顏色會在LAMP反應60 min后變為天藍色,空白對照顏色一直為紫色。實驗中引物添加體系IV(B3+F3+FIP+BIP+LB+LF)會在反應20 min后,發生顏色的變化,是最優的引物添加體系,本研究中選擇LAMP反應的引物添加體系為IV(B3+F3+FIP+BIP+LB+LF),這一引物添加體系和文獻[20]報道一致。
2.4 可視化LAMP的靈敏度

表4 可視化LAMP靈敏度測定結果Table 4 Sensitivity of LAMP
通過平板計數得到原始菌液的菌落數為1.9×109CFU/mL。如表4所示,可視化LAMP反應30 min以后,其基因組靈敏度可以達到1.03 pg/μL,其菌落靈敏度可以達到1.9×104CFU/mL。這一靈敏度和文獻中報道的靈敏度有一定差距,所以按照文獻[21],將LAMP反應時間設置為60 min。可視化LAMP反應60 min以后,其基因組靈敏度可以達到0.010 3 fg/μL,其菌落靈敏度可以達到1.9 CFU/mL。
2.5 可視化LAMP的特異性

圖3 可視化LAMP特異性檢測結果Fig. 3 Specificity of LAMP
如圖3所示,可視化LAMP反應60 min以后,可以發現46 株金黃色葡萄球菌的反應液顏色變為天藍色,LAMP反應結果為陽性;24 株非金黃色葡萄球菌反應液顏色未變化仍然為紫色,LAMP反應結果為陰性;通過特異性實驗可以證實該可視化LAMP檢測方法具有良好的特異性。
3 討 論
本研究建立了一種針對金黃色葡萄球菌的快速、高靈敏度、高特異性的可視化LAMP檢測方法。目前金黃色葡萄球菌分子檢測常用目的基因為耐熱核酸酶基因(nuc)[22-24],但現在研究發現其他少數葡萄球菌也具有耐熱核酸酶基因[14],可產生耐熱核酸酶,導致檢測結果出現假陽性。同樣地,LAMP檢測技術的研究有很多,但較低的特異性和易交叉污染的特點限制了LAMP的實際應用。為解決以上問題,本研究以金黃色葡萄球菌新型特異性靶基因SAR0395為目標片段,建立了一種特異性高、結果準確且靈敏高的可視化LAMP反應體系。
本研究使用的D N A擴增酶為N E B公司Bst 2.0 WarmStart DNA聚合酶,實驗證明使用該酶時,反應體系建立以后立即進行LAMP反應與25 ℃孵育2 h以后進行LAMP反應獲得的反應結果是一致[25]。因此,使用Bst 2.0 WarmStart DNA聚合酶可以避免在室溫條件下建立反應時所產生的非特異性擴增。
研究表明,LAMP反應開蓋進行凝膠電泳檢測,易造成LAMP反應過程中產生的氣溶膠擴散到環境空氣中,污染實驗環境,造成LAMP反應結果產生大量的假陽性[9,11,26]。這一特點大大影響了LAMP反應的應用,本研究添加20 μL石蠟油于反應液上,可以提高反應體系的密封性,防止樣品之間的交叉污染,避免反應結果的假陽性。在LAMP反應體系中添加HNB,建立可肉眼辨別反應結果的可視化LAMP,可以實現不開蓋進行LAMP結果的觀察,避免開蓋檢測導致的氣溶膠,可以達到避免假陽性的作用。
張濤濤等[27]建立了一種金黃色葡萄球菌LAMP檢測方法,其靈敏度可以達到100 fg/μL;宋濤平等[28]建立了一種金黃色葡萄球菌LAMP可視化快速檢測方法,其靈敏度可以達到0.001 ng/μL;李曉霞等[29]建立了一種原料乳中金黃色葡萄球菌LAMP檢測方法,其靈敏度可以達到67 CFU/mL。本研究中建立的可視化LAMP具有更優的靈敏度,其基因組靈敏度可以達到0.010 3 fg/μL,其菌落靈敏度可以達到1.9 CFU/mL。利用該可視化LAMP對46 株金黃色葡萄球菌和24 株非金黃色葡萄球菌進行檢測,24 株非金黃色葡萄球菌都未出現陽性反應,證實該可視化LAMP具有很好的特異性和可靠性。
本研究建立一種針對金黃色葡萄球菌的可視化LAMP檢測方法,并驗證了其特異性與靈敏度。通過添加HNB、石蠟油和Bst 2.0 WarmStart DNA聚合酶等手段可以有效控制假陽性。本研究中建立的可視化LAMP具有快速、直觀、高靈敏度、高特異性的特點,該可視化LAMP將會成為食品中金黃色葡萄球菌快速檢測的重要手段,為金黃色葡萄球菌的檢測與控制做出重要貢獻。

